Активация проферментов поджелудочной железы
Представленная в разделе информация о лекарственных препаратах, методах диагностики и лечения предназначена для медицинских работников и не является инструкцией по применению.
Профермент — неактивный предшественник фермента. Другие названия: зимоген, проэнзим, энзимоген. Физиологический смысл проферментов заключается в том, чтобы ткани, продуцирующие ферменты, не подвергались воздействию этих самых ферментов. Поэтому акт продукции фермента (профермента) отделен от акта его активации — превращения в фермент. И поэтому проферменты, в основном, встречаются у протеолитических ферментов, расщепляющих белки, в отличие от липолитических ферментов, расщепляющих жиры.
Проферменты желудка
 В физиологии желудка наиболее важны проферменты следующих протеолитических ферментов:
В физиологии желудка наиболее важны проферменты следующих протеолитических ферментов:
- пепсиноген — профермент (предшественник) пепсина
- прогастриксин — профермент гастриксина
- прореннин — профермент реннина
Перечисленные выше три профермента вырабатываются главными клетками слизистой оболочки желудка и активируются в просвете желудка соляной кислотой. Главные клетки желудка в связи с этим также называются «зимогенными».
Главные клетки желудка человека синтезируют несколько изоформ пепсиногенов двух групп: Pgl и Pgll. Первая имеет 7, вторая — 2 изоформы. Клетки, секретирующие пепсиноген Pgl локализуются преимущественно в фундальных железах, Pgll — в пилорических железах и либеркюновых криптах двенадцатиперстной кишки. В кислой среде, при рН < 5,4 и в прямой зависимости скорости реакции от кислотности среды пепсиногены переводятся в изопепсины (до 12 изоформ). Они различаются молекулярным весом, электрофоретической подвижностью, оптимумами рН протеолитической активности и субстратной специфичностью, при разном рН с неодинаковой скоростью гидролизуют разные белки, условиями инактивации. Собственно пепсинами принято называть ферменты, гидролизующие белки с максимальной скоростью при рН 1,5–2. Изофермент пепсина — гастриксин имеет максимум протеолетической активности при кислотности 3,2–3,5 рН. Наличие нескольких изопепсинов позволяет производить гидролиз белков в желудке в широком диапазоне рН (Коротько Г.Ф.).
Проферменты поджелудочной железы
Проферменты протеолитических ферментов трипсиноген, химотрипсиноген, прокарбоксипептидаза и другие синтезируются в поджелудочной железе и в составе панкреатического сока попадает в двенадцатиперстную кишку, где, в щелочной среде, под воздействием фермента двенадцатиперстной кишки энтерокиназы от молекулы трипсиногена удаляется гексапептид и формируется биологически активная структура трипсина. После активации трипсина энтерокиназой начинается процесс автокатализа и трипсин далее выступает в качестве фермента, превращающего проферменты: неактивированный трипсиноген А и В в трипсин, химотрипсиноген — в химотрипсин, прокарбоксипептидазы А и В — в карбоксипептидазу A и карбоксипептидазу В, а также другие проферменты поджелудочной железы: профосфолипазу А21 и проэластазу Е. Из химотрипсиногенов А и В образуются a–, d– и p–химотрипсины, которые тоже обладают свойствами автокатализа, а также более широкой субстратной специфичностью, чем трипсин. Эластаза также активно расщепляет пептидные связи, особенно образованные аминокислотами с небольшими гидрофобными радикалами. Основной субстрат этого фермента – эластин; ни трипсином, ни химотрипсином он не гидролизуется (Сереброва С.Ю.).
Липолитический фермент панкреатическая фосфолипаза секретируется поджелудочной железой в виде профермента и активируется в тонкой кишке трипсином.
Схема активирования панкреатических ферментов (Калинин А.В.)
Профессиональные статьи по физиологии пищеварения, касающиеся проблематики проферментов
- Коротько Г.Ф. Желудочное пищеварение в технологическом ракурсе // Кубанский научный медицинский вестник. – 2006. – № 7-8 (88-89). – с. 17–22.
- Сереброва С.Ю. Перспективы применения ферментных препаратов в гастроэнтерологии // Болезни органов пищеварения. – 2006. – том 8. – № 1. – с. 23–27.
- >Калинин А.В. Нарушение полостного пищеварения и его медикаментозная коррекция // Клинические перспективы в гастроэнтерологии, гепатологии. – 2001. – №3. – с. 21–25.
На сайте GastroScan.ru в разделе «Литература» имеется подраздел «Секреция, пищеварение в ЖКТ», содержащий статьи для профессионалов здравоохранения по данной тематике.
Рисунок «Структура прогастриксина» взят из Википедии. Описание и автор рисунка см. https://commons.wikimedia.org/wiki/File:Protein_PGC_PDB_1avf.png
Назад в раздел
Источник
В
поджелудочной железе синтезируются
проферменты ряда протеаз: трипсиноген,
химотрипсиноген, проэластаза,
прокарбоксипептидазы А и В. В кишечнике
они путём частичного протеолиза
превращаются в активные ферменты
трипсин, химотрипсин, эластазу и
карбок-сипептидазы А и В.
Активация
трипсиногена происходит
под действием фермента эпителия
кишечника энтеропептидазы.
464
Этот
фермент отщепляет с N-конца молекулы
трипсиногена гексапептид Вал-(Асп)4-Лиз.
Изменение конформации оставшейся части
полипептидной цепи приводит к формированию
активного центра, и образуется активный
трипсин. Последовательность Вал-(Асп)4-Лиз
присуща большинству известных
трипсиноге-нов разных организмов — от
рыб до человека.
Образовавшийся
трипсин активирует
химотрипсиноген, из
которого получается несколько активных
ферментов (рис. 9-3). Химотрипсиноген
состоит из одной полипептидной цепи,
содержащей 245 аминокислотных остатков
и пяти дисульфидных мостиков. Под
действием трипсина расщепляется
пептидная связь между 15-й и 16-й
аминокислотами, в результате чего
образуется активный π-химотрипсин.
Затем под действием π-химотрипсина
отщепляется дипептид сер(14)-арг(15), что
приводит к образованию δ-химотрипсина.
Отщепление дипептида тре(147)-арг(148)
завершает образование стабильной формы
активного фермента — α-химотрипсина,
который состоит из трёх полипептидных
цепей, соединённых дисульфидными
мостиками.
Остальные
проферменты панкреатических протеаз
(проэластаза и прокарбоксипептидазы
А и В) также активируются трипсином
путём частичного протеолиза. В результате
образуются активные ферменты — эластаза
и карбокси-пептидазы А и В.
2. Специфичность действия протеаз
Трипсин
преимущественно гидролизует пептидные
связи, образованные карбоксильными
группами аргинина и лизина. Химотрипсины
наиболее активны в отношении пептидных
связей, образованных карбоксильными
группами ароматических аминокислот
(Фен, Тир, Три).
Карбоксипептидазы
А и В — цинксодержащие ферменты, отщепляют
С-концевые остатки аминокислот. Причём
карбоксипептидаза А
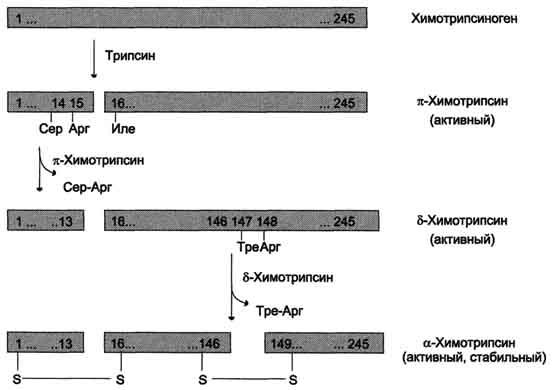
Рис.
9-3. Активация химотрипсиногена. Молекула
химотрипсиногена состоит из 245
аминокислотных остатков и имеет пять
дисульфидных мостиков. На схеме показаны
участки фермента, подвергающиеся
протеолизу. а-Химотрипсин — активная
стабильная форма фермента — состоит из
трёх полипептидных цепей, ковалентно
связанных между собой двумя дисульфидными
мостиками и нековалентно — за счёт
водородных связей и гидрофобных
взаимодействий.
465
отщепляет
преимущественно аминокислоты, содержащие
ароматические или гидрофобные радикалы,
а карбоксипептидаза В — остатки аргинина
и лизина.
Последний
этап переваривания — гидролиз небольших
пептидов, происходит под действием
ферментов аминопептидаз и дипептидаз,
которые синтезируются клетками тонкого
кишечника в активной форме.
Аминопептидазы последовательно
отщепляют N-концевые аминокислоты
пептидной цепи. Наиболее известна
лейцинаминопептидаза — Zn2+-
или Мn2+-содержащий
фермент, несмотря на название, обладающий
широкой специфичностью по отношению
к N-концевым аминокислотам.Дипептидазы расщепляют
дипептиды на аминокислоты, но не
действуют на трипептиды.
В
результате последовательного действия
всех пищеварительных протеаз большинство
пищевых белков расщепляется до свободных
аминокислот.
В.
Защита клеток от действия протеаз
Клетки
поджелудочной железы защищены от
действия пищеварительных ферментов
тем, что:
эти
ферменты образуются
в виде неактивных предшественников в
клетках поджелудочной железы и
активируются только после секреции в
просвет кишечника. Таким образом, место
синтеза и место действия этих ферментов
пространственно разделены.в
клетках поджелудочной железы
присутствует белок-ингибитор
трипсина, образующий
с активной формой фермента (в случае
преждевременной активации) прочный
комплекс.
В
полости желудка и кишечника протеазы
не контактируют с белками клеток,
поскольку слизистая оболочка покрыта
слоем слизи, а каждая клетка содержит
на наружной поверхности плазматической
мембраны полисахариды, которые не
расщепляются протеазами и тем самым
защищают клетку от их действия.
Разрушение
клеточных белков протеазами происходит
при язвенной болезни желудка или
двенадцатиперстной кишки. Однако
начальные механизмы возникновения
язвы ещё мало изучены.
Г.
Транспорт аминокислот в клетки
Аминокислоты,
образовавшиеся при переваривании
белков, быстро всасываются в кишечнике.
Транспорт их осуществляется двумя
путями: через воротную систему печени,
ведущую прямо в печень, и по лимфатическим
сосудам, сообщающимся с кровью через
грудной лимфатический проток. Максимальная
концентрация аминокислот в крови
достигается через 30-50 мин после приёма
белковой пищи (углеводы и жиры замедляют
всасывание аминокислот). Всасывание
L-аминокислот (но не D-изомеров) — активный
процесс, требующий затраты энергии.
Аминокислоты переносятся через кишечную
стенку от слизистой её поверхности в
кровь (рис. 9-4). Перенос через щёточную
кайму осуществляется целым рядом
переносчиков, многие из которых действуют
при участии Nа+-зависимых
механизмов симпорта, подобно переносу
глюкозы (см. раздел 7).
Различная
скорость проникновения аминокислот
через мембраны клеток указывает на
наличие транспортных систем, обеспечивающих
перенос аминокислот как через внешнюю
плазматическую мембрану, так и через
внутриклеточные мембраны. В настоящее
время известно по крайней мере пять
специфических транспортных систем,
каждая из которых функционирует
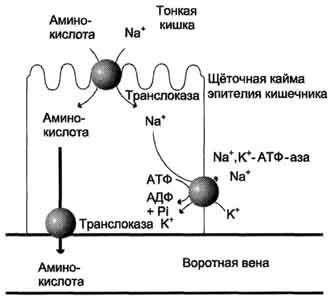
Рис.
9-4. Механизм всасывания аминокислот в
кишечнике. L-аминокислота
поступает в энтероцит путём симпорта
с ионом Na+.
Далее специфическая транслоказа
переносит аминокислоту через мембрану
в кровь. Обмен ионов натрия между
клетками осуществляется путём
первично-активного транспорта с помощью
Nа+,К+-АТФ-азы.
466
для
переноса определённой группы близких
по строению аминокислот:
нейтральных,
с короткой боковой цепью (аланин, серии,
треонин);нейтральных,
с длинной или разветвлённой боковой
цепью (валин, лейцин, изолейцин);с
катионными радикалами (лизин, аргинин);с
анионными радикалами (глутаминовая и
аспарагиновая кислоты);иминокислот
(пролин, оксипролин).
Причём
к числу Nа+-зависимых
относятся переносчики аминокислот,
входящих в первую и пятую группы, а
также переносчик метионина. Независимые
от Na+ переносчики
специфичны для некоторых нейтральных
аминокислот (фенилаланин, лейцин) и
аминокислот с катионными радикалами
(лизин).
Аминокислоты
конкурируют друг с другом за специфические
участки связывания. Например, всасывание
лейцина (если концентрация его достаточно
высока) уменьшает всасывание изолейцина
и валина.
Одна
из специфических транспортных систем
для некоторых нейтральных аминокислот
функционирует в кишечнике, почках и,
по-видимому, мозге. Она получила название
γ-глутамильного цикла (рис. 9-5).
В
этой системе участвуют 6 ферментов,
один из которых находится в клеточной
мембране, а остальные — в цитозоле.
Ключевую роль в транспорте аминокислоты
играет мембранно-связан-ный фермент
γ-глутамилтрансфераза. Этот
фермент является гликопротеином и
катализирует перенос γ-глутамильной
группы от глутатиона (иногда другого
γ-глутамильного пептида) на транспортируемую
аминокислоту и последующий перенос
комплекса в клетку. Глутатион представляет
собой трипептид — γ-глутамилцистеинилглицин,
который находится во всех тканях
животных. Реакция протекает следующим
образом (см. схему А на с. 468).
Аминокислота,
связанная с γ-глутамильным остатком,
оказывается внутри клетки. В следующей
реакции происходит отщепление
γ-глутамильного
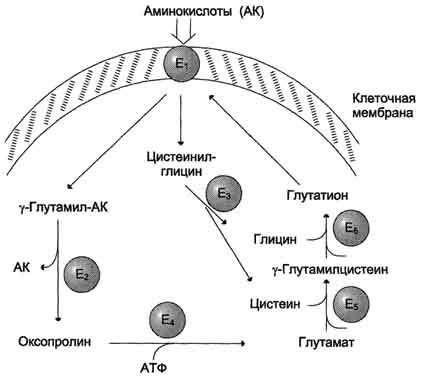
Рис.
9-5. γ-Глутамильный
цикл. Система
состоит из одного мембранного и пяти
цитоплазматических ферментов. Перенос
аминокислоты внутрь клетки осуществляется
в комплексе с глутамильным остатком
глутатиона под действием
γ-глутамилтрансферазы. Затем аминокислота
освобождается, а γ-глутамильный остаток
в несколько стадий превращается в
глутатион, который способен присоединять
следующую молекулу аминокислоты. Е1 —
γ-глутамилтрансфераза; Е2 —
у-глутамилциклотрансфераза; Е3 —
пептидаза; Е4 —
оксопролиназа; Е5 —
γ-глутамилцистеинсинтетаза; Е6 —
глутатионсинтетаза.
467
остатка
под действием фермента
γ-глутамилциклотрансферазы (см. схему
Б).
Дипептид
цистеинилглицин расщепляется под
действием пептидазы на 2 аминокислоты
— цис-теин и глицин. В результате этих
3 реакций происходит перенос одной
молекулы аминокислоты в клетку (или
внутриклеточную структуру). Следующие
3 реакции обеспечивают регенерацию
глутатиона, благодаря чему цикл
повторяется многократно. Для транспорта
в клетку одной молекулы аминокислоты
с участием γ-глутамильного цикла
затрачиваются 3 молекулы АТФ.
Д.
Нарушение переваривания белков и
транспорта аминокислот
Небольшую
долю продуктов переваривания белка
составляют негидролизованные короткие
пептиды. У некоторых людей возникает
иммунная реакция на приём белка, что,
очевидно, связано со способностью к
всасыванию
таких
пептидов. Продукты полностью переваренного
белка (аминокислоты) лишены антигенных
свойств и иммунных реакций не вызывают.
У
новорождённых проницаемость слизистой
оболочки кишечника выше, чем у взрослых,
поэтому в кровь могут поступать антитела
молозива (секрет молочных желёз,
выделяющийся в первые дни после родов,
обогащённый антителами и антитоксинами).
Это усугубляется наличием в молозиве
белка — ингибитора трипсина. Протеолитические
ферменты в пищеварительных секретах
новорождённых обладают низкой
активностью. Всё это способствует
всасыванию в кишечнике небольшого
количества нативных белков, достаточного
для обеспечения иммунной реакции.
Очевидно, подобное усиление всасывающей
способности кишечника является причиной
наблюдаемой иногда непереносимости
белков пищи (например, молока и яиц) у
взрослых людей.
Гниение
Известно,
что микроорганизмы кишечника
для своего роста также нуждаются в
доставке с пищей определенных аминокислот.
Микрофлора кишечника располагает
набором ферментных систем, отличных
от соответствующихферментов животных тканей и
катализирующих самые разнообразные
превращения пищевых аминокислот.
В кишечнике создаются оптимальные
условия для образования ядовитых
продуктов
распада аминокислот: фенола,индола, крезола, скатола, сероводорода,
метилмер-каптана, а также нетоксичных
для организма соединений: спиртов, аминов, жирных
кислот,кетокислот, оксикислот и
др.
Все
эти превращения аминокислот,
вызванные деятельностью микроорганизмовкишечника,
получили общее название «гниение белков в
кишечнике». Так, в процессе
распада серосодержащих
аминокислот (цистин, цистеин, метионин)
в кишечнике образуются сероводород H2S
и метил-меркаптан CH3SH.
Диаминокислоты – орнитин и лизин –
подвергаются процессудекарбоксилирования с
образованием аминов –
путресцина и кадаверина.
Из
ароматических аминокислот: фенилаланин, тирозин и триптофан –
при аналогичном
бактериальном декарбоксилировании образуются
соответствующие амины: фенилэтиламин,
параоксифенилэтиламин (или тира-мин)
и индолилэтиламин (триптамин).
Кроме того, микробные ферментыкишечника
вызывают постепенное разрушение боковых
цепей циклическихаминокислот,
в частности тирозина и триптофана,
с образованием ядовитых продуктов
обмена – соответственно крезола и фенола, скатола и индола.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
Пепсиноген(гл.кл.желудка)
под HCl
в пепсин/гастриксин(стимулирует выр-ку
HCl).Далее
пепсиноген акт-ся образовавшимся ранее
пепсином-аутокатализТрипсиноген(ациноциты
поджел.ж.) под энтеропептидазой,Ca2+
в трипсин.Происходит в ТНК под действием
панкреатического сока.Далее трипсиноген
акт-ся образовавшимся ранее трипсиномХимотрипсиноген(А,В)
под трипсином в пи-химотрипсин(активный),
затем в сигма-химотрипсин, затем в
альфа-химотрипсин. Последние 2 этапа
также кат-ся образовавшимся
химотрипсином.Это дело в ТНК.Проэластаза
под трипсином в ТНК в эластазуПрокарбоксипептидаза(поджелудочная)
под трипсином в ТНК в карбоксипептидазу(А-разрывает
связи ароматических АК в крупных
пептидах или В-разрывает С-конц. ЛИЗ и
АРГ)Проаминопептидаза(кишечник)
под трипсином в аминопептидазу(разрывает
Т-конц. связь с АЛА и ЛЕЙ)
Био.значение-чтобы
расщепить белки до свободных АК, а
главное подготовить химус к его
дальнейшему путешествию по ЖКТ.
5.Пепсин, роль, методы количественного определения.
Под
действием гастринов в главных клетках
желудочных желёз стимулируются синтез
и секреция пепсиногена — неактивной
формы пепсина. Пепсиноген — белок,
состоящий из одной полипептидной цепи
с молекулярной массой 40 кД. Под действием
НСl он превращается в активный пепсин
(молекулярная масса 32,7 кД) с оптимумом
рН 1,0-2,5. В процессе активации в результате
частичного протеолиза от N-конца молекулы
пепсиногена отщепляются 42 аминокислотных
остатка, которые содержат почти все
положительно заряженные аминокислоты,
имеющиеся в пепсиногене. Таким образом,
в активном пепсине преобладающими
оказываются отрицательно заряженные
аминокислоты, которые участвуют в
конформационных перестройках молекулы
и формировании активного центра.
Образовавшиеся под действием НСl активные
молекулы пепсина быстро активируют
остальные молекулы пепсиногена
(аутокатализ). Пепсин в первую очередь
гидролизует пептидные связи в белках,
образованные ароматическими аминокислотами
(фенилаланин, триптофан, тирозин) и
несколько медленнее — образованные
лейцином и дикарбоновыми аминокислотами.
Пепсин — эндопептидаза, поэтому в
результате его действия в желудке
образуются более короткие пептиды, но
не свободные аминокислоты.
Он:
кат-ет
гидролиз пептидных связей, обр-ных
остатками ароматических АКрасщепляет
почти все природные белки, кроме
кератинов,протаминов,гистонов и
мукопротеинову
взрослых сворачивает молоко(переход
казеиногена в казеин).У детишек этим
занимается реннинактивизируется
при рН=1-2
Определение
по способу Метта(стекл. труббочки с
белком опускают в емкость с
жел.соком.оставляют при 37 градусах на
4 часа в термостате перевариваться под
действием пепсина)
6.Экзопептидазы.Их роль в переваривании белков.
Экзопептидазы-
протеазы, кот. кат-ют разрывают концевые
пептидные связи с высвобождением
концевой АК и содержатся в кишечном
соке
Карбоксипептидазы
А и В — цинксодержащие ферменты, отщепляют
С-концевые остатки аминокислот. Причём
карбоксипептидаза Аотщепляет
преимущественно аминокислоты, содержащие
ароматические или гидрофобные радикалы,
а карбоксипептидаза В — остатки аргинина
и лизина.Они синтезируются в поджел.ж.
и акт-ся трипсином в ТНКАминопептидазы
последовательно отщепляют N-концевые
аминокислоты пептидной цепи. Наиболее
известна лейцинаминопептидаза — Zn2+-
или Мn2+-содержащий фермент, несмотря
на название, обладающий широкой
специфичностью по отношению к N-концевым
аминокислотам.И ее подруга
аланинаминопептидаза-отвечает за
разрыв N-конц.
АЛА.Они синтезируются в кишечнике и
там же октивируются трипсином.
7.
Протеиназы поджелудочной железы.
Панкреатит,
В
поджелудочной железе синтезируются
проферменты ряда протеаз: трипсиноген,
химотрипсиноген, проэластаза,
прокарбоксипептидазы А и В. В кишечнике
они путём частичного протеолиза
превращаются в активные ферменты
трипсин, химотрипсин, эластазу и
карбоксипептидазы А и В.
Трипсиноген
под действием энтеропептидазы(отщепляет
с N конца вал, асп4, лиз), Са2+ в трипсин.
Далее трипсин самостоятельно активирующий
трипсиноген.
Химотрипсин под
трипсином( разрывает связь между 15 и 16
АК) в пи-химотрипсин, далее разрывается
связь между 14 и 15 АК и получается сигма-
химотрипсин.Отщепление дипептида
тре(147)-арг(148) завершает образование
стабильной формы активного фермента —
α-химотрипсина, который состоит из трёх
полипептидных цепей, соединённых
дисульфидными мостиками.
Остальные
проферменты панкреатических протеаз
(проэластаза и прокарбоксипептидазы А
и В) также активируются трипсином путём
частичного протеолиза. В результате
образуются активные ферменты — эластаза
и карбокси-пептидазы А и В.А разрывает
связи ароматических АК в крупных
пептидах, а В С-концевые ЛИЗ и АРГ.
При
остром отеке поджелудочной железы в
крови повышается активность трипсина,
липазы и фосфолипазы. Геморрагический
панкреатит сопровождается дальнейшим
увеличением активности трипсина и
липазы. Некротический панкреатит
характеризуется значительным повышением
активности фосфолипазы.
Панкреатические
энзимы вызывают лабилизацию мембран
лизосом и выход лизосомальных ферментов
в кровяное русло. Об этом свидетельствует
увеличение активности катепсинов и
кислой фосфатазы, возрастающее по мере
развития острого панкреатита и достигающее
наибольших величин при некротической
форме заболевания.
8.
Соляная кислота, механизм секреции,
роль в пищеварении.
Соляную
кислоту продуцируют париетальные
(обкладочные) клетки фундальных желёз
желудка при участии Н+/К+-АТФазы. Фундальные
(главные) железы составляют основную
часть желёз области дна и тела
желудка.
Концентрация продуцированной
соляной кислоты одинакова и равна 160
ммоль/л, но кислотность выделяющегося
желудочного сока варьируется за счет
изменения числа функционирующих
париеталь ных клеток и нейтрализации
соляной кислоты щелочными компонентами
желудочного сока. Чем быстрее секреция
соляной кислоты, тем меньше она
нейтрализуется и тем выше кислотность
желудочного сока.
Соляная кислота
присутствует в желудке и до начала
процесса пищеварения. Несмотря на то,
что на базальную секрецию (то есть
секрецию натощак) влияют многие факторы,
её величина в желудке у каждого человека
практически постоянна и у здоровых
людей не превышает 5-7 ммоль в час.
3
фазы:
Секреция соляной кислоты
начинается ещё до попадания пищи в
желудок. Первую фазу секреции (т. н.
цефалическую) запускают запах, вид и
вкус пищи, воздействие которых передаётся
от центральной нервной системы на клетки
желудка через иннервирующие желудок
нервные окончания.
2 фаза секреции —
желудочная, начинается после попадания
пищи в желудок. Растяжение желудка
запускает выделение гастрина из G-клеток,
расположенных в антральном отделе
желудка. Гастрин, воздействуя на
париетальные клетки напрямую или через
активацию ECL-клеток с высвобождением
гистамина, стимулирует продукцию соляной
кислоты.
3 фаза секреции — кишечная —
запускается при попадании пищи в
двенадцатиперстную кишку и её
растяжении.
Функции:
1.способствует
денатурации и набуханию белков в желудке,
что облегчает их последующее расщепление
пепсинами;
2.активирует пепсиногены
и превращает их в пепсины;
3.создает
кислую среду, необходимую для действия
ферментов желудочного сока;
4.обеспечивает
антибактериальное действие желудочного
сока;
5.способствует нормальной
эвакуации пищи из желудка: открытию
пилорического сфинктера со стороны
желудка и закрытию со стороны
двенадцатиперстной кишки;
6.возбуждает
панкреатическую секрецию.
Кислотность
определяется за счет нсl: ph в норме=
1-2
Гиперхлоргидрия: набл язва
прободающая, ( самоперевар нсl истончает
стенку на бол пов-ти), гастрит.
Гипохлогидрия:(
понижен Кислотность. Пониж пепсин)-
хеликобактер, стафилококк, мал язвы по
всему желудку( бугрист поверх), неспец
язвен колит.
9.
Кислотность жел сока, виды, определение
по методу михаэлиса, клинич.
Знач.
Желудочный
сок рН 1,5—1,8— сложный по составу
пищеварительный сок, вырабатываемый
различными клетками слизистой оболочки
желудка.
В жел соке в норме присутствует
свободная HCL, кот
-создает кислую
срубу в желудке,
-активирует
пепсиноген и создает ph-оптимум для
действия пепсина, денатурирует пищ
белки,
— регулирует работу
привратника
-обладает бактерицидным
действием.
Часть нсl связывается
с белками и продуктами их гидролиза-
связанная HCL. Со свободной она обр общую
HCL
В жел соек присут орг кисл и
кислые фосфаты- это кислореагирующие
продукты. Они вместе с общей HCL дают
общую Кислотность жел сока, кот опред
методом титрования 0.1н гидроксидом Na.
При титровании всех видов кислотности
жел сока в одной пробе исп два индикатора:
фенолФталеин( одноцветный индикатор с
зоной перехода 8-10,2) и парадиметиламидоазобензол(
2хцветный с зоной перехода 2,9-4,0)- как
выполняется метод подробно в методичке
стр 6.
3 вида кислотности: повышен, пониж
и норм
Гиперхлоргидрия: набл язва
прободающая, ( самоперевар нсl истончает
стенку на бол пов-ти), гастрит.
Гипохлогидрия:(
понижен Кислотность. Пониж пепсин)-
хеликобактер, стафилококк, мал язвы по
всему желудку( бугрист поверх), неспец
язвен колит.
10.
Диагностическое значение биохимического
анализа желуд и дуоденального
соков.
Основной
целью зондирований желудка является
получение желудочного сока и последующий
его анализ. Диагностическая информация,
получаемая при анализе желудочного
сока, помогает в диагностике таких
заболеваний как гастрит, язвенная
болезнь желудка, опухоли жулудка, болезнь
Золлингера-Эллисона.
Двенадцатиперстная
кишка – основное место процесса
пищеварения. Анализ содержимого
двенадцатиперстной кишки позволяет
диагностировать заболевания печени,
желчевыводящей системы, поджелудочной
железы. Кроме того, в дуоденальном
содержимом могут быть выявлены лямблии,
описторхи, яйца печеночной, кошачьей и
китайской двуусток и др.
11.
Всасывание АК, поступление АК в клетки
тканей.
После
того, как в просвете кишечника завершается
гидролитическое расщеплениее белков,
продукты этого расщепления (аминокислоты
и олигопептиды) захватываются энтероцитами
.
Всасывание аминокислот протекает с
участием стереоспецифичных натрий-зависимых
систем активного транспорта , расположенных
в мембране энтероцита, обращенной в
просвет кишечника. L-изомеры аминокислот
переносятся легче, чем D-изомеры
аминокислот . В настоящее время обнаружены
четыре системы переноса аминокислот:
1.
система переноса нейтральных аминокислот
( валина , фенилаланина , аланина ),
2.
система переноса основных аминокислот
( аргинина , цистеина , лизина , орнитина
),
3. система переноса глицина и
иминокислот ( пролина , гидроксипролина
),
4. система переноса дикарбоновых
кислот ( глутаминовой кислоты и аспарагина
).
Аминокислоты высвобождаются из
энтероцита в области его базальной и
боковых поверхностей. В их высвобождении
участвуют многие механизмы пассивного
транспорта — диффузия, облегченная
диффузия и активный транспорт . В
дальнейшем аминокислоты поступают в
кровь и переносятся по портальной
системе в печень .
Белки пищи начинают
расщепляться в желудке под действием
пепсина . Завершают их гидролиз в основном
ферменты поджелудочной железы :
эндопептидазы ( трипсин , химотрипсин
) и экзопептидазы ( карбоксипептидазы
, аминопептидазы ). В итоге образуются
олигопептиды, дипептиды и
аминокислоты.
Олигопептиды гидролизуются
олигопептидазами щеточной каемки .
Дипептидазы же находятся как в щеточной
каемке , так и в цитоплазме энтероцита
. Дипептиды всасываются быстрее
аминокислот, и, вероятно, их транспорт
идет иначе.
Итак, гидролиз белков до
аминокислот идет в 3 местах: в просвете
кишки, в щеточной каемке и в цитоплазме
энтероцита.
Существует несколько
систем транспорта аминокислот:
— для
моноаминомонокарбоновых аминокислот
(имеется общий белок-переносчик, за
который аминокислоты, на пример триптофан
и аланин, конкурируют друг с другом);
—
для диаминомонокарбоновых аминокислот
(аргинина, лизина и орнитина), а также
цистина;
— для иминокислот (пролина и
гидроксипролина);
— для моноаминодикарбоновых
аминокислот (аспарагиновой и
глутаминовой).
Некоторые аминокислоты
могут связываться с разными
белками-переносчиками, например, глицин
— с переносчиками как моноаминомонокарбоновых
аминокислот, так и иминокислот. Почти
во всех случаях всасывание аминокислот
происходит путем котранспорта с
натрием.
В связи с наличием общих
систем переноса при наследственных
болезнях нарушен транспорт сразу
нескольких аминокислот: при цистинурии
— цистина, аргинина, лизина и орнитина;
при хартнуповской болезни —
моноаминомонокарбоновых аминокислот,
особенно триптофана, фенилаланина и
гистидина. Всасывание дипептидов при
этом не страдает. В двенадцатиперстной
и тощей кишках всасывание идет быстро,
в подвздошной — медленно.
12.биохимические
механизмы регуляции пищеварения, гормоны
ЖКт
Процесс
пищеварения, заключающийся, как известно,
в гидролизе пищевых веществ по ходу
желудочно-кишечного тракта, всасывании
продуктов гидролиза, в основном в форме
мономеров, из кишечника в кровь и лимфу
и транспортировке их к местам депонирования
и утилизации, обеспечивается рядом
функций (секреторной, моторной
ферментативной, и др.), а также их
координацией во времени и пространстве
с помощью многообразных центральных и
местных механизмов регуляции
А
дальше по этой схеме короч:
Название
гормона. Место выработки гормона. Типы
эндокринных клеток. Эффект действия
гормонов. Соматостатин.
Желудок, проксимальный отдел тонкой
кишки, поджелудочная железа D-клетки
Тормозит выделение инсулина и глюкагона,
большинства известных желудочно-кишечных
гормонов (секретина, ГИПа, мотилина,
гастрина); тормозит активность париетальных
клеток желудка и ацинарных клеток
поджелудочной железы
Вазоактивный
интестинальный (ВИП) пептид.
Во всех отделах желудочно-кишечного
тракта D-клетки Тормозит действие
холецистокинина, секрецию соляной
кислоты и пепсина желудком, стимулированную
гистамином, расслабляет гладкие мышцы
кровеносных сосудов, желчного пузыря
Панкреатический
полипептид (ПП)
Поджелудочная железа D2-клетки Антагонист
ХЦК-ПЗ, усиливает пролиферацию слизистой
оболочки тонкой кишки, поджелудочной
железы и печени; участвует в регуляции
обмена углеводов и липидов
Гастрин.
Антральная часть желудка, поджелудочная
железа, проксимальный отдел тонкой
кишки G-клетки Стимулирует секрецию И
выделение пепсина желудочными железами,
возбуждает моторику расслабленного
желудка и двенадцатиперстной кишки, а
также желчного пузыря
Секретин
.Тонкий кишечник S-клетки Стимулирует
секрецию бикарбонатов и воды поджелудочной
железой, печенью, железами Бруннера,
пепсина; тормозит секрецию в желудке
Холецистокинин-панкреозимин
(ХЦК-ПЗ)
Тонкий кишечник I-клетки Возбуждает
выход ферментов и в слабой степени
стимулирует выход бикарбонатов
поджелудочной железой, тормозит секрецию
соляной кислоты в желудке, усиливает
сокращение желчного пузыря и желчевыделение,
усиливает моторику тонкой кишки
Энтероглюкагон.
Тонкий кишечник ЕС1-клетки Тормозит
секреторную активность желудка, снижает
в желудочном соке содержание К+ и повышает
содержание Са2+, тормозит моторику
желудка и тонкой кишки
Мотилин.
Проксимальный отдел тонкой кишки
ЕС2-клетки Возбуждает секрецию пепсина
желудком и секрецию поджелудочной
железы, ускоряет эвакуацию содержимого
желудка
Гастроингибирующий
пептид (ГИП).
Тонкий кишечник К-клетки Тормозит
выделение соляной кислоты и пепсина,
высвобождение гастрина, моторику
желудка, возбуждает секрецию толстой
кишки
Субстанция
Р.
Тонкая кишка ЕС1-клетки Усиливает
моторику кишечника, слюноотделение,
тормозит высвобождение инсулина
Вилликинин.
Двенадцатиперстная кишка ЕС1-клетки
Стимулирует ритмические сокращения
ворсинок тонкой кишки
Энтерогастрон
.Двенадцатиперстная кишка ЕС1-клетки
Тормозит секреторную активность и
моторику желудка
Серотони.н
Желудочно-кишечный
тракт ЕС1,ЕС2-клетки Тормозит выделение
соляной кислоты в желудке, стимулирует
выделение пепсина, активирует секрецию
поджелудочной железы, желчевыделение,
кишечную секрецию
Гистамин.
Желудочно-кишечный тракт ЕС2-клетки
Стимулирует выделение секрета желудка
и поджелудочной железы, расширяет
кровеносные капилляры, оказывает
активирующее влияние на моторику желудка
и кишечника
Инсулин
.Поджелудочная
железа Бета-клетки Стимулирует транспорт
веществ через клеточные мембраны,
способствует утилизации глюкозы и
образованию гликогена, тормозит липолиз,
активирует липогенез, повышает
интенсивность синтеза белка
Глюкагон
.Поджелудочная железа Альфа-клетки
Мобилизует углеводы, тормозит секрецию
желудка и поджелудочной железы, тормозит
моторику желудка и кишечника
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник


