Активация проферментов в клетках поджелудочной железы
В
поджелудочной железе синтезируются
проферменты ряда протеаз: трипсиноген,
химотрипсиноген, проэластаза,
прокарбоксипептидазы А и В. В кишечнике
они путём частичного протеолиза
превращаются в активные ферменты
трипсин, химотрипсин, эластазу и
карбок-сипептидазы А и В.
Активация
трипсиногена происходит
под действием фермента эпителия
кишечника энтеропептидазы.
464
Этот
фермент отщепляет с N-конца молекулы
трипсиногена гексапептид Вал-(Асп)4-Лиз.
Изменение конформации оставшейся части
полипептидной цепи приводит к формированию
активного центра, и образуется активный
трипсин. Последовательность Вал-(Асп)4-Лиз
присуща большинству известных
трипсиноге-нов разных организмов — от
рыб до человека.
Образовавшийся
трипсин активирует
химотрипсиноген, из
которого получается несколько активных
ферментов (рис. 9-3). Химотрипсиноген
состоит из одной полипептидной цепи,
содержащей 245 аминокислотных остатков
и пяти дисульфидных мостиков. Под
действием трипсина расщепляется
пептидная связь между 15-й и 16-й
аминокислотами, в результате чего
образуется активный π-химотрипсин.
Затем под действием π-химотрипсина
отщепляется дипептид сер(14)-арг(15), что
приводит к образованию δ-химотрипсина.
Отщепление дипептида тре(147)-арг(148)
завершает образование стабильной формы
активного фермента — α-химотрипсина,
который состоит из трёх полипептидных
цепей, соединённых дисульфидными
мостиками.
Остальные
проферменты панкреатических протеаз
(проэластаза и прокарбоксипептидазы
А и В) также активируются трипсином
путём частичного протеолиза. В результате
образуются активные ферменты — эластаза
и карбокси-пептидазы А и В.
2. Специфичность действия протеаз
Трипсин
преимущественно гидролизует пептидные
связи, образованные карбоксильными
группами аргинина и лизина. Химотрипсины
наиболее активны в отношении пептидных
связей, образованных карбоксильными
группами ароматических аминокислот
(Фен, Тир, Три).
Карбоксипептидазы
А и В — цинксодержащие ферменты, отщепляют
С-концевые остатки аминокислот. Причём
карбоксипептидаза А
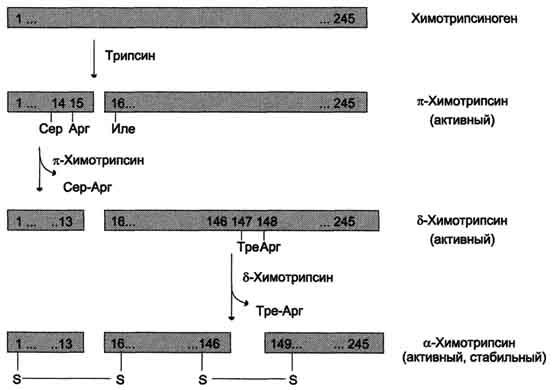
Рис.
9-3. Активация химотрипсиногена. Молекула
химотрипсиногена состоит из 245
аминокислотных остатков и имеет пять
дисульфидных мостиков. На схеме показаны
участки фермента, подвергающиеся
протеолизу. а-Химотрипсин — активная
стабильная форма фермента — состоит из
трёх полипептидных цепей, ковалентно
связанных между собой двумя дисульфидными
мостиками и нековалентно — за счёт
водородных связей и гидрофобных
взаимодействий.
465
отщепляет
преимущественно аминокислоты, содержащие
ароматические или гидрофобные радикалы,
а карбоксипептидаза В — остатки аргинина
и лизина.
Последний
этап переваривания — гидролиз небольших
пептидов, происходит под действием
ферментов аминопептидаз и дипептидаз,
которые синтезируются клетками тонкого
кишечника в активной форме.
Аминопептидазы последовательно
отщепляют N-концевые аминокислоты
пептидной цепи. Наиболее известна
лейцинаминопептидаза — Zn2+-
или Мn2+-содержащий
фермент, несмотря на название, обладающий
широкой специфичностью по отношению
к N-концевым аминокислотам.Дипептидазы расщепляют
дипептиды на аминокислоты, но не
действуют на трипептиды.
В
результате последовательного действия
всех пищеварительных протеаз большинство
пищевых белков расщепляется до свободных
аминокислот.
В.
Защита клеток от действия протеаз
Клетки
поджелудочной железы защищены от
действия пищеварительных ферментов
тем, что:
эти
ферменты образуются
в виде неактивных предшественников в
клетках поджелудочной железы и
активируются только после секреции в
просвет кишечника. Таким образом, место
синтеза и место действия этих ферментов
пространственно разделены.в
клетках поджелудочной железы
присутствует белок-ингибитор
трипсина, образующий
с активной формой фермента (в случае
преждевременной активации) прочный
комплекс.
В
полости желудка и кишечника протеазы
не контактируют с белками клеток,
поскольку слизистая оболочка покрыта
слоем слизи, а каждая клетка содержит
на наружной поверхности плазматической
мембраны полисахариды, которые не
расщепляются протеазами и тем самым
защищают клетку от их действия.
Разрушение
клеточных белков протеазами происходит
при язвенной болезни желудка или
двенадцатиперстной кишки. Однако
начальные механизмы возникновения
язвы ещё мало изучены.
Г.
Транспорт аминокислот в клетки
Аминокислоты,
образовавшиеся при переваривании
белков, быстро всасываются в кишечнике.
Транспорт их осуществляется двумя
путями: через воротную систему печени,
ведущую прямо в печень, и по лимфатическим
сосудам, сообщающимся с кровью через
грудной лимфатический проток. Максимальная
концентрация аминокислот в крови
достигается через 30-50 мин после приёма
белковой пищи (углеводы и жиры замедляют
всасывание аминокислот). Всасывание
L-аминокислот (но не D-изомеров) — активный
процесс, требующий затраты энергии.
Аминокислоты переносятся через кишечную
стенку от слизистой её поверхности в
кровь (рис. 9-4). Перенос через щёточную
кайму осуществляется целым рядом
переносчиков, многие из которых действуют
при участии Nа+-зависимых
механизмов симпорта, подобно переносу
глюкозы (см. раздел 7).
Различная
скорость проникновения аминокислот
через мембраны клеток указывает на
наличие транспортных систем, обеспечивающих
перенос аминокислот как через внешнюю
плазматическую мембрану, так и через
внутриклеточные мембраны. В настоящее
время известно по крайней мере пять
специфических транспортных систем,
каждая из которых функционирует
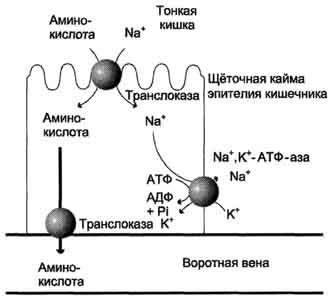
Рис.
9-4. Механизм всасывания аминокислот в
кишечнике. L-аминокислота
поступает в энтероцит путём симпорта
с ионом Na+.
Далее специфическая транслоказа
переносит аминокислоту через мембрану
в кровь. Обмен ионов натрия между
клетками осуществляется путём
первично-активного транспорта с помощью
Nа+,К+-АТФ-азы.
466
для
переноса определённой группы близких
по строению аминокислот:
нейтральных,
с короткой боковой цепью (аланин, серии,
треонин);нейтральных,
с длинной или разветвлённой боковой
цепью (валин, лейцин, изолейцин);с
катионными радикалами (лизин, аргинин);с
анионными радикалами (глутаминовая и
аспарагиновая кислоты);иминокислот
(пролин, оксипролин).
Причём
к числу Nа+-зависимых
относятся переносчики аминокислот,
входящих в первую и пятую группы, а
также переносчик метионина. Независимые
от Na+ переносчики
специфичны для некоторых нейтральных
аминокислот (фенилаланин, лейцин) и
аминокислот с катионными радикалами
(лизин).
Аминокислоты
конкурируют друг с другом за специфические
участки связывания. Например, всасывание
лейцина (если концентрация его достаточно
высока) уменьшает всасывание изолейцина
и валина.
Одна
из специфических транспортных систем
для некоторых нейтральных аминокислот
функционирует в кишечнике, почках и,
по-видимому, мозге. Она получила название
γ-глутамильного цикла (рис. 9-5).
В
этой системе участвуют 6 ферментов,
один из которых находится в клеточной
мембране, а остальные — в цитозоле.
Ключевую роль в транспорте аминокислоты
играет мембранно-связан-ный фермент
γ-глутамилтрансфераза. Этот
фермент является гликопротеином и
катализирует перенос γ-глутамильной
группы от глутатиона (иногда другого
γ-глутамильного пептида) на транспортируемую
аминокислоту и последующий перенос
комплекса в клетку. Глутатион представляет
собой трипептид — γ-глутамилцистеинилглицин,
который находится во всех тканях
животных. Реакция протекает следующим
образом (см. схему А на с. 468).
Аминокислота,
связанная с γ-глутамильным остатком,
оказывается внутри клетки. В следующей
реакции происходит отщепление
γ-глутамильного
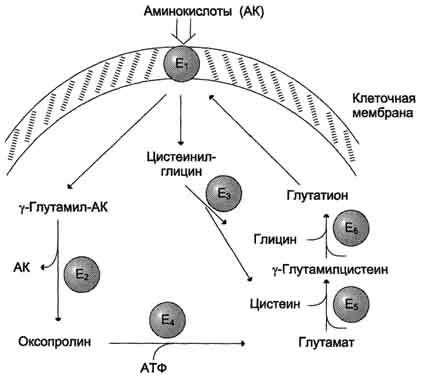
Рис.
9-5. γ-Глутамильный
цикл. Система
состоит из одного мембранного и пяти
цитоплазматических ферментов. Перенос
аминокислоты внутрь клетки осуществляется
в комплексе с глутамильным остатком
глутатиона под действием
γ-глутамилтрансферазы. Затем аминокислота
освобождается, а γ-глутамильный остаток
в несколько стадий превращается в
глутатион, который способен присоединять
следующую молекулу аминокислоты. Е1 —
γ-глутамилтрансфераза; Е2 —
у-глутамилциклотрансфераза; Е3 —
пептидаза; Е4 —
оксопролиназа; Е5 —
γ-глутамилцистеинсинтетаза; Е6 —
глутатионсинтетаза.
467
остатка
под действием фермента
γ-глутамилциклотрансферазы (см. схему
Б).
Дипептид
цистеинилглицин расщепляется под
действием пептидазы на 2 аминокислоты
— цис-теин и глицин. В результате этих
3 реакций происходит перенос одной
молекулы аминокислоты в клетку (или
внутриклеточную структуру). Следующие
3 реакции обеспечивают регенерацию
глутатиона, благодаря чему цикл
повторяется многократно. Для транспорта
в клетку одной молекулы аминокислоты
с участием γ-глутамильного цикла
затрачиваются 3 молекулы АТФ.
Д.
Нарушение переваривания белков и
транспорта аминокислот
Небольшую
долю продуктов переваривания белка
составляют негидролизованные короткие
пептиды. У некоторых людей возникает
иммунная реакция на приём белка, что,
очевидно, связано со способностью к
всасыванию
таких
пептидов. Продукты полностью переваренного
белка (аминокислоты) лишены антигенных
свойств и иммунных реакций не вызывают.
У
новорождённых проницаемость слизистой
оболочки кишечника выше, чем у взрослых,
поэтому в кровь могут поступать антитела
молозива (секрет молочных желёз,
выделяющийся в первые дни после родов,
обогащённый антителами и антитоксинами).
Это усугубляется наличием в молозиве
белка — ингибитора трипсина. Протеолитические
ферменты в пищеварительных секретах
новорождённых обладают низкой
активностью. Всё это способствует
всасыванию в кишечнике небольшого
количества нативных белков, достаточного
для обеспечения иммунной реакции.
Очевидно, подобное усиление всасывающей
способности кишечника является причиной
наблюдаемой иногда непереносимости
белков пищи (например, молока и яиц) у
взрослых людей.
Гниение
Известно,
что микроорганизмы кишечника
для своего роста также нуждаются в
доставке с пищей определенных аминокислот.
Микрофлора кишечника располагает
набором ферментных систем, отличных
от соответствующихферментов животных тканей и
катализирующих самые разнообразные
превращения пищевых аминокислот.
В кишечнике создаются оптимальные
условия для образования ядовитых
продуктов
распада аминокислот: фенола,индола, крезола, скатола, сероводорода,
метилмер-каптана, а также нетоксичных
для организма соединений: спиртов, аминов, жирных
кислот,кетокислот, оксикислот и
др.
Все
эти превращения аминокислот,
вызванные деятельностью микроорганизмовкишечника,
получили общее название «гниение белков в
кишечнике». Так, в процессе
распада серосодержащих
аминокислот (цистин, цистеин, метионин)
в кишечнике образуются сероводород H2S
и метил-меркаптан CH3SH.
Диаминокислоты – орнитин и лизин –
подвергаются процессудекарбоксилирования с
образованием аминов –
путресцина и кадаверина.
Из
ароматических аминокислот: фенилаланин, тирозин и триптофан –
при аналогичном
бактериальном декарбоксилировании образуются
соответствующие амины: фенилэтиламин,
параоксифенилэтиламин (или тира-мин)
и индолилэтиламин (триптамин).
Кроме того, микробные ферментыкишечника
вызывают постепенное разрушение боковых
цепей циклическихаминокислот,
в частности тирозина и триптофана,
с образованием ядовитых продуктов
обмена – соответственно крезола и фенола, скатола и индола.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
Механизм активации профермента [c.160]
Механизм активации профермента 160 [c.231]
| Рис. 6.4. Активация профермента путем гидролиза специфических пептидных связей. |  |
Какие ферменты гидролизуют пептидные связи в молекулах белков В чем состоит механизм активации проферментов (на примере трипсина) [c.396]
Преждевременная активация проферментов в секреторных клетках происходит при [c.229]
Активные формы белков П. к. представляют собой сериновые протеолитич. ферменты, у к-рых каталитич. участок активного центра расположен в С-концевых областях тяжелых цепей молекулы. После активации проферментов (в результате элиминирования пептидных фрагментов) С-концевая область ферментов остается связанной с N-концевым доменом дисульфидными связями, благодаря чему осуществляется оптимальная ориентация белков на мембране клетки. Исключение-фермент тромбин, к-рый в результате активации протромбина лишается домена, содержащего Са -связывающие участки. [c.129]
При острых панкреатитах, а также в результате травмы поджелудочной железы происходит активация проферментов в клетках поджелудочной железы. [c.231]
Активация профермента трипсиногена в кищечнике идет не только под действием энтерокиназы, но и под действием активных форм этого же фермента (трипсина), при этом отщепляются полипептиды (гексапептид). Активация некоторых других ферментов идет по аналогичной схеме. [c.137]
Свертывание крови как каскад реакций активации проферментов [c.166]
Важная особенность явления активации проферментов состоит в том, что в ряде случаев она осуществляется тем же ферментом, который в результате этой активации образуется. Таким образом, весь процесс является аутокаталитическим и его скорость очень быстро возрастает (в частности, пепсиноген способен активироваться пепсином). Вся эта согласованная система активации ферментов — очень важное свойство живого организма, которое можно рассматривать как приспособление, предотвращающее самопереварйвание тканей, вырабатывающих данные ферменты. Иначе трудно было бы себе представить, каким образом способны сосуществовать в живой клетке волки и овцы — ферменты и те субстраты, на которые они воздействуют. [c.51]
Наличие высокоэффективного способа активации трипсина, вероятно, обусловлено тем, что в кишечнике перевариваются и сами протеазы их убыль восполняется продолжающейся секрецией и активацией проферментов. [c.333]
Химотрипсин. В поджелудочной железе синтезируется ряд химотрип-синов (а-, 3- и л-химотрипсины) из двух предшественников—химотрипсиногена А и химотрипсиногена В. Активируются проферменты в кишечнике под действием активного трипсина и химотрипсина. Полностью раскрыта последовательность аминокислот химотрипсиногена А, во многом сходная с последовательностью аминокислот трипсина. Молекулярная масса его составляет примерно 25000. Он состоит из одной полипептидной цепи, содержащей 246 аминокислотных остатков. Активация профермента не сопряжена с отщеплением большого участка молекулы (см. рис. 4.3). Получены доказательства, что разрыв одной пептидной связи между аргинином и изолейцином в молекуле химотрипсиногена А под действием трипсина приводит к формированию л-химотрипсина, обладающего наибольшей ферментативной активностью. Последующее отщепление дипептида Сер—Арг приводит к образованию б-химотрипсина. Аутокаталитический процесс активирования, вызванный химотрипсином, сначала способствует формированию неактивного промежуточного неохимотрипсина, который под действием активного трипсина превращается в а-химотрип-син этот же продукт образуется из б-химотрипсина, но под действием активного химотрипсина. [c.421]
Химотрипсин, Химотрипсин (КФ 3.4.21.1) секретируется вфор-ме профермента — химотрипсиногена поджелуд очной железой позвоночных животных активация профермента происходит в двенадцатиперстной кишке под действием трипсина. Физиологическая функция химотрипсина — гидролиз белков и полипептидов. Химотрипсин атакует преимущественно пептидные связи, образованные карбоксильными группами остатков тирозина, триптофана, фенилаланина и метионина. Он эффективно гидролизует также сложные эфиры соответствующих аминокислот. Молекулярная масса химотрипсина равна 25 ООО, молекула его содержит 241 аминокислотный остаток. Химотрипсин образован тремя полипептидными цепями, которые связаны дисульфидными мостиками. Первичная структура фермента установлена Б. Хартли в 1964 г. [c.197]
Л5, Преждевременная активация проферментов может приводить к летальному исходу, в частности при панкреатите [c.165]
Активация белка-предшественника путем разрыва пептидной связи-это один из основных способов регуляции, свойственный различным биологическим системам. Сейчас мы рассмотрим роль активации проферментов при образовании кровяного сгустка, представляющем собой один из трех механизмов гемостаза. Два других способа регуляции-это быстрое сужение поврежденного сосуда и агрегация тромбоцитов на его стенке для защиты поврежденной поверхности сосуда. [c.166]
Скорость катализа карбоксипептидазой А возрастает благодаря смещению электронов 148 Заключение 149 Вопросы и задачи 151 Г лава 8. Активация проферментов пищеварительные ферменты и факторы свертывания крови 152 [c.231]
Каталитич. св-ва ферментов усиливаются путем их комплексообразования с кофакторами или регуляторными белками на пов-сти клеточных мембран. К ним отиосят фактор VIII-кофактор фактора 1Х , фактор V-кофактор фактора X ,, тканевый фактор (ТФ)-кофактор фактора VII , протеин S и тромбомодулин-кофактор протеина СИ . Регуляторные белки обеспечивают оптимальную локализацию ферментов вблизи соответствующих субстратов, благодаря чему скорость активации проферментов увеличивается в десятки тысяч раз и более. [c.129]
Существенной для Т. является способность сорбировать положительно заряженные соед. и нек-рые белки (ингибиторы). В этом случае Т. теряет каталитич. активность. Последнее существенно в физиол. отношении, т.к. взаимод. с белковым панкреатич. ингибитором исключает активацию профермента непосредственно в поджелудочной железе и его автолиз. [c.639]
В заключение следует отметить, что функционирование всех факторов свертывания крови и белков системы фАбрииолиза осуществляется на основе некоторых общих принципов активации проферментов, или зимогеиов (превращение неактивного предшественника в активный фермент). Сравнение структур ряда факторов свертывания кровн показывает, что протеолитическим действием во всех случаях обладают С-концевые фрагменты, содержащие около 250 аминокислотных остатков, которые обнаруживают выраженную структурную гомологию как между собой, так и с другими [c.237]
Активация проферментов различных протеаз изучена в неодинаковой степени наиболее подробно исследованы активационные превращения трипсиногена, химотрипсиногена и прокарбоксипептидазы А, т. е. протеолитических ферментов поджелудочной железы. В пищеварительной системе их изменения не происходят изолированно, поскольку один из проферментов (трипсиноген) образует фермент, интенсивно активирующий другие предшественники. Сок поджелудочной железы остается неактивным, пока энтерокиназа не превратит трипсиноген в трипсин действие ее является пусковым моментом для всей системы. Далее начинается быстрая активация всех предшественников, которая происходит с резким ускорением, по автокаталитическо-му типу. Причина такого хода процесса в том, что трипсин образуется в результате автокатализа, поскольку он превращает все новые порции трипсиногена в трипсин. Активация других проферментов не является автокаталитической реакцией она происходит под действием трипсина, количество которого стремительно растет. [c.94]
Для обнаружения предшественников а1 тивных протеолитических Ферментов вначале приходится инкубировать электрофореграммы с ферментом, катализирующим активацию проферментов. Так, для активации трипсииогена можно применить энтерокиназу, а для активации химотрипсиногена — трипсин [304]. [c.304]
Поток энергии и вещества (в виде атомов углерода) в ходе метаболизма зависит от процессов синтеза ферментов и активации проферментов. Однако процессы эти необратимы. Как и все белки млекопитающих, ферменты распадаются на аминокислоты (обновление белков). В бактериальных клетках активность фермента может разбавляться из-за распределения его среди дочерних клеток, образующихся в результате последовательных делений. Хотя оба механизма приводят к уменьшению концентрации фермента и как следствие к уменьшению каталитической активности, идут такие процессы медленно и сопровождаются большими затратами вещества представим себе по аналогии, что мы выключали бы свет, разбивая лампочку, а затем, чтобы снова его включить, вкручивали бы новую лампочку. Ясно, что гораздо эффективнее регулировать активность фермента, включая и выключая его. Каталитическая актюность некоторых ключевых ферментов действительно регулируется с помощью низкомолекулярных метаболитов (см. гл. 6). Низкомолекулярные модуляторы, подавляющие ферментативную активность, называют отрицательными модуляторами, а повышающие ее—положительными. Мы рассмотрим их в гл. 10 и в последующих главах. [c.90]
Например, комплексом Xa.Va активируется не только фактор II, но и сам фактор X. Некоторые факторы способны к аутоактивации. Обычно один из субстратов фермента системы свертывания крови является основным, а по отношению к другим возможным субстратам активность ниже. Однако при инициации свертывания роль дополнительных путей активации проферментов может быть заметной. [c.512]
Активация белков в результате протеолитического расщепления одной или нескольких пептидных связей-широко распространенный механизм регуляции в биологических системах. Если белок в активированной форме является ферментом, то его неактивный предшественник называется проферментом (или зимогеном). Наиболее изученный процесс активации профермента — это превращение химотрипсиногена в химотрипсин, происходящее следующим путем. Под действием трипсина пептидная связь между остатками 15 и 16 в молекуле химотрипсиногена разрывается и в результате образуется химотрипсин. Возникшая при этом новая концевая аминогруппа изолейцина-16 загибается внутрь молекулы белка, где электростатически связывается с аспартатом-194. Это взаимодействие служит пусковым механизмом для ряда локальных изменений конформации, конечный результат которых — формирование кармана для связывания ароматических (либо больших неполярньгк) боковых цепей субстрата. Кроме того, формируется полость оксианиона, стабилизирующая переходное состояние. [c.176]
Активация проферментов играет также ведущую роль в регуляции свертывания крови. Поразительная особенность процесса свертывания состоит в том, что он организован как каскад превращений проферментов, в котором активированная форма одного фактора свертывания катализирует активацию следующего. Свертывание крови происходит в результате взаимодействия двух последовательностей реакций, получивших название внешнего и внутреннего механизмов. Оба механизма необходимы для нормального свертывания крови. Они сливаются в общий механизм, приводящий к формированию фибринового сгустка. Фибрин образуется из фибриногена, высокорастворимого белка плазмы, путем гидролиза четырех пептидных связей между остатками аргинина и глицина. Катализирует эту реакцию тромбин — фермент, сходный с трипсином. В результате гидролиза от фибриногена отщепляются два А-пептида и два В-пептида, на долю которых приходится около 3% молекулы фибриногена. Образующийся в результате мономер фибрина спонтанно полимеризуется в длинные [c.176]
Биохимия Том 3 (1980) — [
c.0
]
Источник


