Блокада рака поджелудочной железы
I. Операция. Операбельный рак поджелудочной железы диагностируется лишь у
5-20% больных.
Виды операций:
— Панкреатодуоденальная резекция (
операция Уиппла
и ее модификации) — стандартная операция, применимая лишь при раке
головки поджелудочной железы.
— Панкреатодуоденальная резекция с сохранением привратника часто
применяется в США; она достоверно снижает риск
демпинг-синдрома
, не ухудшая выживаемости.
— Расширенная лимфаденэктомия популярна в Японии, но не нашла широкого
признания в США из-за повышения риска осложнений и отсутствия
рандомизированных испытаний, указывавших бы на улучшение выживаемости.
— Резекция поджелудочной железы не улучшает результаты по сравнению с
панкреатодуоденальной резекцией.
— Панкреатэктомия вызывает недостаточность экзокринной функции железы и
неконтролируемый
сахарный диабет
и оправдана лишь тогда, когда без нее остается опухоль в крае резекции.
Летальность и осложнения. В опытных руках летальность при
панкреатодуоденальной резекции не превышает 5%. Тем не менее в целом по США
она составляет 18%. У 20-35% больных возникают тяжелые осложнения, включая
сепсис
,
абсцесс
,
кровотечение
,
желчные свищи
и
панкреатические свищи
.
Паллиативные операции (холецистоеюностомия, холедохоеюностомия) устраняют
механическую желтуху, но выживаемость после них составляет в среднем 5 мес,
летальность же, по данным больших наблюдений, достигает 20%. Желтуху можно
устранить путем эндоскопической установки стента: процедура удается у 85%
больных при летальности, равной 1-2%, достоверно сокращаются сроки
восстановления и госпитализации по сравнению с паллиативной операцией.
Рандомизированное испытание не выявило разницы в выживаемости при установке
стента и наложении обходного анастомоза, но в первом случае чаще
требовалась повторная госпитализация из-за обструкции стента, рецидива
желтухи и холангита.
II. Адъювантная терапия после радикальной операции представляется
оправданной. Ее влияние на выживаемость показало рандомизированное
испытание, проведенное в 1980-х гг. и включившее 43 больных после
радикальной панкреатодуоденальной резекции: на фоне лучевой терапии и
фторурацила медиана выживаемости составила 20 мес и 3 больных из 21 прожили
5 лет и более, тогда как без адъювантной терапии медиана выживаемости была
11 мес и лишь один больной из 22 прожил 5 лет и дольше. Пятилетняя
выживаемость составила 40% у больных без метастазов в лимфоузлы и менее 5%
при их наличии. Адъювантная терапия
гемцитабином
и
фторурацилом
сравнивалась в недавнем испытании RTOG-9704 (обе группы получали также
лучевую терапию на фоне фторурацила).
III. Лечение местнораспространенных опухолей:
— Лучевая терапия на фоне фторурацила (по 15 мг/кгв/вв первые 3 сут и в
последние 3 сут облучения) достоверно повышала медиану выживаемости по
сравнению с одной лучевой терапией (10 мес и 5,5 мес). Некоторые
предпочитают струйному введению фторурацила длительную в/в инфузию, однако
эти схемы при раке поджелудочной железы не сравнивались.
— Интраоперационное облучение потоком электронов. Опухоль напрямую
облучают небольшим полем, без воздействия на радиочувствительный кишечник.
Медиана выживаемости составила до 13 мес (выше, чем в исторической
контрольной группе) при хорошем местном эффекте, 5% больных прожили 3-8
лет. Уменьшение боли отмечается в 50-90% случаев.
IV. Паллиативная химиотерапия. Частота ремиссий на фоне фторурацила
составляет от 0 до 20%. В испытании, включившем 126 больных, гемцитабин был
более эффективен: он чаще, чем фторурацил, вызывал ремиссию, приносил
симптоматический эффект и достоверно увеличивал медиану выживаемости (с
4,41 до 5,65 мес, Р= 0,0025). Более медленное введение гемцитабина (10
мг/м2/мин, тогда как обычно вся доза вводится за 30 мин) повышает его
эффективность, но усиливает токсичность. Препарат оказывает
радиосенсибилизирующее действие и испытывается вместе с облучением при
неоперабельных опухолях и в качестве адъювантной терапии. Определенной
активностью обладают и другие препараты (включая
митомицин
,
доксорубицин
,
стрептозоцин
и
ифосфамид
), но полихимиотерапия пока не показала явных преимуществ перед
монохимиотерапией. Продолжаются испытания новых схем.
V. Блокада чревного сплетения. Из-за инвазии чревного сплетения рак
поджелудочной железы часто вызывает
постоянную ноющую боль в животе
и
постоянную ноющую боль в спине
, которая бывает крайне мучительной и требует высоких доз наркотических
анальгетиков, прежде всего
морфина длительного действия
. Блокаду чревного сплетения следует выполнять при пробных операциях,
вводя по 25 мл 6% фенола или 50% этанола справа и слева от чревного ствола.
Более 80% больных отмечают уменьшение боли. Сообщалось, что столь же
эффективна чрескожная блокада чревного узла; к ней можно прибегнуть в тех
случаях, когда не проводилась интраоперационная блокада или не было
операции. Возможна преходящая
ортостатическая гипотония
. В отсутствие эффекта и при возобновлении боли можно повторить блокаду.
VI. Другие симптоматические мероприятия. Плохой аппетит, уменьшение
калорийности пищи и нарушение всасывания вызывают
кахексию
у больных раком поджелудочной железы. Улучшить аппетит помогает суспензия
мегестрола
, до 800 мг/сут. Бывают полезны высококалорийные питательные смеси.
Нарушение всасывания жиров
, вызванное недостаточностью экзокринной функции железы, компенсируют
ферментами поджелудочной железы. При
асците
по возможности используют
диуретики
, показания к лапароцентезу следует ограничить: на фоне кахексии удаление
богатой белками асцитической жидкости способно усугубить нарушения
белкового обмена.
Смотрите также:
Источник
Рак поджелудочной железы (РПЖЖ) — это одно из самых смертельных заболеваний среди солидных опухолей. Ежегодно регистрируется более 250000 смертей от рака поджелудочной железы. Он является восьмой по частоте причиной смерти от злокачественных новообразований у мужчин и женщин во всем мире, а заболеваемость РПЖЖ варьируется от 1 до 10 случаев на 100000 человек. Проблема рака поджелудочной железы актуальна в современной медицине, так как большинство пациентов с локальным или метастатическим РПЖЖ не являются кандидатами на лечебную резекцию из-за чрезвычайно неблагоприятного прогноза.
Несмотря на огромный прогресс в лечении других злокачественных опухолей благодаря прорыву в иммунотерапии рака, лечение рака поджелудочной железы развивалось медленно в течение последних двух десятилетий. Неэффективность иммунотерапии РПЖЖ объясняется несколькими факторами, в том числе слабой иммуногенностью опухоли (мутантные белки, экспрессируемые на поверхности опухолевых клеток РПЖЖ, обладают слабыми антигенными свойствами, по сравнению, к примеру, с антигенами меланомы или рака легкого), а также наличием иммуносупрессивных свойств как у самой опухоли, так и у ее микроокружения. Не последнюю роль в резистентности к терапии играет десмопластическая строма опухоли, состоящая из фибробластов, клеток поджелудочной железы, иммунных клеток, кровеносных сосудов и белков внеклеточного матрикса. Помимо уже упомянутых иммуносупрессивных свойств, она играет роль физического барьера, препятствующего доставке терапевтических агентов к опухолевым клеткам. Взаимодействие опухолевых клеток с микроокружением может приводить как к усилению роста опухоли и подавлению иммунного ответа на нее, так и к нарушению ее развития, что делает опухолевое микроокружение хорошей целью для терапевтического воздействия. Совокупностью этих факторов обосновывается неэффективность традиционной иммунотерапии. Это поднимает необходимость разработки и внедрения новых, улучшенных способов лечения РПЖЖ с помощью различных иммунологических методик, а также подготовки комбинированных схем терапии с применением различных препаратов или иных методов (например, лучевая терапия).
Устранение иммуносупрессивных свойств опухолей — это один из зарекомендовавших себя подходов в иммунотерапии рака. Ингибирование иммуносупрессивных молекул CTLA-4 и PD-1 — неплохой метод, который проявил себя в лечении таких видов рака как меланома, уротелиальная карцинома, рак почки, гепатоцеллюлярный рак и др. CTLA-4 (цитотоксический лимфоцитарный антиген 4) представляет собой ингибирующий рецептор, локализующийся на CD4+ и CD8+ лимфоцитах. Его экспрессия повышена в опухолях, и было показано, что блокада CTLA-4 вызывает противоопухолевый иммунный ответ. Препарат ипилимумаб — это человеческое моноклональное антитело, нацеленное на CTLA-4. Однако несмотря на его эффективность в терапии других опухолей, клинические испытания ипилимумаба в терапии РПЖЖ не показали эффективных результатов. Другой супрессивной молекулой является programming death 1 (PD-1, рецептор запрограммированной смерти 1). Он экспрессируется на эффекторных Т-лимфоцитах, B-лимфоцитах, NK-клетках и Treg. При связывании со своим лигандом PD-1L этот рецептор активирует ингибирование активации и пролиферации лимфоцитов. Терапия моноклональными антителами против PD-1 (препараты пембролизумаб и ниволумаб) также была эффективна при лечении солидных опухолей, таких как меланома, рак почки и урогенитальная карцинома. Также применяются моноклональные антитела против PD-1L (атезолизумаб). Однако клинические испытания на РПЖЖ не показали эффективности данных методов.
Другим подходом к лечению злокачественных новообразований является стимуляция собственного иммунитета организма пациента с помощью противоопухолевых вакцин. Такие вакцины предназначены для увеличения представления опухолевых антигенов и активации антигенспецифичных эффекторных Т-лимфоцитов и Т-клеток памяти. Выявлено несколько антигенов, которые экспрессируются в большинстве опухолей поджелудочной железы, как например карциноэмбриональный антиген (СЕА), муцин-1 (MUC-1) и белок, кодируемый мутированным геном KRAS. В настоящее время несколько вакцин были испытаны для терапии РПЖЖ. GVAX — это клеточная вакцина, в которой модифицированные клетки рака поджелудочной железы экспрессируют гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF). Фаза I клинических испытаний показала безопасность данной вакцины, однако эффект от терапии был неоднозначный. Несмотря на то, что не было выявлено улучшения однолетней и общей выживаемости в группах пациентов, получавших данную вакцину в сочетании с химиолучевой терапией, и пациентов, получавших только адъювантную лучевую терапию, подгруппа пациентов с длительной безрецидивной выживаемостью показала увеличение опухолеспецифичных CD8+ Т-лимфоцитов после вакцинации. Это демонстрирует, что данная методика может использоваться в отношении некоторой группы пациентов. Другой тип вакцин, на основе опухолевых пептидов, также был исследован. Вакцина на основе мутантного белка KRAS, который мутирует больше чем в 90 % случаев РПЖЖ, давала появление иммунного ответа у 58 % пациентов, причем медиана выживаемости среди таких пациентов была в два раза выше, чем у группы, не развивших иммунный ответ. Другая мультипептидная вакцина OCV-C01, содержащая фрагменты рецептора фактора роста эндотелия сосудов 1 и 2 (VEGFR1 и VEGFR2 соответственно), а также белка семейства кинезина (KIF20A), была исследована на пациентах с РПЖЖ. 58,6 % испытуемых показали развитие иммунного ответа на KIF20A, что сопровождалось значительным улучшением безрецидивной выживаемости. Данные результаты свидетельствуют о перспективности использования противоопухолевых вакцин и необходимости установления новых антигенных детерминант, более специфичных для РПЖЖ.
Хорошие результаты вакцин и важность иммуносупрессивных свойств микроокружения опухоли для успешной терапии дают обоснования для комбинирования данных методик в терапии РПЖЖ. Клиническое исследование комбинированной терапии ипилимумабом и вакциной GVAX показало эффективность данного подхода, по сравнению с монотерапией ипилимумабом, а также безопасность данного сочетания препаратов. Эффективной оказалась и комбинация GVAX с ингибиторами PD-1, которая демонстрировала значительное увеличение средней общей выживаемости по сравнению с монотерапией. В группе пациентов, получавших оба препарата, обнаруживалось увеличение CD8+ T-лимфоцитов, продуцирующих IFN-gamma. Было показано, что пациенты, получавшие GVAX за 2 недели до резекции опухоли, демонстрировали увеличение уровня PD-L1, что указывает на один из механизмов иммунорезистентности. Таким образом, комбинация вакцин и ингибиторов иммуносупрессивных молекул является обоснованной и перспективной схемой терапии, требующей дальнейших исследований.
Новым подходом к лечению РПЖЖ являются методики, воздействующие на определенный компоненты стромы рака поджелудочной железы, о роли которой в резистентности к терапии было упомянуто ранее. Мезенхимальная строма РПЖЖ содержит большое количество фибробластов, продуцирующих белок-α активирующий фибробласты (FAP-α). Высокая экспрессия этого белка коррелирует с худшим прогнозом заболевания. В эксперименте на мышах ликвидация клеток, экспрессирующих FAP-α, повышала эффективность противоопухолевых вакцин. Эффективными оказались и комбинации данной методики с анти-CTLA-4 и анти-PD-L1 препаратами. Другое исследование было направлено на блокаду рецептора колониестимулирующего фактора 1 (CSF1R), который экспрессируется на ассоциированных с опухолью М2-макрофагах и супрессорных миелоидных клетках (MDSC). Данные клетки обладают способностью блокировать цитотоксический иммунный ответ. Ингибирование CSF1R в сочетании с химиотерапией улучшает противоопухолевый иммунитет. В мышиной модели трансплантации РПЖЖ лечение ингибиторами CSF1R приводило к усилению инфильтрации опухоли Т-клетками, однако эти клетки демонстрировали повышенные уровни CTLA-4, а также наблюдалось усиление экспрессии PD-L1 в опухоле. Этот факт делает обоснованным сочетание ингибиторов CSF1R и анти-CTLA-4, анти-PD-L1 препаратов. IMC-CS4 является CSF1R-антителом, которое в настоящее время проходит клинические испытания в сочетании с GVAX и анти-PD1 терапией. Еще одна важная молекула, а точнее пара молекул, была исследована в качестве мишени для терапии РПЖЖ. Хемокин CXCL12 широко представлен в микроокружении опухоли, а его рецептор CXCR4 экспрессирован на опухолевых клетках. Показано, что CXCL12 способствует хемотаксису опухолевых клеток, что указывает на перекрестное клеточное взаимодействие между опухолевыми клетками и стромой. Это взаимодействие оказалось значимым для иммунорезистентности РПЖЖ, так как при обработке опухоли AMD3100 моноклональным антителом к CXCR4, регистрировалось снижение роста опухоли, зависимое от Т-лимфоцитов. Комбинация AMD3100 с анти-PD-L1 препаратом также оказалась эффективной. На данный момент AMD3100 находится в I фазе клинических испытаний в качестве терапии РПЖЖ под торговым названием Мозобил (Mozobil). Помимо ингибирующих агентов моноклональные антитела могут использоваться и как агонисты различных рецепторов. CD40 является молекулой, располагающейся на поверхности иммунных клеток. При связывании со своим лигандом CD40L (который экспрессирован на CD4+ Т-хелперных клетках) активирует антигенпредставляющие клетки. Было продемонстрировано, что усиление действия CD40 повышает эффективность противоопухолевых вакцин. Моноклональные антитела, активирующие CD40, приводили к регрессии опухоли в сочетании с химиотерапией в доклинических исследованиях. В клинических испытаниях I фазы терапия агонистом CD40 в сочетании с химиотерапией привела к иммунному противоопухолевому ответу в 19 % случаев у пациентов с неоперабельной формой РПЖЖ. В мышиных моделях, сочетание анти-PD-1 или анти-CTLA-4 препаратов с агонистами CD40 усиливало противоопухолевый иммунитет. 39 % мышей, получавших подобную схему терапии, демонстрировали длительную полную ремиссию и продолжительную выживаемость. Также терапия привела к уменьшению Treg и увеличению CD8+ Т-лимфоцитов в микроокружении опухоли. Важно, что в экспериментах на мышах сочетание CD40 агонистов с анти-PD-1 или анти-CTLA-4 препаратами показало улучшенную среднюю выживаемость по сравнению с комбинацией химиотерапии и CD40 агониста. На данный момент моноклональное антитело-агонист CD40 R07009789 проходит клинические испытания в комбинации с химиотерапией и ингибиторами супрессорных молекул.
Таким образом, рак поджелудочной железы является важной проблемой в современной медицине. Традиционные подходы иммунотерапии, такие как ингибиторы иммуносупрессивных молекул и противоопухолевые вакцины, малоэффективны в качестве монотерапии при РПЖЖ. В то же время, комбинации специальных препаратов, воздействующих на компоненты микроокружения опухоли с традиционной иммунотерапией и химиотерапией показали многообещающие результаты. Требуется дальнейшее всестороннее изучение данного злокачественного новообразования для разработки эффективных методов лечения, в том числе и иммунотерапии.
Источники:
- Torphy R. J., Zhu Y., Schulick R. D. Immunotherapy for pancreatic cancer: Barriers and breakthroughs //Annals of Gastroenterological Surgery. — 2018.
- Bhosale R. R. et al. Current Perspectives on Novel Drug Carrier Systems and Therapies for Management of Pancreatic Cancer: An Updated Inclusive Review // Critical Reviews™ in Therapeutic Drug Carrier Systems. — 2018. — Т. 35. — №. 3.
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Источник
Усиливается тенденция к проведению малых хирургических процедур при раке молочной железы. Эти малые вмешательства часто включают тилэкгомию, или простую мастэктомию. Теперь избегают обширных операций на стенке грудной клетки, в прошлом включавших даже плечевые структуры.
По этой причине блокада молочной железы может становиться более приемлемой для женщин, подвергающихся операции по повод}’ рака молочной железы.
Выбор пациентов
Любой человек, нуждающийся в хирургической операции на молочной железе, — кандидат на проведение блокады молочной железы, хотя постоянно следует помнить о соответствующей седации для выполнения блокады и операции.
! ‘» V
С4

Т10
РИС. 32-1.
Анатомия блокады молочной железы: дерматомы.
Фармакологический выбор
Блокада молочной железы предназначена больше для блокады чувствительных нервов, нежели двигательных. По этой причине возможно использование низких концентраций местного анестетика. Например, используют 0,75-1% раствор лидокаи- на или мепивакаина. также приемлем 0.25% раствор бупивакаина.
МЕТОДИКА ПРИМЕНЕНИЯ
Анатомия
При выполнении блокады молочной железы блокируют 11-М1 межрёберные нервы и некоторые терминальные ветви поверхностного шейного сплетения (рис. 32-1).
Положение больного
Процедуру можно провести, когда больной лежит на спине, если блокаду межрёберных нервов выполняют на уровне средней подмышечной линии. Эти же нервы могут быть заблокированы со стороны спины (задний подход), если пациент лежит на животе.
Пункция иглой
Блокаду молочной железы можно выполнить, когда пациент лежит на спине, путём проведения блокады межрёберных нервов от ТЪ2 до ТЪ7 по средней подмышечной линии больного, как показано на рис. 32-2, А. Руку пациента отводят в плече и помещают на подставку для руки или кладут под голову как показано на рис. 32-2. А. Межрёберную блокаду можно выполнить с использованием 3-сантиметровой иглы калибра 22 с коротким срезом. Вводят 5 мл раствора местного анестетика ниже каждого ребра, после того как кончик иглы соскользнул с нижнего края ребра. Если вызванной аналгезии недостаточно, необходимо добавить подкожную инфильтрацию, поскольку7 могли быть пропущены латеральные кожные ветви межрёберных нервов. Это возможно, поскольку’ у некоторых пациентов латеральный кожный нерв может ответвляться в точке, расположенной более кзади. В добавление к блокаде межрёберных нервов необходимо провести подкожную инфильтрацию в виде перевёрнутой буквы «Ь», как показано на рис. 32-2. В. Эту подключичную блокаду следует добавить для анестезии ветвей поверхностного шейного сплетения, иннервирующих часть верхней стенки грудной клетки. Дополнительно для блокады волокон межрёберных нервов, пересекающих срединную линию с противоположной стороны, нужна подкожная инфильтрация по срединной линии. Выполнение подкожной инфильтрации облегчается использованием 10-12-сантиметровой иглы.
Если применяют задний подход к межрёбер- ным нервам, пациент должен лежать на животе. Межрёберную блокаду выполняют путём шагового смещения иглы для соскальзывания сразу же ниже ребра от ТЪ2 до ТЪ7 (рис. 32-2, Б). Эта техника описана в главе 33. Если выбран задний подход, необходимо добавлять подкожную инфильтрацию, как было описано выше. Некоторые практикующие специалисты предпочитают использовать паравертебральные блокады (С1-ТЪ7), а не межрёберные, для достижения регионарной анестезии при хирургии молочной железы.
Потенциальные осложнения
При этой методике (или при паравертебральной блокаде) может возникнуть пневмоторакс, хотя это происходит редко.
ОСОБЕННОСТИ
Из-за понятного беспокойства, которое часто сопровождает хиру ргическое вмешательство на молочной железе, пациенты должны осознавать перед проведением этого анестезиологического подхода, что предпочтительна выраженная седа- ция в комбинации с блокадой молочной железы. Некоторые пациенты хотят сохранить «чувство контроля» во время проведения реконструктивных или увеличивающих хирургических вмешательств на молочной железе, такие пациенты — идеальные кандидаты для блокады молочной железы, так как при ней не происходит утраты контроля, как при общей анестезии. Также следует помнить, что вместо блокады межрёберных нервов можно использовать грудную параверте- бральную блокаду (см. главу 37).


 ПОЛОЖЕНИЕ ЛЕЖА НА ЖИВОТЕ
ПОЛОЖЕНИЕ ЛЕЖА НА ЖИВОТЕ

 (
(
В
33
Еще по теме Блокада поджелудочной желез:
- Глава 14. ПОДЖЕЛУДОЧНАЯ ЖЕЛЕЗА
- 14.2. Повреждения поджелудочной железы
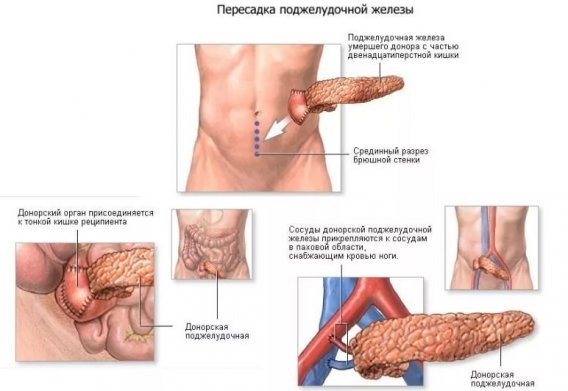
- 28.6. Трансплантация поджелудочной железы
- РАС поджелудочной железы
- Поджелудочная железа
- Опухоли поджелудочной железы
- ИНКРЕТОРНАЯ ФУНКЦИЯ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
- ПОДЖЕЛУДОЧНАЯ ЖЕЛЕЗА
- Трансплантация поджелудочной железы
- 14.6.2.1. Рак поджелудочной железы
- 14.5. Кисты и свищи поджелудочной железы
- Рак поджелудочной железы
Источник