Что такое паллиативное лечение при раке поджелудочной железы
12 апреля 2019 г.
Просмотров: 343
В последние десятилетия отмечается рост пациентов со злокачественными опухолями органов гепатопанкреатодуоденальной зоны. При этом частота диагностики рака этих органов на ранних стадиях практически не повысилась. В основном пациенты продолжают поступать в стационары только при развитии осложнений, наиболее частым из которых является механическая желтуха. Рак головки поджелудочной железы находится на втором месте среди причин подпеченочной желтухи (30–35%), уступая лишь холедохолитиазу (35–40%), третье место занимает рак внепеченочных желчных протоков (10–12%), затем — рак большого сосочка двенадцатиперстной кишки (1–2%).
При этом, по данным литературы, только в 10–20% случаев при выявлении рака поджелудочной железы пациентам выполняется радикальная операция, несмотря на которую большинство умирает в первый год после вмешательства. К сожалению, большая часть больных по разным причинам не может рассчитывать на радикальное лечение. Лечение больных этой категории осложняется наличием обтурации желчных путей, холангита, а в большинстве случаев и печеночной недостаточности. Общепризнано, что оперативное вмешательство, выполненное при нарастающей механической желтухе, является чрезвычайно рискованным и сопровождается высокой летальностью, достигающей 20-60%, что наряду с возрастающей частотой опухолевого поражения поджелудочной железы, несомненно, обусловливает актуальность данной проблемы.
В последние годы основными методами декомпрессии желчных путей считаются минимально инвазивные: ретроградные (эндоскопические) или антеградные (чрескожные чреспеченочные). Активное использование в клинической практике современных антеградных чрескожно-чреспеченочных) и ретроградных (эндоскопических) минимально инвазивных вмешательств позволяет эффективно сочетать диагностические и лечебные мероприятия, направленные в первую очередь на достижение билиарной декомпрессии. При этом следует признать, что при исторически сложившемся приоритете эндоскопических вмешательств ретроградный доступ в желчные протоки тем не менее, очевидно, перестал быть безальтернативным.
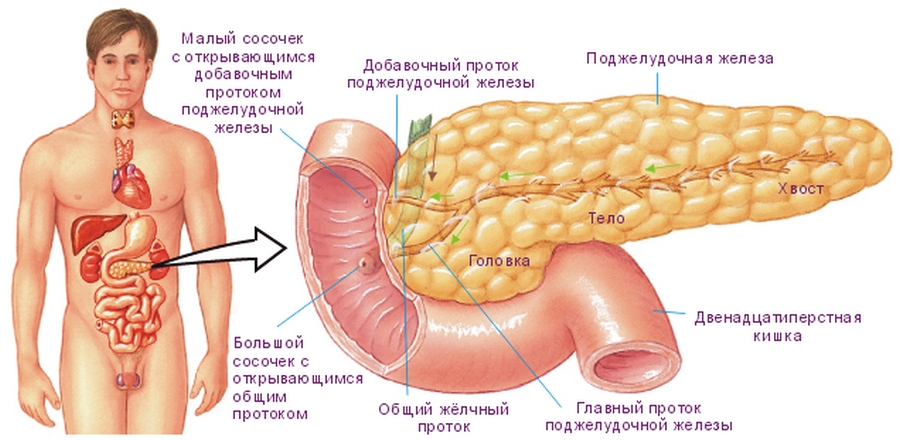
Антеградные методы декомпрессии желчевыводящей системы, реализуемые в виде чрескожно-чреспеченочной холангиостомии, продленного наружно-внутреннего дренирования, антеградного эндобилиарного стентирования, могут служить альтернативой эндоскопическим методам при их неэффективности или невозможности выполнения. При этом чрескожные миниинвазивные вмешательства позволяют либо успешно подготовить пациентов к основному этапу операции, в случае возможного выполнения радикального хирургического лечения, либо могут стать окончательным вмешательством, являясь примером паллиативного лечения. Целью нашего исследования явилась оценка эффективности паллиативного лечения с применением антеградных миниинвазивных технологий при раке поджелудочной железы.
Материалы и методы
За период с января 2010 по декабрь 2016 года в хирургическом отделении Орловской областной клинической больницы под наблюдением находилось 160 больных со злокачественным поражением поджелудочной железы, осложненным синдромом механической желтухи. В связи с чем все пациенты были госпитализированы в экстренном порядке. Больные доставлялись в стационар скорой медицинской помощью, направлялись другими лечебно-профилактическими учреждениями города и области, а также обращались самостоятельно. Женщин в исследуемой группе было 76 (47,5%), мужчин — 84 (52,5%). Возраст больных колебался от 48 до 76 лет. Проводилось комплексное обследование больных, включающее исследование клинико-лабораторных данных (общий и биохимический анализ крови, общий анализ мочи, коагулограмма и др.), выполнялось ультразвуковое исследование брюшной полости, гастродуоденоскопия, по показаниям эндоскопическая ретроградная холангиопанкреатография и мультиспиральная компьютерная томография, а также ряд других инструментальных исследований в зависимости от сопутствующей патологии.
При поступлении уровень прямого билирубина в исследуемой группе больных колебался от 68 до 580 мкмоль/л. Уровень общего билирубина в отдельных случаях достигал 780 мк-моль/л. Известно, что чем выше уровень гипербилирубинемии, тем больше вероятность развития у больного некорригируемой печёночной недостаточности и прогрессирующей полиорганной недостаточности. В связи с этим наличие гипербилирубинемии и билиарной гипертензии требует проведения срочных хирургических вмешательств, направленных на декомпрессию желчных путей. При этом билиарная декомпрессия должна быть прогнозируемо эффективной и управляемой.
У всех пациентов, находящихся под нашим наблюдением, при ультразвуковом исследовании были выявлены признаки актуальной желчной гипертензии, что наряду с невозможностью выполнения по различным причинам ретроградного эндоскопического дренирования явилось основанием для антеградного дренирования желчных путей под сонофлюороскопическим контролем по срочным показаниям (1-2 сутки от момента поступления в стационар). При этом во всех случаях антеградные миниинвазивные вмешательства несли не только лечебную, но и диагностическую нагрузку. Так как выполняемая интраоперационная антеградная холангиография позволяла уточнить уровень и степень блока. Адекватность выполненного чрескожного чреспеченочного дренирования оценивалась по изменению интенсивности желтухи, по суточному дебиту желчи, степени снижения гипербилирубинемии в биохимическом анализе крови, а также по устранению признаков билиарной гипертензии при динамическом ультразвуковом исследовании. После снижения уровня билирубина крови, дообследования и стабилизации состояния пациентов решался вопрос о переводе наружной холангиостомы в наружно-внутреннюю или об антеградном эндобилиарном стентировании.
Результаты исследования
Чувствительность, специфичность и диагностическая точность холангиографии во время постановки холангиостомы при раке поджелудочной железы составила соответственно 91,2%, 80,1% и 85,3%. Всего в группе пациентов со злокачественным поражением поджелудочной железы выполнено 204 минимально инвазивных вмешательств. Распределение характера вмешательств было следующим: наружная холангиостомия — 62,7% (128); антеградное эндобилиарное стентирование — 25% (51); наружно-внутреннее дренирование протоков — 10,3% (21); чрескожно-чреспеченочная микрохолецистостомия — 2% (4).
Учитывая, что у 51 пациента (32%) в исследуемой группе при проведении клинико-инструментальных и морфологических исследований был подтвержден неоперабельный характер поражения поджелудочной железы, выполнение радикального оперативного лечения не представлялось возможным. В связи с этим окончательным видом хирургического лечения, направленным на улучшение качества жизни, у данных больных, явилось антеградное стентирование внепеченочных желчных протоков.
Стентирование, по данным литературы, является более предпочтительным и менее травматичным способом восстановления пассажа желчи у больных с неоперабельным раком поджелудочной железы, так как значительно улучшает качество жизни больного.
В каждом исследуемом случае стентирование выполнялось вторым этапом после предварительной чрескожно-чреспеченочной холангиостомии или наружно-внутреннего дренирования. Техника стентирования заключалась в проведении металлического проводника через опухолевую структуру за зону большого сосочка двенадцатиперстной кишки под сонофлюороскопическим контролем, по которому в последующем производилась транспапиллярная установка стента. После выполненного стентирования в обязательном порядке производили постановку страховочной наружной холангиостомы, которая позволяла выполнять динамическую антеградную холангиографию для контроля процесса раскрытия стента и адекватности его функционирования в раннем послеоперационном периоде.
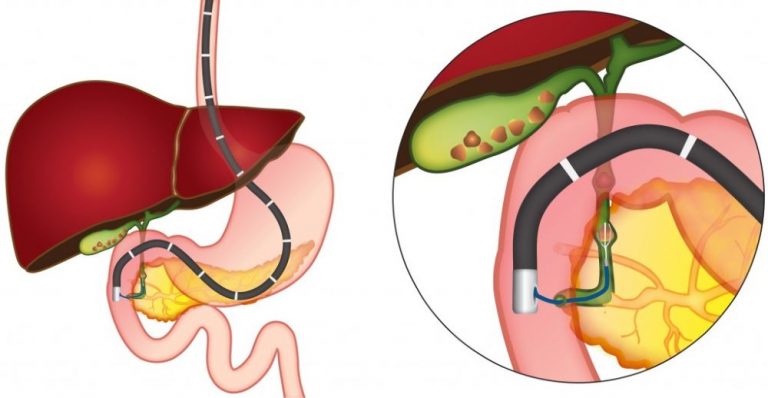
Выбор стента по диаметру раскрытия, длине и типу покрытия осуществлялся индивидуально в каждом конкретном случае в зависимости от протяженности зоны поражения. Использование покрытого стента при неоперабельном раке поджелудочной железы имеет ряд преимуществ, так как позволяет предотвратить возможное прорастание опухолевой или грануляционной тканью ячеистой стенки стента, тем самым вызывая обтурацию его просвета. Однако учитывая транспапиллярное положение устанавливаемого стента, применение покрытых форм было ограничено у пациентов с сохраненной проходимостью и функцией панкреатического протока.
Использование в подобных случаях покрытых форм стента значительно повышало риск перекрытия устья панкреатического протока. Как правило, в большинстве случаев сразу же после установки нитинолового саморасправляющегося стента под рентгенологическим контролем отмечали поступление контрастного препарата в просвет двенадцатиперстной кишки. Однако при этом рентгенологически сохранялась зона сужения в пораженном участке билиарного тракта. Полное раскрытие стента, сопровождавшееся свободным поступлением контрастного вещества в просвет двенадцатиперстной кишки, определялось в течение 24-48 часов с момента его установки. Восстановление пассажа подтверждалось контрольной антеградной холангиографией.
Обсуждение результатов
Осложнения после проведенных миниинвазивных вмешательств возникли в 26 случаях, и были связаны у 12 пациентов (7,5%) с дислокацией холангиостомического дренажа; в 4 случаях (2,5%) с развившимся острым холециститом; в 2 случаях (1,2%)с развившимся острым панкреатитом; у 5 пациентов с гидротораксом (3,1%). В отдаленные сроки после стентирования у 3 (1,9%) больных развился рецидив механической желтухи, обусловленный нарушением функции эндобилиарного стента.
В 2 наблюдениях через 4-5 мес. с момента постановки непокрытого стента произошла обтурация его внутреннего просвета за счет прорастания опухолевыми тканями ячеистой стенки.
В 3-м наблюдении рецидив желтухи развился через 6 мес. с момента постановки покрытого эндобилиарного стента и был обусловлен сдавлением его просвета разрастающейся опухолевой тканью. Двум пациентам из данной группы наблюдения выполнено антеградное рестентирование покрытым стентом по методике «стент в стент». В 3-м случае рецидива желтухи, связанного со сдавлением покрытого стента, рестентирование не проводилось. Пациенту было выполнено наружно-внутреннее дренирование.
Среди осложнений, развившихся после проведения антеградного эндобилиарного стентирования в ранний послеоперационный период, были зафиксированы острый холецистит (4 пациента) и острый панкреатит (2 пациента). В 3 случаях после установки непокрытого стента и в 1 после установки покрытого у пациентов отмечены клинико-эхографические признаки острого холецистита. У одного больного выполнена лапароскопическая холецистэктомия, у трех других произведена постановка чрескожно-чреспеченочной микрохолецистостомии под контролем УЗИ, на фоне которой клинические проявления острого холецистита удалось полностью купировать. Клиническая картина острого панкреатита, развившаяся в течение 24-48 часов после выполненного стентирования у двух пациентов, полностью купировалась на фоне проведенной консервативной терапии.
Мы в своем опыте не наблюдали смещений и миграций стентов после установки. Таким образом, антеградное эндобилиарное транспапиллярное стентирование саморасправляющимися металлическими стентами обеспечивает надежное и длительное дренирование желчных протоков, является малотравматичным, довольно безопасным и эффективным методом билиарной декомпрессии при механической желтухе, обусловленной неоперабельным раком поджелудочной железы. Летальный исход возник у 12 больных, что составило 7,5%, и был обусловлен прогрессированием основного заболевания и нарастанием полиорганной недостаточности.
Выводы
У пациентов с неоперабельным раком поджелудочной железы выполнение антеградного эндобилиарного стентирования представляет собой окончательный вариант хирургического лечения, позволяющий при минимальном объеме вмешательства обеспечить адекватный дренирующий эффект желчевыводящих путей. Кроме того, отсутствие наружных дренажей улучшает качество жизни пациента, его психологическое состояние, позволяет активизировать его в более ранние сроки, избавляет от необходимости приема желчи внутрь.
Литература:
- Альянов А.Л., Мамошин А.В., Борсуков А.В., Мурадян В.Ф. Эффективность применения минимально инвазивных технологий в лечении больных с синдромом механической желтухи // Ученые записки Орловского государственного университета. Серия: Естественные, технические и медицинские науки. 2015. № 4. С. 280-284.
- Гальперин Э.И., Ветшев П.С. Руководство по хирургии желчных путей. М.: Издательский дом Видар-М, 2006.
- Данилов М.В., Фёдоров В.Д. Повторные и реконструктивные операции при заболеваниях поджелудочной железы.М.: Медицина, 2003.
- Долгушин Б.И., Авалиани М.В., Буйденок Ю.В. и др.Эндобилиарная интервенционная онкорадиология.М.: ООО «Медицинское информационное агентство«.2004. — 224 с.
- Затевахин И.И., Цициашвили М.Ш., Дзарасова Г.Ж. и др.Возможности доплеровской сонографии в оценке функционального состояния печени при механической желтухе // Анн. хирург. гепатолог. 2001. Т. № 1. С. 113-124.
- Ившин В.Г., Якунин А.Ю., Лукичев О.Д. Чрескожные диагностические и желчеотводящие вмешательства у больных механической желтухой. Тула, 2000. — 312 с.
- Израилов Р.Е. Миниинвазивные технологии в лечении больных с опухолями органов билиопанкреатодуоденальной зоны: автореф. дис… докт. мед. наук / Р.Е. Израилов.Москва, 2011. — 47 с.
- Кубышкин В.А., Вишневский В.А. Рак поджелудочной железы. М., 2003.
- Охотников О.И., Яковлева М.В., Григорьев С.Н., Пахомов В.И. Антеградные эндобилиарные вмешательства в лечении осложненной желчнокаменной болезни // Анн.хирург. гепатолог. 2013. Т. 18. № 1. С. 29-37.
- Патютко Ю.И., Котельников А.Г. Хирургия рака органов билиопанкреатодуоденальной зоны. М.: Медицина, 2007.
- Costamagna G., Pandolfi M. Endoscopic stenting for biliary and Pancreatic malignancies. J ClinGastroenterol 2004; 38: 59–67.
- Hans-Joachim Wagner. With or Against the Bile Flow?Radiology. 2002; 225: 7-9.
- Katsinelos P., Paikos D., Kountouras J. et al. Tannenbaum and metal stents in the palliative treatment of malignant distal bileduct obstruction: a comparative study of patency and cost effectiveness. SurgEndosc 2006; 20: 1587–1593.
- May A., Ell C. A New Self-Expanding Nitinol Stent for Palliation of Malignant Biliary obstruction. Endoscopy 2004; 36: 329–333.
- Mehmet M.D., Aksungur E., Seydaolu G. Percutaneousplacement of biliary metallic stents in patients with malignanthilar obstruction, unilobar versus bilobar drainage. Journal ofVascular and Interventional Radiology. 2003; 14: 1409-1416.
- Yushidome H., Miyazaki M., Shimizu H. et al. Obstructivejaundice impairs hepatic sinusoidal endothelial cell functionand renders liver susceptible to hepatic ischemia/ reperfusion //J. Hepatology. 2000. V.33 (1). P.59-67.
Источник: Научно-практический журнал «Паллиативная медицина и реабилитация» № 1. 2018.
Источник
Как известно, рак поджелудочной железы характеризуется высокими биологической агрессивностью и метастатическим потенциалом. К этому предрасполагают ее анатомо-физиологические особенности: орган не имеет хорошо выраженной капсулы, расположен в забрюшинном пространстве, имеет хорошо развитую сосудистую сеть, богато снабжен нервными окончаниями, расположен в непосредственной близости с жировой клетчаткой и многочисленными лимфоузлами забрюшинного пространства. В то же время появление опухоли в железе на первых этапах практически не вызывает специфических симптомов. Кроме того, выявление образований в ткани железы представляет определенные трудности в диагностическим плане: чаще всего при обычном ультразвуковом исследовании в условиях неудовлетворительной визуализации (газ и жидкость в желудке, кишечнике) поджелудочная железа видна плохо, фрагментарно, а ее опухоли достаточно часто имеют изоэхогенную структуру, т.е. аналогичную здоровой ткани. Эти обстоятельства предрасполагают к крайне низкой выявляемости этого вида опухоли на ранних стадиях и к тяжелому, не поддающемуся лечению дальнейшему прогрессированию рака.
Устранение симптомов
При установленном диагнозе рака поджелудочной железы неоперабельной стадии первой задачей является устранение жизнеугрожающих осложнений (механическая желтуха, препятствие для прохождения пищи по желудку или двенадцатиперстной кишки, кровотечение, болевой синдром), а также снятие болевого синдрома.
Дальнейшие варианты возможного лечения обсуждаются на консилиуме с участием специалистов онкохирургов, химиотерапевтов и лучевых терапевтов.
Что такое паллиативное лечение
Паллиативное лечение подразумевает под собой применение специальных методов противоопухолевого лечения: циторедуктивная операция (операция, уменьшающая объем опухоли и способствующая устранению осложнений), паллиативное химиотерапевтическое и радиотерапевтическое лечение. Поскольку полностью излечить этих больных невозможно, целью паллиативного лечения является уменьшение проявлений заболевания, улучшения качества и продление жизни пациентов.
 При невозможности специального противоопухолевого лечения пациенты нуждаются в паллиативной помощи – симптоматическом лечении, направленном на снятие тягостных и жизнеугрожающих симптомов болезни, включающем хирургические способы, кровоостанавливающие средства, различные методы питательной (нутритивной) поддержки, обезболивание. Целью паллиативной помощи является борьба с симптомами, ухудшающими качество жизни больных.
При невозможности специального противоопухолевого лечения пациенты нуждаются в паллиативной помощи – симптоматическом лечении, направленном на снятие тягостных и жизнеугрожающих симптомов болезни, включающем хирургические способы, кровоостанавливающие средства, различные методы питательной (нутритивной) поддержки, обезболивание. Целью паллиативной помощи является борьба с симптомами, ухудшающими качество жизни больных.
Паллиативное и симптоматическое лечение необходимо и при прогрессировании рака поджелудочной железы после радикального лечения. Прогрессирование проявляется рецидивом в ложе удаленной опухоли, распространением опухоли по брюшной полости и развитием отдаленных метастазов.
Хирургическое паллиативное лечение
 Хирургический компонент в паллиативном лечении применяется при наличии осложненного опухолевого процесса. Так, сужение желчных путей с развитием механической желтухи –показание к хирургическим манипуляциям для отвода желчи. При неоперабельном процессе возможно чрезкожное чрезпеченочное дренирование желчного пузыря или желчных протоков, однако при неоперабельном процессе отдают предпочтение различным видам стентирования протоков. Стентирование проводится с помощью эндоскопической техники, с заведением направляющей струны через канал эндоскопа в просвет холедоха. Процедура выполняется под рентгенологическим контролем в режиме реального времени с рентгеноконтрастным веществом, вводимым в желчные протоки. По проводнику, согласно данным выявленного уровня сужения протока, выполняется установление саморасправляющегося стента – трубочки в виде пружинки, которая будет удерживать просвет протока раскрытым. При отсутствии возможности стентирования выполняют симптоматическую шунтирующую операцию (соединение желчного пузыря или протока выше сужения с кишкой, т.н. билиодигестивное шунтирование).
Хирургический компонент в паллиативном лечении применяется при наличии осложненного опухолевого процесса. Так, сужение желчных путей с развитием механической желтухи –показание к хирургическим манипуляциям для отвода желчи. При неоперабельном процессе возможно чрезкожное чрезпеченочное дренирование желчного пузыря или желчных протоков, однако при неоперабельном процессе отдают предпочтение различным видам стентирования протоков. Стентирование проводится с помощью эндоскопической техники, с заведением направляющей струны через канал эндоскопа в просвет холедоха. Процедура выполняется под рентгенологическим контролем в режиме реального времени с рентгеноконтрастным веществом, вводимым в желчные протоки. По проводнику, согласно данным выявленного уровня сужения протока, выполняется установление саморасправляющегося стента – трубочки в виде пружинки, которая будет удерживать просвет протока раскрытым. При отсутствии возможности стентирования выполняют симптоматическую шунтирующую операцию (соединение желчного пузыря или протока выше сужения с кишкой, т.н. билиодигестивное шунтирование).
Появление признаков желудочно-кишечного кровотечения – показание к гемостатической и гемозамещающая терапии (см.часть I).
Восстановление питания
При нарушении проходимости желудка и/или двенадцатиперстной кишки необходимо стремиться к восстановлению питания. Возможно эндоскопическое заведение зонда за зону сужения или эндоскопическое стентирование – установка саморасправляющейся конструкции в виде сетчатой трубки, раскрывающей просвет желудочно-кишечного тракта. При невозможности или неэффективности стентирования выполняется симптоматическая операция – формирование соустья нижележащих отделов кишечника с желудком – т.н. обходной гастроеюноанастомоз, позволяющий пище из желудка поступать в отделы кишечника, свободные от опухоли. В ряде ситуаций формируют противоестественное отверстие для питания – тонкокишечную стому (еюностомия). Существуют малоинвазивные (эндоскопические) методы еюностомии, их применение ограничено наличием выраженного опухолевого сужения, не позволяющего провести эндоскоп.

Пациенты с распространенным раком поджелудочной железы чаще всего находятся в состоянии пониженного питания, плоть до выраженного истощения (раковая кахексия). Для поддержания качества жизни применяются различные способы улучшения питания и восстановления водно-электролитного баланса:
- Частое дробное питание, исключения продуктов, раздражающих слизистую оболочку желудка (грубая пища, копчености, маринады, жирное и жареное, газированные и алкогольные напитки)
- Медикаментозные средства: ферменты поджелудочной железы (паркеатин, креон, панзинорм, эрмиталь и дт.), препараты, снижающие секрецию желудочного сока (омепразол, рабепразол и др.), спазмолитики (но-шпа, дюспаталин).
- Применение специальных сбалансированных питательных смесей – сухих или в разведении (Нутризон, Нутридринк, Суппортан и др.)
- Парэнтеральное (букв. помимо желудочно-кишечного тракта) питание – внутривенное введение питательных веществ – сбалансированных смесей углеводов, жиров и аминокислот, например, Кабивен, Оликлиномель.
- Введение витаминных комплексов и смесей (например, мильгамма, витамин С, цернивит и др.)
Консервативные методы лечения
 При нерезектабельном местном опухолевом процессе без отдаленных метастазов, отсутствии жизнеугрожающих осложнений и сохранном общем состоянии пациента применяются консервативные паллиативные методы лечения. Проводят лучевую терапию в сочетании с противоопухолевыми лекарственными средствами (химиолучевое лечение) (см.часть I). Паллиативная лучевая терапия проводится по специальной щадящей схеме: подводится меньшая разовая доза облучения, более длительное лечение, меньше поле облучения. В качестве радиомодификаторов добавляются химиопрепараты.
При нерезектабельном местном опухолевом процессе без отдаленных метастазов, отсутствии жизнеугрожающих осложнений и сохранном общем состоянии пациента применяются консервативные паллиативные методы лечения. Проводят лучевую терапию в сочетании с противоопухолевыми лекарственными средствами (химиолучевое лечение) (см.часть I). Паллиативная лучевая терапия проводится по специальной щадящей схеме: подводится меньшая разовая доза облучения, более длительное лечение, меньше поле облучения. В качестве радиомодификаторов добавляются химиопрепараты.
 Для самостоятельного паллиативного лечения неоперабельных больных с генерализованным, т.е. с отдаленными метастазами, раком проводят самостоятельную химиотерапию – лечение специальными противоопухолевыми препаратами (см.часть I). Химиотерапия проводится длительно, с большим числом курсов, сменой линий химиопрепаратов, регулярным контролем эффективности, активной сопроводительной симптоматической терапией. Эффективными химиопрепаратами считаются гемцитабин, препараты платины, капецитабин, иринотекан, прапараты таксанов и т.д. (см.часть I).
Для самостоятельного паллиативного лечения неоперабельных больных с генерализованным, т.е. с отдаленными метастазами, раком проводят самостоятельную химиотерапию – лечение специальными противоопухолевыми препаратами (см.часть I). Химиотерапия проводится длительно, с большим числом курсов, сменой линий химиопрепаратов, регулярным контролем эффективности, активной сопроводительной симптоматической терапией. Эффективными химиопрепаратами считаются гемцитабин, препараты платины, капецитабин, иринотекан, прапараты таксанов и т.д. (см.часть I).
Применяют также таргетные препараты, блокирующие рост и размножение опухолевых клеток, воздействуя на индивидуально выявленные молекулы (цели), участвующие в росте и развитии опухолевых клеток. Это Тарцева (эрлотиниб), бевацизумаб, целекоксиб, Алимта. Препарат назначается в комбинации с обычными химиопрепаратами при выявленной чувствительности опухоли к тому или иному лекарственному агенту. Чувствительность определяется при молекулярно-биологическом исследовании опухоли.
При опухолях с эндокринной активностью, таких как нейроэндокринные опухоли (карциноиды), возможно применение аналога соматостатина – октреотида, в том числе с пролонгированным действием (Сандостатин Лар).
Обезболивание как способ лечения
При распространенной опухоли, определяемой как IV стадия, и при прогрессировании заболевания развиваются различные осложнения и состояния, описанные выше, а также изнуряющий болевой синдром. При наличии болей назначают обезболивающую терапию, в том числе с применением наркотических анальгетиков.
Врач-онколог не имеет права отказать онкологическому больному в обезболивании!
Обезболивающая терапия подбирается по мере нарастания боли, с применением специальных шкал. Для короткого курса обезболивания могут применяться нестероидные противовоспалительные средства (парацетамол, кетопрофен, кеторолак и др.), однако при необходимости длительного обезболивания подключают препараты с меньшими побочными эффектами – аналоги опиатов (трамадол), опиоидные анальгетики, глюкокортикоиды, транквилизаторы, антиконвульсанты, антидепрессанты.

Если традиционные методы обезболивания малоэффективны, обезболивающего эффекта добиваются введением в эпидуральное простраство (в позвоночный канал в пространство, омывающее нервные корешки) анестетика. Существуют программируемые помпы для дозированного введения обезболивающих, в т.ч. наркотических средств, например, программируемая морфиновая помпа.
Также производят разрушение нервных узлов симпатических нервов с одной или двух сторон (симпатспланхникэктомия) мини-инвазивным способом – при видеоторакоскопии.
Прогноз
При далеко зашедшем процессе все лечебные мероприятия позволяют прожить не более 6-8мес.
Видео о том, как происходит метастазирование раковых опухолей
- Автор: Ирина
- Распечатать
Здравствуйте, меня зовут Ирина. По роду деятельности я практикующий врач. Имею высшую категорию. После окончания государственного медицинского университета прошла интернатуру при медицинской академии последипломного образования.
Оцените статью:
(1 голос, среднее: 5 из 5)
Источник





