Главный стимулятор клеток поджелудочной железы это
Функции
поджелудочной железы.
I.
Экзокринная. Она заключается
в секреции панкреатического
сока
– смеси
пищеварительных ферментов, поступающих
в двенадцатиперстную кишку и расщепляющих
все компоненты химуса;
II.
Эндокринная.
Она заключается в продукции гормонов.
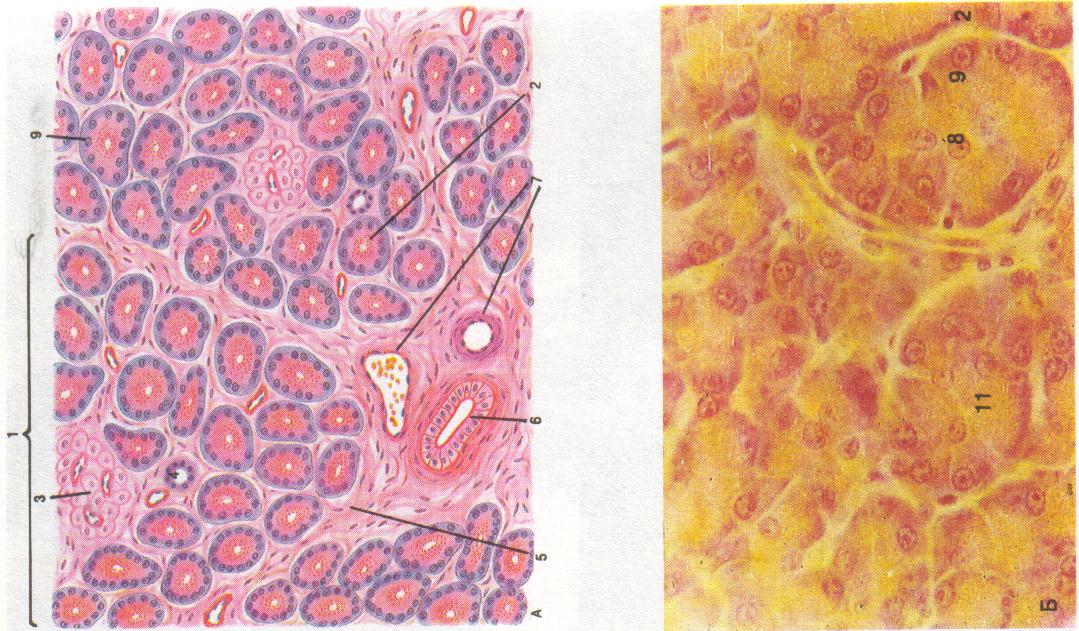
1 7 2 3 4 6 5 Поджелудочная |
Поджелудочная
железа – паренхиматозный
дольчатый орган.
Строма
железы представлена:
капсулой,
которая сливается с висцеральной
брюшиной и отходя-щими
от неё трабекулами. Строма тонкая,
образована
рыхлой
волокнистой —
тканью. Трабекулы делят железу на дольки.
В прослойках
рыхлой волокнистой ткани находятся
выводные протоки
экзокринной части железы, сосуды, нервы,
интраму-ральные ганглии,
пластинчатые тельца
Фатер-Пачини.
Паренхима
образо-вана совокупностью
секреторных отделов (ацинусов),
выводных протоков и остров-ков
Лангерганса. Каждая
долька состоит из экзокринной и
эндокринной частей. Их соотношение
≈ 97 : 3.
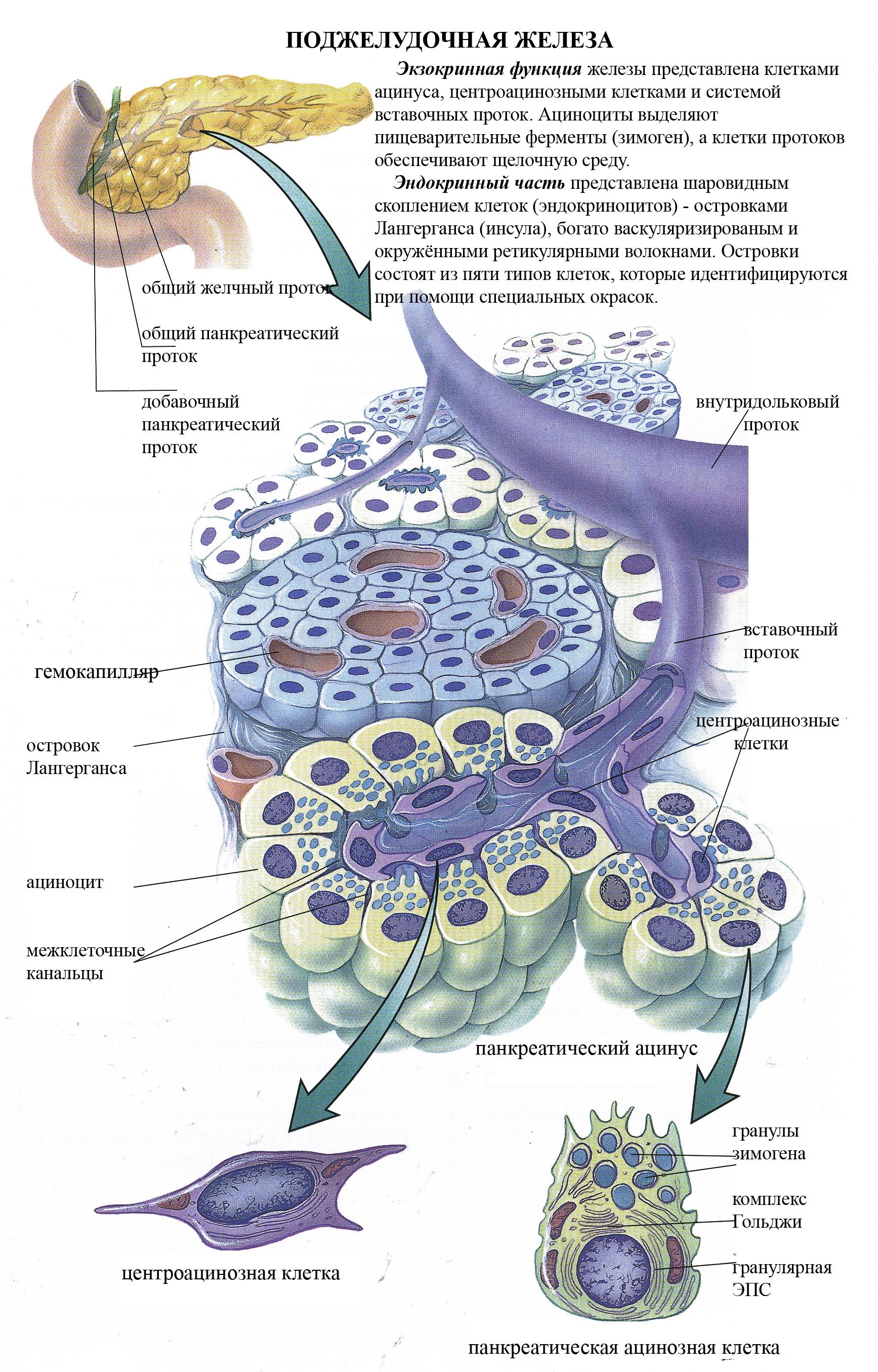
Экзокринная
часть поджелудочной железы представляет
собой сложную
алъвеолярно-трубчатую белковую железу.
Структурно-функциональной
единицей экзокринной части является
панкреатический
ацинус.
Он
образован 8
– 14 ацинозными клетками (ациноцитами)
и центроацинозными клетками
(центроациноцитами).
Ацинозные клетки лежат на базальной
мембране, имеют коническую форму и
выраженную полярность: различающиеся
по строению базальный и апикальный
полюсы. Расширенный базальный полюс
равномерно окрашивается основными
красителями и называется гомогенным.
Суженный апикальный полюс окрашивается
кислыми красителями и называется
зимогенным,
потому
что содержит гранулы зимогена –
проферментов. На апикальном полюсе
ациноцитов имеются микроворсинки.
Функция ациноцитов – выработка
пищеварительных ферментов. Активация
ферментов, секретируемых
ациноцитами, в норме происходит только
в двенадцатиперстной кишке под влиянием
активаторов. Это обстоятельство, а также
вырабатываемые
клетками эпителия протоков ингибиторы
ферментов и
слизь защищают паренхиму поджелудочной
железы от аутолиза (самопереваривания).
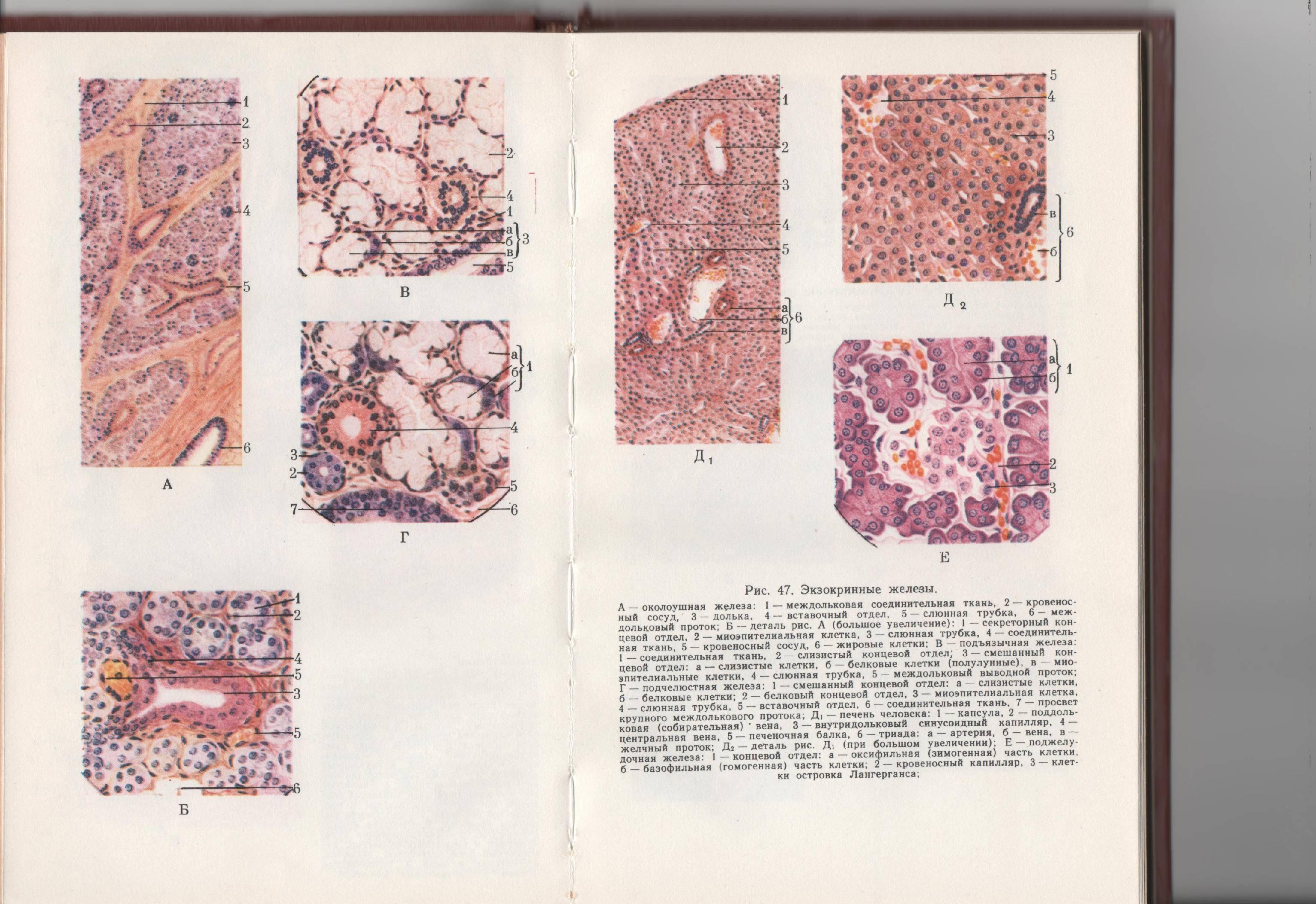
Поджелудочная
железа, долька,
рисунок, большое увеличение:
1 – концевой отдел
(ацинус):
а – апикальная
(оксифильная) часть клетки, содержит
зимоген,
б – базальная
(базофильная) – гомогенная часть клетки;
2 – гемокапилляр;
3 – островок
Лангерганса (инсула).
Эндокринная
часть железы. Структурно-функциональной
единицей эндокринной
части поджелудочной железы является
островок
Лангерганса
(инсула). Он
отделён от ацинусов рыхлой волокнистой
неоформленной
тканью. Островок состоит из клеток
инсулоцитов,
между которыми лежит рыхлая волокнистая
соединительная
ткань с гемокапиллярами фенестрированного
типа. Инсулоциты
различаются по способности окрашиваться
красителями. В соответствии
с этим различают инсулоциты типа А, В,
D,
D1,
PP.
В-клетки
(базофильные инсулоциты) окрашиваются
в синий цвет основными красителями. Их
количество составляет около 75% всех
клеток островка. Они располагаются в
центре инсулы. Клетки имеют развитый
белоксинтезирующий аппарат
и секреторные гранулы с широким светлым
ободком. Секреторные
гранулы содержат гормон инсулин
в комплексе с цинком. Функцией
В-инсулоцитов является выработка
инсулина, снижающего в крови
уровень глюкозы и стимулирующего ее
поглощение клетками организма.
В печени инсулин стимулирует образование
из глюкозы гликогена.
[При недостатке выработки инсулина
формируется сахарный
диабет].
А-клетки
(ацидофильные) – составляют 20-25% всех
клеток островка. Они располагаются по
периферии инсулы. Они содержат
гранулы, окрашивающиеся кислыми
красителями. В электронном микроскопе
гранулы имеют узкий ободок. Клетки также
содержат развитый
белоксинтезирующий аппарат и секретируют
гормон глюкагон.
Этот гормон является антагонистом
инсулина (контринсулярный гормон),
поскольку стимулирует распад гликогена
в печени и способствует
повышению содержания глюкозы в крови.
D-клетки
составляют около 5% эндокринных клеток
островка. Они
располагаются по периферии инсулы.
Содержат
умеренно плотные гранулы без светлого
ободка. В гранулах содержится
гормон соматостатин,
угнетающий функцию А, В-клеток островков
и ациноцитов. Он же обладает митозингибирующим
действием
на различные клетки.
D1-клетки
содержат гранулы с узким ободком.
Вырабатывают вазоинтестинальный
полипептид,
понижающий артериальное давление и
стимулирующий выработку панкреатического
сока. Количество этих клеток
невелико.
 РР-клетки
РР-клетки
(2—5%) располагаются по периферии
островков, иногда могут
встречаться и в составе экзокринной
части железы. Содержат гранулы различной
формы, плотности и величины. Клетки
вырабатывают панкреатический
полипептид,
угнетающий внешнесекреторную активность
поджелудочной железы.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
Эндокринная
часть поджелудочной железы образована
лежащими между ацинусов панкреатическими
островками, или островками Лангерганса
— светлыми
образованиями размером 50— 500 мкм,
состоящими из разных типов эпителиальных
клеток (альфа-, бета-и дельта-клеток).
Островки составляют около 1,5% объема
железы; у человека их насчитывается
около 1 млн.
Островки
состоят из клеток – инсулоцитов, среди
которых на основании наличия в них
различных по физико-химическим и
морфологическим свойствам гранул
выделяют 5 основных видов:
—
бета-клетки, синтезирующие инсулин
(60—80
%);
—
альфа-клетки, продуцирующие глюкагон
(20
%);
—
дельта-клетки, образующие соматостатин;
—
D1-клетки, выделяющие ВИП;
 —
—
PP-клетки, вырабатывающие панкреатический
полипептид.
Кроме
того, методами иммуноцитохимии и
электронной микроскопии было показано
наличие в островках незначительного
количества клеток, содержащих гастрин,
тиролиберин и соматолиберин.
Островки
представляют собой компактные пронизанные
густой сетью фенестрированных капилляров
скопления упорядоченных в гроздья или
тяжи внутрисекреторных клеток. Клетки
слоями окружают капилляры островков,
находясь в тесном контакте с сосудами;
большинство эндокриноцитов контактируют
с сосудами либо посредством цитплазматических
отростков, либо примыкая к ним
непосредственно.
3.1. Инсулин: химическая природа, регуляция секреции, механизм действия, роль в обмене.
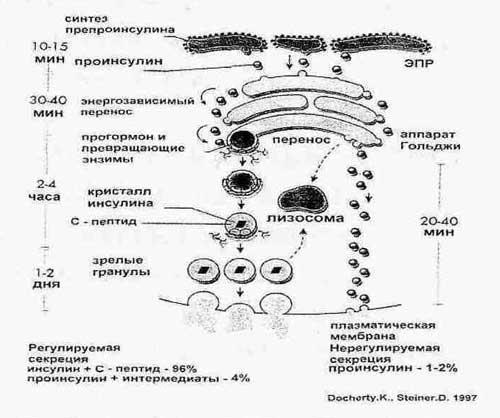
Инсулин
представляет собой простой полипептид
с молекулярной массой около 6000, состоящий
из двух линейных цепей: А — с 21 аминокислотой
и В — с 30 аминокислотами, соединенных
двумя бисульфидными мостиками. В цепи
А есть еще один «внешний» бисульфидный
мостик. Структура инсулина у различных
животных в основном совпадает. В настоящее
время принята точка зрения, согласно
которой вначале синтезируется одна
цепь аминокислот с последующим
свертыванием молекулы и образованием
бисульфидных связей. В этом процессе
участвует так называемый соединительный
пептид, или пептид С, состоящий из 33
аминокислот и соединяющий цепи А и В.
После свертывания образуется предшественник
инсулина, или проинсулин, с молекулярной
массой свыше 9000.
Биологическая
активность проинсулина составляет
примерно 10% активности инсулина.
Соединительный пептид С отщепляется
от инсулина в гранулах β-клеток перед
секрецией в кровь и поступает в нее в
количестве, эквимолекулярном инсулину.
Определение уровня пептида С является
более надежным индикатором секреции
β-клеток, чем определение собственно
инсулина, так как последний в отличие
от С-пептида частично задерживается в
печени, может подвергаться воздействию
циркулирующих противоинсулиновых
антител и подвергаться другим воздействиям,
искажающим истинную картину. Разъединение
цепей А и В приводит к полной инактивации
инсулина.


Регуляция
секреции инсулина происходит на основе
простой обратной связи, регулирующим
фактором в которой является уровень
гликемии: секреция инсулина повышается
при гипергликемии и понижается при
гипогликемии. При этом (3-клетки являются
одновременно хеморецепторами и
эффекторами. К основной регуляции
функции (3-клеток присоединяется
модулирующее влияние некоторых
гормональных факторов: СТГ, гормонов
надпочечников — стероидов и катехоламинов.
Вероятно, в интраинсулярной регуляции
участвуют глюкагон и соматостатин, а
также ионы кальция, связанные с
кальмодулином. Определенное влияние
на секрецию инсулина могут оказывать
и нервные факторы (блуждающий нерв).
Косвенное участие в регуляции секреции
инсулина принимают адреналин, глюкагон,
глюкокортиконцы и тиреоидные гормоны,
а соответственно, АКТГ и ТТГ, вызывающие
гипергликемию. Предполагается, что
существуют также интраинсулярные
регуляторные связи между α-, β- и
γ-клетками, в основе которых лежит
непосредственное (не связанное с
гипергликемией) стимулирующее действие
глюкагона на секрецию инсулина. К другим
эндогенным факторам, оказывающим
стимулирующее воздействие на секрецию
инсулина, относятся некоторые аминокислоты
(особенно лейцин и аргинин), ионы натрия,
холинергические вещества; высокая
внутриклеточная концентрация калия
блокирует секрецию инсулина.
Секреция
инсулина происходит постоянно, и около
50% инсулина, высвобождаемого из β-клеток,
никак не связано с приемом пищи или
иными влияниями. В течение суток
поджелудочная железа выделяет примерно
1/5 от запасов имеющегося в ней инсулина.
Главным
стимулятором секреции
инсулина является повышение концентрации
глюкозы в крови выше 5,5 ммоль/л, максимума
секреция достигает при 17-28 ммоль/л.
Особенностью этой стимуляции является
двухфазное усиление секреции инсулина:
первая
фаза длится
5-10 минут и концентрация гормона может
10-кратно возрастать, после чего его
количество понижается,вторая
фаза начинается
примерно через 15 минут от начала
гипергликемии и продолжается на
протяжении всего ее периода, приводя
к увеличению уровня гормона в 15-25 раз.
Чем
дольше в крови сохраняется высокая
концентрация глюкозы, тем большее число
β-клеток подключается к секреции
инсулина.
Стимуляция синтеза инсулина
происходит от момента проникновения
глюкозы в клетку до трансляции инсулиновой
мРНК. Она регулируется повышением
транскрипции гена инсулина, повышением
стабильности инсулиновой мРНК и
увеличением трансляции инсулиновой
мРНК.
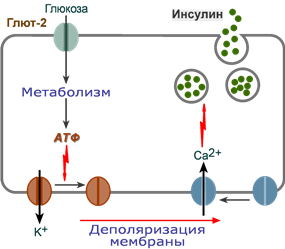
Стимуляция секреции инсулина
1.
После проникновения глюкозы в β-клетки
(через ГлюТ-1 и ГлюТ-2) она
фосфорилируется гексокиназой
IV (глюкокиназа,
обладает низким сродством к глюкозе),
2.
Далее глюкоза аэробно окисляется, при
этом скорость окисления глюкозы линейно
зависит от ее количества,
3.
В результате нарабатывается АТФ,
количество которого также прямо зависит
от концентрации глюкозы в крови,
4.
Накопление АТФ стимулирует закрытие
ионных K+-каналов,
что приводит к деполяризации мембраны,
5.
Деполяризация мембраны приводит к
открытию потенциал-зависимых Ca2+-каналов
и притоку ионов Ca2+ в
клетку,
6.
Поступающие ионы Ca2+ активируют
фосфолипазу C и запускают кальций-фосфолипидный
механизм проведения сигнала с образованием
ДАГ и инозитол-трифосфата,
7.
Появление инозитол-трифосфата в цитозоле
открывает Ca2+-каналы
в эндоплазматической сети, что ускоряет
накопление ионов Ca2+ в
цитозоле,
8.
Резкое увеличение концентрации в клетке
ионов Ca2+ приводит
к перемещению секреторных гранул к
плазматической мембране, их слиянию с
ней и экзоцитозу кристаллов зрелого
инсулина наружу,
9.
Далее происходит распад кристаллов,
отделение ионов Zn2+ и
выход молекул активного инсулина в
кровоток.
Описанный
ведущий механизм может корректироваться
в ту или иную сторону под действием ряда
других факторов, таких как аминокислоты,
жирные кислоты, гормоны ЖКТ
и других гормоны, нервная
регуляция.
Из
аминокислот на секрецию гормона наиболее
значительно влияют лизин и аргинин.
Но сами по себе они почти не стимулируют
секрецию, их эффект зависит от наличия
гипергликемии, т.е. аминокислоты только
потенциируют действие глюкозы.
Свободные
жирные кислоты также
являются факторами, стимулирующими
секрецию инсулина, но тоже только в
присутствии глюкозы. При гипогликемии
они оказывают обратный эффект, подавляя
экспрессию гена инсулина.
Логичной
является положительная чувствительность
секреции инсулина к действию гормонов
желудочно-кишечного тракта
– инкретинов (энтероглюкагона
и глюкозозависимого инсулинотропного
полипептида), холецистокинина, секретина, гастрина, желудочного
ингибирующего полипептида.
Клинически
важным и в какой-то мере опасным является
усиление секреции инсулина при длительном
воздействии соматотропного
гормона, АКТГ и глюкокортикоидов, эстрогенов, прогестинов.
При этом возрастает риск истощения
β-клеток, уменьшение синтеза инсулина
и возникновение инсулинзависимого
сахарного диабета. Такое может наблюдаться
при использовании указанных гормонов
в терапии или при патологиях, связанных
с их гиперфункцией.
Нервная
регуляция β-клеток поджелудочной железы
включает адренергическую и холинергическую регуляцию.
Любые стрессы (эмоциональные и/или
физические нагрузки, гипоксия,
переохлаждение, травмы, ожоги) повышают
активность симпатической нервной
системы и подавляют секрецию инсулина
за счет активации α2-адренорецепторов.
С другой стороны, стимуляция
β2-адренорецепторов
приводит к усилению секреции.
Также
выделение инсулина контролируется n.vagus,
в свою очередь находящегося под контролем
гипоталамуса, чувствительного к
концентрации глюкозы крови.
К
органам-мишеням инсулина можно отнести
все ткани, имеющие к нему рецепторы.
Рецепторы инсулина находятся практически
на всех клетках, кроме нервных, но в
разном количестве. Наибольшая их
концентрация наблюдается на мембране
гепатоцитов (100-200 тыс на клетку) и
адипоцитов (около 50 тыс на клетку), клетка
скелетной мышцы имеет около 10 тысяч
рецепторов, а эритроциты — только 40
рецепторов на клетку.
Нервные
клетки не имеют рецепторов к инсулину,
который просто не проникает через
гематоэнцефалический барьер.
Рецептор
инсулина представляет собой гликопротеин,
построенный из двух димеров, каждый из
которых состоит из α- и β-субъединиц,
(αβ)2.
Обе субъединицы кодируются одним геном
19 хромосомы и формируются в результате
частичного протеолиза единого
предшественника. Период полужизни
рецептора составляет 7-12 часов.
При
связывании инсулина с рецептором
изменяется конформация рецептора и
они связываются друг с другом, образуя
микроагрегаты.
Связывание
инсулина с рецептором инициирует
ферментативный каскад реакций фосфорилирования.
Первым делом аутофосфорилируются тирозиновые
остатки на
внутриклеточном домене самого рецептора.
Это активирует рецептор и ведет
к фосфорилированию остатков серина
на особом белке, называемом субстрат
инсулинового рецептора (СИР,
или чаще IRS от
англ. insulin receptor substrate).
Таких IRS выделяют четыре типа – IRS‑1,
IRS‑2, IRS‑3, IRS‑4.
Также к субстратам инсулинового рецептора
относят белки Grb-1 и Shc,
которые отличаются от IRS аминокислотной
последовательностью.
Дальнейшие
события разделяются по двум направлениям:
1.
Реакции, связанные с активностью ферментов
MAP-киназ –
в целом управляют активностью хроматина.
2.
Процессы, связанные с
активацией фосфоинозитол-3-киназы –
в основном контролируют метаболические
реакции. Сюда же относятся процессы,
которые регулируют активность глюкозных
транспортеров и
поглощение глюкозы клетками.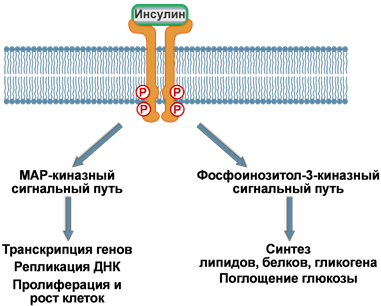
Тем
не менее, такое подразделение
условно,
так как в клетке присутствуют ферменты,
чувствительные к активации и того и
другого каскадного пути.
Соседние файлы в папке Рефераты Презентации
- #
- #
- #
- #
- #
Источник
Поджелудочная железа
После эвакуации из желудка в тонкую кишку пища подвергается наиболее интенсивному перевариванию. Чрезвычайно важную роль в этом процессе играет поджелудочная железа, точнее – ее секреты. Главные компоненты панкреатического сока – это бикарбонат, создающий щелочную среду и нейтрализующий кислый желудочный химус в двенадцатиперстной кишке до pH 6–8 (такой диапазон pH необходим для панкреатических ферментов), и пищеварительные ферменты, расщепляющие основные компоненты пищи.
Поджелудочная железа является экзокринным (секретирующим) и одновременно эндокринным (инкретирующим) органом, участвующим в пищеварении, в регуляции обмена, а также других органов и систем.
Поджелудочная железа, масса которой составляет примерно 110 г, выделяет в сутки от 1,5 до 2,5 л сока. Сок изотоничен плазме крови (независимо от стимуляции), содержит ряд электролитов и солей, а также пищеварительные ферменты. Основные анионы сока – С1- и НСО-, катионы – Na+ и К+ Кроме того, в соке присутствуют катионы Са2+, Mg2+ и анионы НРО При стимуляции концентрация катионов остается без изменений, а анионов меняется в противоположных направлениях. При максимальной секреции концентрация НСОз составляет 130–140 ммоль/л, а pH – 8,2.
Экзокринная функция поджелудочной железы имеет исключительно важное значение для пищеварения. Под влиянием психических, алиментарных, гуморальных и других раздражителей клетки ацинусов поджелудочной железы синтезируют и выделяют в двенадцатиперстную кишку более 20 проферментов и ферментов (главным образом гидролаз), которые участвуют в расщеплении в кишечнике различных составных частей пищи. Пищеварительные ферменты составляют около 90 % белков панкреатического сока. Эту функцию поджелудочной железы называют экболической в отличие от второй экзокринной функции – гидрокинетической, заключающейся в секреции воды, бикарбонатов (до 150 ммоль/л) и других электролитов. Гидрокинетическая функция поджелудочной железы обеспечивает нейтрализацию кислого желудочного содержимого и создает в кишечнике щелочную среду, оптимальную для действия панкреатических и кишечных ферментов.
Панкреатические ферменты подразделяются на амилолитические (гидролиз крахмала), протеолитические (гидролиз белков), липолитические (гидролиз жиров) и нуклеолитические (гидролиз нуклеиновых кислот).
Амилолитические ферменты — амилазы. Расщепление крахмала начинает ?-амилаза, состоящая из нескольких изоферментов, и составляющая примерно 20 % белков в панкреатическом секрете. Основное количество этого фермента выделяется поджелудочной железой в активном виде. Сходный изофермент синтезируется слюнными железами, ?-Амилаза расщепляет полисахариды (крахмал, гликоген) до декстринов, мальтоолигосахаридов, мальтозы и незначительного количества глюкозы. Указанные полимеры далее превращаются в глюкозу кишечными ферментами – мальтазой, ?-амилазой, изомальтазой.
Липолитические ферменты – липазы. Липолиз осуществляется панкреатическими ферментами, однако диагностическое значение в настоящее время имеет лишь липаза (гидролизует триглицериды). Из панкреатического сока выделена еще фосфолипаза (гидролиз фосфолипидов, лецитина) и карбоксил-эстераза (гидролиз эфиров жирных кислот). Поджелудочная железа выделяет основное количество липазы (немного липазы содержится также в слюне и кишечном соке), расщепляющей триглицериды до моноглицеридов и жирных кислот, которые проходят через мембрану энтероцита. Липаза гидролизует водонерастворимый субстрат, что возможно лишь на поверхности мелких эмульгированных частиц жира. Одинаковые количества фермента проявляют различную активность в зависимости от качества эмульсии: чем она тоньше, тем выше активность фермента. Липаза активна в тонкой кишке в присутствии желчных кислот, которые способствуют эмульгированию жиров.
Протеолитические ферменты — протеазы. В панкреатическом соке их много (эндопептидазы – трипсин, химотрипсин, эластаза, экзопептидазы – карбоксипептидазы А и Б). Они относятся к группе сериновых протеаз и составляют 44 % от общего белка панкреатического сока. Существуют множественные формы трипсина и химотрипсина, как и желудочных пепсинов. Ацинарные клетки не синтезируют активные протеолитические ферменты (это грозило бы самоперевариванием органа). Они выделяются в виде неактивных проферментов, которые активируются в кишке. Первым активируется трипсиноген. Под действием кишечного фермента энтерокиназы он превращается в трипсин, а затем активные молекулы трипсина обеспечивают активацию других протеолитических ферментов, включая трипсиноген (процесс активации продолжается уже аутокаталитически).
С панкреатическим соком выделяются фактически два трипсиногена, составляющие около 19 % всех его белков, два химотрипсиногена и две проэластазы. Все они называются эндопептидазами, так как при гидролизе белков «разрывают» внутренние связи между аминокислотами в середине их цепей, продуцируя пептиды. Эндопептидазы специфичны. Например, трипсин гидролизует лишь связи справа от лизина или аргинина, химотрипсин – в основном те, которые рядом с фенилаланином, тирозином и триптофаном. Эластаза способна гидролизовать эластин, белок соединительной ткани, а также другие белки. В отличие от эндопептидаз экзопептидазы разрывают в пептидных цепях С-терминальную, т. е. конечную, связь (карбоксипептидазы) или первую, N-терминаль-ную (аминопептидазы), «освобождая», таким образом, аминокислоты одну за другой.
В панкреатическом соке присутствует ингибитор трипсина – неферментный белок, тесно связанный с протеолизом. Его физиологическое значение заключается в предотвращении преждевременной активации трипсина в протоках поджелудочной железы. Определение его активности в сыворотке крови в динамике имеет значение, свидетельствующее о воспалительно-деструктивных процессах органа при гиперферментемии (синдром «уклонения ферментов»).
Калликреин является протеолитическим ферментом поджелудочной железы. Активированный трипсином, он отвечает за образование в крови каллидина, гипотензивного полипептида, идентичного брадикинину, одному из нейровазоактивных пептидов.
Нуклеолитические ферменты — нуклеазы. Принадлежат к фосфодиэстеразам. В панкреатическом соке они представлены рибонуклеазой, гидролизующей рибонуклеиновую кислоту, и дезоксирибонуклеазой, расщепляющей дезоксирибонуклеиновую кислоту.
Количество и ферментативная активность панкреатического сока зависят от количества и состава принятой пищи. Вне пищеварения, натощак, поджелудочный сок выделяется в небольших количествах. Секрецию панкреатического сока вызывает объемная и стимулирующая желудочное кислотообразование пища. Твердая, густая и жирная пища долго задерживается в желудке (медленнее эвакуируется), поэтому секреция поджелудочной железы дольше, чем после приема жидкой пищи. Основная секреция, однако, начинается в кишечной фазе, т. е. после попадания пищи и продуктов ее переваривания в двенадцатиперстную кишку.
Секреция поджелудочного сока усиливается через 2–3 мин после приема пищи и продолжается 6-14 ч (с максимальным выделением сока на 90-й минуте) в зависимости от ее состава. Смешанная пища вызывает больший секреторный ответ, чем отдельные продукты. Нейтральные жиры и продукты их переваривания больше всего стимулируют продуцирующие ферменты клетки поджелудочной железы. Белки также довольно сильный стимулятор секреции ферментов, в меньшей мере – бикарбонатов и жидкой части панкреатического сока. Поступление аминокислот в кишку вызывает значительное повышение в крови уровня гормона – холецистокинина (прежние названия – панкреозимин, холецистокинин-панкреозимин), местного стимулятора ферментсинтезирующей деятельности ацинарных клеток поджелудочной железы. Особенно сильно влияют фенилаланин, холин, метионин и другие незаменимые аминокислоты.
Преобладание углеводов в питании «щадит» поджелудочную железу, что необходимо учитывать при обострении хронического панкреатита. Малоконцентрированные растворы глюкозы и сахарозы, введенные в двенадцатиперстную кишку, вызывают кратковременную и небольшую стимуляцию секреции ?-амилазы, а концентрированные растворы – резкое угнетение экзокринной секреции.
Соляная кислота является сильным естественным стимулятором внешней секреции поджелудочной железы. Все напитки и продукты, которые возбуждают аппетит, наряду с секрецией желудка усиливают секрецию поджелудочной железы. Так, выраженным сокогонным действием обладают некоторые фруктовые и органические кислоты (яблочная, лимонная, винная, молочная), а также алкоголь.
Зависимость ферментного состава сока поджелудочной железы от качества пищи хорошо известна. Находящиеся в ацинарных клетках гранулы содержат все ферменты, присутствующие в секрете, в постоянном соотношении, так что в панкреатическом соке оно также постоянно. Однако увеличение в пище доли какого-либо компонента рациона (например, белков) постепенно увеличивает синтез соответствующих гидролизующих ферментов. Эта адаптация к диете дала возможность обсуждать вопрос о возможности диетического излечения некоторых дисфункций поджелудочной железы.
Секреция поджелудочной железы регулируется нервными и гуморальными механизмами. В стимуляции панкреатической секреции прямые нервные влияния имеют меньшее значение, чем гуморальные. Ведущее значение в гуморальной регуляции секреции поджелудочной железы принадлежит гастроинтестинальным гормонам. Они относятся к числу пептидов и синтезируются специальными клетками желудка и двенадцатиперстной кишки под влиянием соответствующих химических, механических, нервных или иных стимулирующих факторов.
Секрецию поджелудочной железы усиливают секретин, холецистокинин, а также гастрин, серотонин, инсулин, бомбезин, субстанция П и соли желчных кислот. Тормозят выделение поджелудочного сока глюкагон, кальцитонин, ЖИП, ПП, соматостатин. ВИП может возбуждать и тормозить панкреатическую секрецию. Эффекты гормонов частично опосредуются через их влияние на желудочную секрецию: с усилением ее более кислое содержимое поступает в двенадцатиперстную кишку и посредством ее гормонов повышает панкреатическую секрецию.
Патофизиология
При структурно-функциональных нарушениях поджелудочной железы может нарушаться синтез ферментов, в связи с чем возникают дефекты пищеварения в тонкой кишке. Особенно страдает переваривание жира, так как панкреатический сок содержит наиболее активный фермент липазу. При патологии может не усваиваться до 60–80 % жира, который выводится с калом. В меньшей степени нарушается переваривание белков, может не усваиваться до 30–40 % их количества. О недостаточном переваривании белков свидетельствует появление большого количества мышечных волокон в каловых массах (креаторея) после приема мясной пищи. Переваривание углеводов также нарушено. Развивается недостаточность пищеварения.
Нарушения внешней секреции поджелудочной железы могут быть обусловлены рядом причин. Основные из них следующие:
1) развитие в поджелудочной железе воспалительных процессов (острые и хронические панкреатиты);
2) обтурация протока поджелудочной железы конкрементами (желчнокаменная болезнь, калькулез протоков), паразитами кишечника, белковослизистыми «пробками»;
3) воспалительные процессы в двенадцатиперстной кишке (дуодениты, язвенная болезнь), сопровождающиеся уменьшением образования секретина; вследствие этого понижается секреция панкреатического сока;
4) сдавление протока поджелудочной железы (опухоли, дуодениты, фатериты);
5) развитие тяжелых нарушений обменных процессов организма (ожирение, белково-энергетическая недостаточность, гормональные расстройства и др.) с формированием дистрофических поражений поджелудочной железы (липоматоз, белковая дистрофия, гемохроматоз);
6) аллергическая перестройка организма;
7) неврогенное торможение функций поджелудочной железы (вагальная дистрофия, длительная атропинизация);
8) разрушение опухолью.
В случаях развития обтурационных процессов, затрудняющих или даже прекращающих отток панкреатического секрета в двенадцатиперстную кишку, возникает гипертензия в системе протоков поджелудочной железы, вызывающая не только выраженный болевой синдром, но и внутренние разрывы, разрушения паренхимы органа. Энтерокиназа лизированных клеток поджелудочной железы в этом случае может катализировать активацию ферментов панкреатического сока непосредственно в протоковой системе (особенно трипсиногена). Более того, сам трипсин способен активизировать трипсиноген, как бы запуская «цепную» реакцию ферментативной активизации (аутокаталитическая реакция). В результате описываемых явлений ферменты поджелудочной железы могут осуществлять самопереваривание ткани поджелудочной железы с развитием некрозов.
При разрушении поджелудочной железы активные панкреатические ферменты, продукты тканевой деструкции, нарушенного метаболизма могут всасываться в кровь, в окружающие ткани. В тканях в результате действия на них ферментов развиваются некрозы; особенно характерно появление некрозов жировой клетчатки (сальника), возникающих под влиянием липазы панкреатического сока. Формируется синдром интоксикации организма.
Следующая глава >
Похожие главы из других книг
Поджелудочная железа
Ее влияние в пищеварении огромно. Она выделяет от 600 до 1500 мл пищеварительного сока, в котором содержатся ферменты, действующие на все виды пищи (белки, жиры, углеводы). В основном это трипсин, химотрипсин и карбоксипептидаза, которые становятся
Печень, поджелудочная железа
Печень не успевает выводить неусваиваемые элементы вареной пищи и забивается. Развивается портальная гипертония. Не хватает витаминов, энзимов и других питательных веществ, что приводит к угасанию функции и развитию разнообразных
32. Поджелудочная железа
Поджелудочная железа (pancreas) представляет собой продолговатый призматический по форме орган, располагающийся забрюшинно и лежащий почти поперек задней стенки брюшной полости.Поджелудочная железа играет большую роль в процессах пищеварения и
4. Поджелудочная железа
Сахарный диабетСахарный диабет – заболевание, обусловленное относительной или абсолютной недостаточностью инсулина.Классификация:1) спонтанный диабет (инсулин-зависимый 1-й тип и инсулин-независимый 2-й тип);2) диабет беременных;3) вторичный
Поджелудочная железа
В пищеварительную систему входит также поджелудочная железа, выполняющая две основные функции. Экзокринная часть выделяет значительное количество пищеварительного сока, в деятельности которого ощущается явное присутствие агрессивного
ПОДЖЕЛУДОЧНАЯ ЖЕЛЕЗА И СЕЛЕЗЁНКА
Поджелудочная железа и селезёнка, ввиду их близкого расположения друг к другу, по теории ЧЖЕНЬ-ЦЗЮ терапии сведены в один меридиан с общими клиническими симптомами и, соответственно, одинаковыми методами лечения. Но, поскольку селезёнка
Поджелудочная железа и панкреатит
Панкреатит – довольно сложная и обширная тема, поэтому, перед тем как начать описание современных представлений о поджелудочной железе и связанном с ней заболевании, расскажем о том, как формировались сведения о нем, его диагностике и
Поджелудочная железа
Эта железа продуцирует гормоны (инсулин, глюкагон и др.), поэтому влияет на работу эндокринной системы. Также она вырабатывает панкреатический сок и очень важна для нормальной работы системы пищеварения. В сутки поджелудочная железа выделяет до 1,5 л
Поджелудочная железа
Боли в левом подреберье (иногда опоясывающие), сухость во рту, горят ладони рук, постоянные позывы к мочеиспусканию, ухудшение зрения (особенно правого глаза), зрачок правого глаза больше левого, часто повышается давление, ощущение «песка» в глазах,
Надпочечники и поджелудочная железа
Обычно людей, у которых проблемы с надпочечниками, поджелудочной железой и уровнем сахара в крови, часто захлестывают эмоции, они совершенно забывают про себя, постоянно стараясь угодить другим. У таких людей обычно лучше духовное
Поджелудочная железа
После эвакуации из желудка в тонкую кишку пища подвергается наиболее интенсивному перевариванию. Чрезвычайно важную роль в этом процессе играет поджелудочная железа, точнее – ее секреты. Главные компоненты панкреатического сока – это бикарбонат,
Поджелудочная железа
Переизбыток в пище белков и жиров, неумеренное употребление алкоголя, приводит к нарушению работы поджелудочной железы.Этот небольшой орган не только активно участвует в процессе пищеварения, поставляя в двенадцатиперстную кишку панкреатический
Поджелудочная железа
Функция поджелудочной железы заключается в выработке гормонов инсулина и глюкагона, которые поступают в кровь. Оба гормона влияют на угле водный обмен: инсулин снижает содержание сахара в крови (переводит его в гликоген, который накапливается в
Поджелудочная железа
Поджелудочная железа относится к железам со смешанной функцией. Эндокринная функция осуществляется за счет продукции гормонов панкреатическими островками (островками Лангерганса). Островки расположены преимущественно в хвостовой части железы, и
Поджелудочная железа
Поджелудочная железа, вторая по величине железа пищеварительного тракта (масса 60–100 г, длина 15–22 см), серовато-красного цвета, дольчатая, расположена забрюшинно, перекидывается в поперечном направлении от двенадцатиперстной кишки до селезенки. Ее
Поджелудочная железа
Заболевания поджелудочной железы очень сложно диагностировать, а ведь именно своевременная постановка правильного диагноза может гарантировать успех лечения.Поджелудочная железа расположена позади желудка ближе к спине, в области, называемой
Источник