Гормоны поджелудочной железы презентация скачать
1. ГОРМОНЫ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
2.
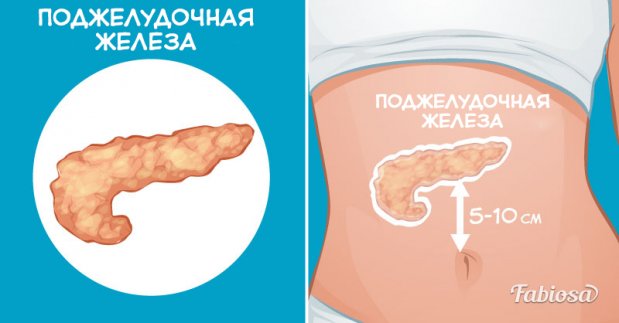
Поджелудочная железа (pancreas) – орган
пищеварительной и эндокринной систем.
1. Экзокринная (внешнесекреторная) функция. В
клетках ацинусов железы синтезируется панкреатический сок, который по панкреатическому протоку выделяется в просвет duodenum. Компоненты сока:
• проферменты (зимогены): трипсиноген, химотрипсиноген, эластаза, карбоксипептидаза, панкреатические липазы (липаза, ФЛазаА2, лизоФЛаза и ХС-эстераза), амилаза и нуклеазы. Зимогены активируются
с участием энтеропептидаз (выделяются клетками
duodenum).
• ионы бикарбоната — нейтрализует кислую реакцию
пищевого комка, поступающего в duodenum из
желудка.
3.
2. Эндокринная функция. Реализуется благодаря
клеткам, лежащим между ацинусами, в виде островков
– островков Лангерганса. Клетки островков:
a — клетки, выделяют глюкагон
— клетки, выделяют инсулин
— клетки, выделяют соматостатин
D — клетки, выделяют вазоактивный интестинальный
пептид
Островок Лангерганса
Островки окружены клетками ацинусов (окрашены розовым цветом). На долю островков
приходится 1-2% от объема pancreas. -клетки
составляют 65-80% от общего числа клеток
островка.
Флуоресцентные антитела против глюкагона дают красное окрашивание (периферия
островков). Флуоресцентные антитела про-тив
инсулина – синее окрашивание (централь-ная
часть островков).
4.
ИНСУЛИН
1889 г. — Минковски и Меринг: устновили, что отсутствие некоего продукта в соке pancreas («диабетический фактор») является причиной сахарного диабета
(СД).
1921 г. — Бантинг и Бест: впервые получили экстракт
из pancreas, который снимал симптомы СД в эксперименте. Доказано, что «диабетический фактор» синтезируется в -клетках островков Лангерганса, его назвали «инсулин» (лат. Insula – островок).
1922 г. — Бантинг и Бест получили препарат очищенного инсулина из pancreas свиньи и впервые в мире
успешно применили инсулин для лечения СД.
1923 г. — Бантинг, Бест и двое их коллег получили
Нобелевскую премию за выделение инсулина. С 1923
года начался выпуск инсулина, как фармпрепарата (из
pancreas свиньи).
5.
ИНСУЛИН
Синтезируется и секретируется -клетками островков Лангерганса.
Инсулин — полипептид (51 аминокислота, m.m. = 5800), состоит
из 2-х пептидных цепей:
А-цепь 21 аминокислота
В-цепь 30 аминокислот
Три дисульфидные (-S-S-) связи: две связи соединяют А- и Вцепи; одна связь находится внутри А-цепи.
Первичная структура инсулина человека и свиньи отличается по единственной а.к. В-цепи в
положении-30: Tre (человек), Ala (свинья).
6.
СИНТЕЗ И ОБРАЗОВАНИЕ
БИОАКТИВНОГО (ЗРЕЛОГО) ИНСУЛИНА
Зрелый (биологически активный) инсулин образуется из молекулы-предшественника – препроинсулина путём поэтапного
протеолиза, катализиремого специфическими эндопептидазами.
1. Из препроинcулина (110
а.к.) протеолитически удаляется фрагмент (23 а.к.) с N-конца
(сигнальная последовательность).
2. В проинсулине образуются три -S-S- связи.
3. Из проинсулина протеолитически удаляется С-пептид.
Образуется зрелый (биоактивный) инсулин.
Зрелый инсулин запасается
в цитоплазме -клеток в секреторных гранулах (гексамеры,
стабилизированные Zn2+).
7.
КОМПАРТМЕНТЫ СОЗРЕВАНИЯ ИНСУЛИНА
Мембрана шероховатого ЭПР: Сигнальная последовательность
связывается с мембраной ЭПР, что позволяет растущей на рибосомах пептидной цепи препроинсулина постепенно проникать во
внутренне пространство ЭПР.
Внутреннее пространство ЭПР: По завершении синтеза препроинсулина происходит протеолитическое отделение сигнальной
последовательности, которая остается связана с мембраной ЭПР.
В пространстве ЭПР выделяется проинсулин. Он подвергается
фолдингу (оптимальная конформация) и образуются все дисульфидные мостики.
Аппарат Гольджи: Проинсулин покидает ЭПР и доставляется в
аппарат Гольджи, где формируются секреторные гранулы. Тут
завершается созревание инсулина: действующие в двух точках
внутриклеточные эндопептидазы «вырезают» фрагмент «Спептид». Зрелый (биоактивный) инсулин: А- и В-полипептидные
цепи, соединённые двумя дисульфидными мостиками. Молекулы
инсулина через атом Zn формируют гексамеры и в таком виде
ожидают метаболического сигнала к экзоцитозу и выходу в кровь.
8.
СИГНАЛИЗАЦИЯ К ОСВОБОЖДЕНИЮ
ИНСУЛИНА В КРОВЬ
Ведущий метаболический сигнал для выделения инсулина –
повышение [глюкозы] в крови.
• Глюкоза проникает в -клетки с помощью ГЛЮТ 2 – вдоль градиента её концентрации (облегчённая диффузия глюкозы).
• Интенсификация окисления глюкозы приводит к повышению
отношения АТФ/АДФ в клетке. Под влиянием этого в клеточной
мембране закрываются АТФ-чувствительные К+ каналы. К+ перестает выходить из клетки и [K+] повышается. В итоге – электроотрицательность цитозольной поверхности мембраны уменьшается, что приводит к её деполяризации. В ответ на это открываются вольтаж-зависимые Са2+ каналы и внеклеточный Са2+ начинает поступать в клетку и активирует рианодиновые Са2+ каналы
мембраны ЭПР: [Ca2+] в цитоплазме повышается.
• Высокая [Ca2+] активирует ФЛазуС, что запускает образование ДАГ и
И3Ф из ФИ-4,5-диФ.
• И3Ф связывается с рецептором мембраны ЭПР, сопряженным с Са2+
каналом, что приводит к резкому повышению [Са2+]. Скачёк [Са2+] запускает экзоцитоз секреторных гранул и выход инсулина в кровь.
9.
Помимо глюкозы, синтез и секрецию инсулина стимулируют:
• аргинин
• лизин
• гормоны ЖКТ: желудочный ингибиторный полипептид (инсулин), секретин (бикарбонат), гастрин (HCl и пепсин) и холецистокинин (панкреатическая амилаза)
• соматотропный гормон
• кортизол
• эстрогены
Снижает секрецию: адреналин
Основные органы-мишени: печень, мышцы (скелетные и миокард) и жировая ткань.
10.
ВНУТРИКЛЕТОЧНЫЙ СИГНАЛЬНЫЙ ПУТЬ ИНСУЛИНА
Рецептор инсулина относится к классу рецепторов клеточной
поверхности, обладающих тирозинкиназной активностью. В
отличие от других рецепторов этого класса, рецептор инсулина
изначально существует как гомодимер.
При связывании инсулина с рецептором в его цитозольных доменах
активируется тирозинкиназа.
В результате перекрестного аутофосфорилирования на обоих доменах появляются фосфотирозины.
Они становятся точками связывания для белка: субстрата инсулинового рецептора (IRS), содержащий
SН2-домен.
Рецепторная тирозиновая киназа
фосфорилирует IRS, что придает
ему способность связываться и активировать внутриклеточную фосфатидилинозитол-3-киназу (содержит SН2-домен).
11.
Схема
активации гликогенсинтетазы инсулином
ФИ-3К содержит SH2-домен. С её
помощью образуется мембранный
ФИ-3,4,5-трифосфат (ФИФ3). Эта
молекула становится начальным
пунктом собственного каскада
киназ. Сначала активируется киназа
PDK-1 (3-phosphoinositide dependent
protein kinase-1), которая далее
активирует ПКВ. ПКВ фосфорилирует
GSK3 (glycogen synthase kinase-3),
чем инактивирует её. В результате
гликогенсинтаза остаётся в активном
(нефосфорилированном) состоянии.
Инсулин активирует РР1
12.
МЕТАБОЛИЧЕСКИЕ ЭФФЕКТЫ ИНСУЛИНА
ПЕЧЕНЬ:
• Активация гликолиза (окисление глюкозы)
• Активация синтеза гликогена: посредством активации ПКВ
(фосфорилирует и инактивирует киназу ГС, параллельно активирует РР1) большая часть ГС переводится в активную (нефосфорилированную) форму синтез гликогена.
• Ингибирование глюконеогенеза:
а). метаболическая регуляция – подавление уже имеющегося
ключевого фермента глюконеогенеза — ф-1,6-биФазы. ПКВ активирует РР1 активация БФБ, который синтезирует аллостерический регулятор ф-2,6-биФ: активатор ФФК (гликолиз) и ингибитор ф-1,6-биФазы (глюконеогенез).
б). влияние на геном — подавление синтеза ключевых ферментов
глюконеогенеза. ПКВ фосфорилирует транскрипционный фактор FOXO1, который в фосфорилированной форме диссоциирует с инсулин-респонсивных сайтов генов, кодирующих
ключевые ферменты глюконеогенеза.
13.
• Активация синтеза липидов: усиление окисления глюкозы
даёт избыток цитрата в ЦТК. Цитрат переносится в цитозоль, где
с участием цитратлиазы превращается в эквимолярное ко-во
ацетил-КоА. ПКВ активирует РР1, которая дефосфорилирует
ацетил-КоА-карбоксилазу и этим активирует её. Это ключевой
фермент синтеза ЖК: ацетил-КоА малонил-КоА (ключевой
метаболит для синтеза ЖК, ТАГ и ХС). Малонил-КоА – аллостерический ингибитор МХ фермента карнитинацилтрансферазы I,
ответственного за перенос длинноцепочечных ЖК в матрикс для
-окисления. Т.о., подавление окисления ЖК в этих условиях
способствует усилению синтеза липидов.
14.
МЫШЦЫ:
Транспорт глюкозы в гепатоциты обеспечивает ГЛЮТ 2. Мембраны адипоцитов и сарколемма миоцитов исходно непроницаемы
для глюкозы. Для транспорта глюкозы необходим ГЛЮТ 4.Инсулин
активирует ПКВ стимуляция специфического белка, ответственнго за экзоцитоз. Под его влиянием цитозольные везикулы, содержащие ГЛЮТ 4, встраиваются в плазматическую мембрану и приносят туда ГЛЮТ 4, что обеспечивает транспорт глюкозы внутрь
адипоциов и миоцитов.
• Активация гликолиза и синтеза гликогена происходит
согласно механизмам, аналогичным для печени. В мышцах есть
дополнительный механизм, трансформации ГС в активную форму.
Глюкозо-6-Ф (не может выходить из миоцитов т.к. нет Г6Фазы)
является аллостерическим активатором РР1.
15.
ЖИРОВАЯ ТКАНЬ:
• Активация синтеза липидов: происходит согласно механизмам, аналогичным для печени.
• Активация гликолиза: служит источником энергии (АТФ) и
глицерол-3-Ф для синтеза ТАГ а адипоцитах. В жировой ткани
гликолиз единственный источник глицерол-3-Ф.
• Ингибирование липолиза:
а). ПКВ активирует РР1, которая дефосфорилирует и ингибирует гормончувствительную липазу (ГЧЛ) (ответственна за
пуск липолитического каскад в адипоитах).
б). ПКВ активирует фосфодиэстеразу цАМФ, которая быстро
разрушает цАМФ – активатор ГЧЛ.
16.
ГЛЮКАГОН
Синтезируется и секретируется a-клетками островков
Лангерганса.
Глюкагон — полипептид (29 аминокислот, m.m. = 3500), состоит из
единственной пептидной цепи.
Метаболическим сигналом для усиления секреции глюкагона снижение [глюкозы] в крови. Орган-мишень – печень.
В процессе регуляции обмена веществ инсулин и глюкагон являются гормонами – антагонистами. Их концентрация в крови изменяется всегда реципрокно: увеличение концентрации инсулина
одновременно сопровождается снижением концентрации глюкагона и наоборот.
Регуляция метаболизма глюкагном осуществляется в теснейшей
связи с гормоном адреналином (мозговое в-во надпочечников).
Секреция адреналина усиливается также в ответ на снижение
[глюкозы] в крови. Органы-мишени адреналина – жировая ткань и
мышцы. Т.о., глюкагон и адреналин – гормоны — синергисты.
17.
Глюкагон и адреналин реализуют регуляторные эффекты,
связываясь с рецепторами, сопряженными с G-белком
(G-protein coupled receptors, GPCR).
глюкагон или адреналин
Активация аденилатциклазы приводит к 20-кратному увеличнию [цАМФ] в цитозоле в течении нескольких секунд. цАМФ является аллостерическим активатором семейства протеинкиназ А (ПКА). Сигнализация
цАМФ быстро «включается» и быстро «выключается»: спустя секунды после активации в
Ga активизируется ГТФаза замена ГТФ на ГДФ и образуется неактивный гетеротример
G-белка. цАМФ разрушается фософдиэстеразой цАМФ. Её активатор – инсулин.
18.
МЕТАБОЛИЧЕСКИЕ ЭФФЕКТЫ ГЛЮКАГОНА
ПЕЧЕНЬ:
• Активация гликогенолиза (расщепления гликогена):
а). цАМФ активирует ПКА, которая активирует киназу гликогенфосфорилазы (киназа-ГФ) (1-я мишень). Под её влиянием фосфорилируется ГФ, переходя в активную форму расщепление
гликогена.
б). ПКА фосфорилирует гликогенсвязывающий белок (2-я мишень) диссоциация из гранул гликогена РР1, что защищает
активную ГФ от дефосфорилирования (инактивации).
• Активация глюконеогенеза:
Снимает ингибирование ключевого фермента глюконеогенеза:
ф-1,6-биФазы. Активированная ПКА фосфорилирует БФБ, который разрушает аллостерический регулятор ф-2,6-биФ. Его концентрация падает и ф-1,6-биФаза перестаёт ингибироваться,
возвращаясь к активной работе стимуляция глюконеогенеза.
Одновременно гликолитическая ФФК лишается активатора
гликолиз тормозится.
19.
• Подавление синтеза липидов:
Активированная ПКА фосфорилирует ацетил-КоА-карбоксилазу, переводя её в неактивную форму снижение синтеза
малонил-КоА – первого метаболита в синтезе ЖК, ТАГ, ФЛ и ХС
подавление синтеза липидов. Одновременно усиливается транспорт длинноцепочечных ЖК в МХ (стимулируется -окисление) исчезает аллостерическое ингибирование карнитинацилтрансфеазы I.
20.
МЫШЦЫ:
В ответ на снижение [глюкозы] в крови усиливается секреция
адреналина, который действует на мышцы как синергист глюкагона. Адреналин действует, связываясь с мышечной изоформой
GPCR – 2-адренорецептор.
• Активация гликогенолиза (расщепления гликогена):
Механизм активации аналогичен таковому в печени. Детали:
а). В мышцах киназа ГФ также активируется под влиянием комплекса Са2+-кальмодулин.
б). Освобождаемая из гликогена глюкоза-6-Ф остается внутри
миоцита, поскольку в нём отсутствует гюкозо-6-Фаза. Вся мобилизованная глюкоза окисляется в клетке, производя энергию для сокращения мышечных волокон (стимуляция гликолиза).
Глюконеогенез поисходит только в печени (90% de novo синтеза глюкозы) и в почках (10% de novo синтеза
глюкозы).
21.
ЖИРОВАЯ ТКАНЬ:
Как и в мышцах, адреналин действует на адипоциты в качестве синергиста глюкагона. На мембране адипоцитов адреналин связывается с
изоформой GPCR – 3-адренорецептором.
• Активация липолиза (ТАГ, образующих жировую
каплю в цитоплазме адипоцита):
Адреналин повышает в цитоплазме адипоцита [цАМФ], которая
активирует ПКА.
а). 1-я мишень ПКА – белок перилипин, образуюет оболочку
жировой капли, препятствуя контакту липазы с субстратом –
ТАГ. Фосфорилированные молекулы перилипина меняют
конформацию и образуют «окна» в оболочке липидной капли, что обеспечивает доступ липазе к ТАГ.
б). 2-я мишень ПКА – липаза: гормончувствительная липаза
(ГЧЛ). Активированная ГЧЛ катализирует реакцию: ТАГ
ДАГ + ЖК. Появление ДАГ запускает работу ДАГ-липазы:
ДАГ МАГ + ЖК. Появление МАГ запускает работу МАГ-липазы. Т.о., ДАГ- и МАГ-липазы активируются субстратами.
ГЧЛ, ДАГ-липаза и МАГ-липаза – образуют липолитический
каскад.
22. Благодарю за внимание
Источник
Презентация на тему: Гормоны поджелудочной железы

Скачать эту презентацию
Скачать эту презентацию
№ слайда 1

Описание слайда:
ГОРМОНЫ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
№ слайда 2
Описание слайда:
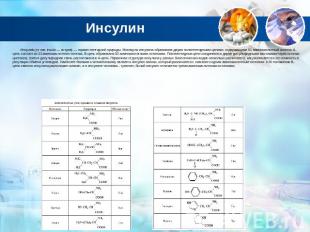
Инсулин Инсулин (от лат. insula — остров) — гормон пептидной природы. Молекула инсулина образована двумя полипептидными цепями, содержащими 51 аминокислотный остаток: A-цепь состоит из 21 аминокислотного остатка, B-цепь образована 30 аминокислотными остатками. Полипептидные цепи соединяются двумя дисульфидными мостиками через остатки цистеина, третья дисульфидная связь расположена в A-цепи. Первичная структура инсулина у разных биологических видов несколько различается, как различается и его важность в регуляции обмена углеводов. Наиболее близким к человеческому является инсулин свиньи, который различается с ним всего одним аминокислотным остатком: в 30 положении B-цепи свиного инсулина расположен аланин, а в инсулине человека — треонин; бычий инсулин отличается тремя аминокислотными остатками.
№ слайда 3

Описание слайда:
Синтез инсулина в клетке Синтез и выделение инсулина представляют собой сложный процесс, включающий несколько этапов. Первоначально образуется неактивный предшественник гормона, который после ряда химических превращений в процессе созревания превращается в активную форму. Ген, кодирующий первичную структуру предшественника инсулина, локализуется в коротком плече 11 хромосомы. На рибосомах шероховатой эндоплазматической сети синтезируется пептид-предшественник — т.н. препроинсулин. Он представляет собой полипептидную цепь, построенную из 110 аминокислотных остатков и включает в себя расположенные последовательно: L-пептид, B-пептид, C-пептид и A-пептид. Почти сразу после синтеза в ЭПР от этой молекулы отщепляется сигнальный (L) пептид — последовательность из 24 аминокислот, которые необходимы для прохождения синтезируемой молекулы через гидрофобную липидную мембрану Эндоплазматический ретикулум (ЭПР). Образуется проинсулин, который транспортируется в комплекс Гольджи, далее в цистернах которого происходит так называемое созревание инсулина. Созревание является наиболее длительным этапом образования инсулина. В процессе созревания из молекулы проинсулина с помощью специфических эндопептидаз вырезается C-пептид — фрагмент из 31 аминокислоты, соединяющий B-цепь и A-цепь. То есть молекула проинсулина разделяется на инсулин и биологически инертный пептидный остаток. В секреторных гранулах инсулин, соединяясь с ионами цинка, образует кристаллические гексамерные агрегаты.
№ слайда 4
Описание слайда:
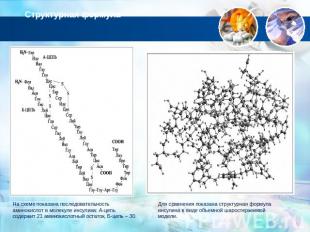
Структурная формула На схеме показана последовательность аминокислот в молекуле инсулина: А-цепь содержит 21 аминокислотный остаток, Б-цепь – 30. Для сравнения показана структурная формула инсулина в виде объемной шаростержневой модели.
№ слайда 5

Описание слайда:
Секреция инсулина Бета-клетки островков Лангерганса поджелудочной железы чувствительны к изменению уровня глюкозы в крови; выделение ими инсулина в ответ на повышение концентрации глюкозы реализуется по следующему механизму:Глюкоза свободно транспортируется в бета-клетки специальным белком-переносчиком GluT 2 В клетке глюкоза подвергается гликолизу и далее окисляется в дыхательном цикле с образованием АТФ; интенсивность синтеза АТФ зависит от уровня глюкозы в крови. АТФ регулирует закрытие ионных калиевых каналов, приводя к деполяризации мембраны. Деполяризация вызывает открытие потенциал-зависимых кальциевых каналов, это приводит к току кальция в клетку. Повышение уровня кальция в клетке активирует фосфолипазу C, которая расщепляет один из мембранных фосфолипидов — фосфатидилинозитол-4,5-бифосфат — на инозитол-1,4,5-трифосфат и диацилглицерат. Инозитолтрифосфат связывается с рецепторными белками ЭПР. Это приводит к высвобождению связанного внутриклеточного кальция и резкому повышению его концентрации. Значительное увеличение концентрации в клетке ионов кальция приводит к высвобождению заранее синтезированного инсулина, хранящегося в секреторных гранулах. В зрелых секреторных гранулах кроме инсулина и C-пептида находятся ионы цинка и небольшие количества проинсулина и промежуточных форм. Выделение инсулина из клетки происходит путём экзоцитоза — зрелая секреторная гранула приближается к плазматической мембране и сливается с ней, и содержимое гранулы выдавливается из клетки. Изменение физических свойств среды приводит к отщеплению цинка и распаду кристаллического неактивного инсулина на отдельные молекулы, которые и обладают биологической активностью.
№ слайда 6

Описание слайда:
Регуляция образования и секреции инсулина Главным стимулятором освобождения инсулина является повышение уровня глюкозы в крови. Дополнительно образование инсулина и его выделение стимулируется во время приёма пищи, причём не только глюкозы или углеводов. Секрецию инсулина усиливают аминокислоты, особенно лейцин и аргинин, некоторые гормоны гастроэнтеропанкреатической системы: холецистокинин, ГИП, ГПП-1, а также такие гормоны, как глюкагон, АКТГ, СТГ, эстрогены и др., препараты сульфонилмочевины. Также секрецию инсулина усиливает повышение уровня калия или кальция, свободных жирных кислот в плазме крови. Понижается секреция инсулина под влиянием соматостатина. Бета-клетки также находятся под влиянием автономной нервной системы.Парасимпатическая часть (холинергические окончания блуждающего нерва) стимулирует выделение инсулина Симпатическая часть (активация α2-адренорецепторов) подавляет выделение инсулина. Причём синтез инсулина заново стимулируется глюкозой и холинергическими нервными сигналами.
№ слайда 7

Описание слайда:
Механизм действия инсулина Так или иначе, инсулин затрагивает все виды обмена веществ во всём организме. Однако в первую очередь действие инсулина касается именно обмена углеводов. Основное влияние инсулина на углеводный обмен связано с усилением транспорта глюкозы через клеточные мембраны. Активация инсулинового рецептора запускает внутриклеточный механизм, который напрямую влияет на поступление глюкозы в клетку путём регуляции количества и работы мембранных белков, переносящих глюкозу в клетку. В наибольшей степени от инсулина зависит транспорт глюкозы в двух типах тканей: мышечная ткань (миоциты) и жировая ткань (адипоциты) — это т.н. инсулинозависимые ткани. Составляя вместе почти 2/3 всей клеточной массы человеческого тела, они выполняют в организме такие важные функции как движение, дыхание, кровообращение и т. п., осуществляют запасание выделенной из пищи энергии.Подобно другим гормонам своё действие инсулин осуществляет через белок-рецептор. Инсулиновый рецептор представляет собой сложный интегральный белок клеточной мембраны, построенный из 2 субъединиц (a и b), причём каждая из них образована двумя полипептидными цепочками. Инсулин с высокой специфичностью связывается и распознаётся а-субъединицей рецептора, которая при присоединении гормона изменяет свою конформацию. Это приводит к появлению тирозинкиназной активности у субъединицы b, что запускает разветвлённую цепь реакций по активации ферментов, которая начинается с самофосфорилирования рецептора.Весь комплекс биохимических последствий взаимодействия инсулина и рецептора ещё до конца не вполне ясен, однако известно, что на промежуточном этапе происходит образование вторичных посредников: диацилглицеролов и инозитолтрифосфата, одним из эффектов которых является активация фермента — протеинкиназы С, с фосфорилирующим (и активирующим) действием которой на ферменты и связаны изменения во внутриклеточном обмене веществ. Усиление поступления глюкозы в клетку связано с активирующим действием посредников инсулина на включение в клеточную мембрану цитоплазматических везикул, содержащих белок-переносчик глюкозы GluT 4. Комплекс инсулин-рецептор после образования погружается в цитозоль и в дальнейшем разрушается в лизосомах. Причём деградации подвергается лишь остаток инсулина, а освобождённый рецептор транспортируется обратно к мембране и снова встраивается в неё.
№ слайда 8

Описание слайда:
Эффекты вызываемые инсулином Физиологические эффекты инсулина Инсулин оказывает на обмен веществ и энергии сложное и многогранное действие. Многие из эффектов инсулина реализуются через его способность действовать на активность ряда ферментов. Инсулин — единственный гормон, снижающий содержание глюкозы в крови, это реализуется через:усиление поглощения клетками глюкозы и других веществ; активацию ключевых ферментов гликолиза; увеличение интенсивности синтеза гликогена — инсулин форсирует запасание глюкозы клетками печени и мышц путём полимеризации её в гликоген; уменьшение интенсивности глюконеогенеза — снижается образование в печени глюкозы из различных веществ Анаболические эффекты инсулинаусиливает поглощение клетками аминокислот (особенно лейцина и валина); усиливает транспорт в клетку ионов калия, а также магния и фосфата; усиливает репликацию ДНК и биосинтез белка; усиливает синтез жирных кислот и последующую их этерификацию — в жировой ткани и в печени инсулин способствует превращению глюкозы в триглицериды; при недостатке инсулина происходит обратное — мобилизация жиров. Антикатаболические эффекты инсулинаподавляет гидролиз белков — уменьшает деградацию белков; уменьшает липолиз — снижает поступление жирных кислот в кровь.
№ слайда 9

Описание слайда:
Регуляция уровня глюкозы в крови Поддержание оптимальной концентрации глюкозы в крови — результат действия множества факторов, сочетание слаженной работы почти всех систем организма. Однако главная роль в поддержании динамического равновесия между процессами образования и утилизации глюкозы принадлежит гормональной регуляции. В среднем уровень глюкозы в крови здорового человека колеблется от 2,7 до 8,3 ммоль/л, однако сразу после приёма пищи концентрация резко возрастает на короткое время. Две группы гормонов противоположно влияют на концентрацию глюкозы в крови:единственный гипогликемический гормон — инсулин и гипергликемические гормоны (такие как глюкагон, гормон роста и адреналин), которые повышают содержание глюкозы в крови Когда уровень глюкозы опускается ниже нормального физиологического значения, высвобождение инсулина из B-клеток замедляется (но в норме никогда не останавливается). Если же уровень глюкозы падает до опасного уровня, высвобождаются так называемые контринсулярные (гипергликемические) гормоны (наиболее известный — глюкагон α-клеток панкреатических островков), которые вызывают высвобождение глюкозы из клеточных запасов в кровь.Адреналин и другие гормоны стресса сильно подавляют выделение инсулина в кровь. Точность и эффективность работы этого сложного механизма является непременным условием нормальной работы всего организма, здоровья. Длительное повышенное содержание глюкозы в крови (гипергликемия) является главным симптомом и повреждающим фактором сахарного диабета. Гипогликемия — понижение содержания глюкозы в крови — часто имеет ещё более серьёзные последствия. Так, экстремальное падение уровня глюкозы может быть чревато развитием гипогликемической комы и смертью.
№ слайда 10

Описание слайда:
Заболевания, связанные с действием инсулина Гипергликемия — увеличение уровня сахара в крови. В состоянии гипергликемии увеличивается поступление глюкозы как в печень, так и в периферические ткани. Как только уровень глюкозы зашкаливает, поджелудочная железа начинает вырабатывать инсулин.Гипогликемия — патологическое состояние, характеризующееся снижением уровня глюкозы периферической крови ниже нормы (обычно, 3,3 ммоль/л). Развивается вследствие передозировки сахароснижающих препаратов, избыточной секреции инсулина в организме. Гипогликемия может привести к развитию гипогликемической комы и привести к гибели человека.Инсулинома — доброкачественная опухоль из бета-клеток поджелудочной железы, вырабатывающая избыточное количество инсулина. Клиническая картина характеризуется эпизодически возникающими гипогликемическими состояниями.Инсулиновый шок — симптомокомплекс развивающийся при однократно введенной избыточной дозе инсулина. Наиболее полное описание можно встретить в учебниках по психиатрии, так как инсулиновые шоки применяли для лечения шизофрении.Синдром хронической передозировки инсулина (синдром Сомоджи) — симптомокомплекс, развивающийся при длительном избыточном введении препаратов инсулина.
№ слайда 11
Описание слайда:
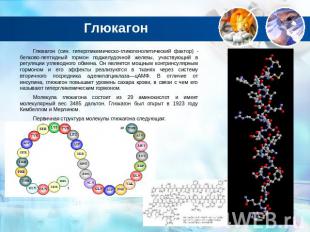
Глюкагон Глюкагон (син. гипергликемическо-гликогенолитический фактор) — белково-пептидный гормон поджелудочной железы, участвующий в регуляции углеводного обмена. Он является мощным контринсулярным гормоном и его эффекты реализуются в тканях через систему вторичного посредника аденилатциклаза—цАМФ. В отличие от инсулина, глюкагон повышает уровень сахара крови, в связи с чем его называют гипергликемическим гормоном.Молекула глюкагона состоит из 29 аминокислот и имеет молекулярный вес 3485 дальтон. Глюкагон был открыт в 1923 году Кимбеллом и Мерлином.Первичная структура молекулы глюкагона следующая:
№ слайда 12
Описание слайда:
Секреция и синтез глюкагона Гормон синтезируется в альфа-клетках островков Лангерганса. В организме продуцируется также кишечный глюкагон (в толстой и тощей кишке, двенадцатиперстной кишке), который иммунологически отличается от панкреатического глюкагона и имеет, по крайней мере, два компонента с молекулярным весом 7000 и 3000. Содержание глюкагона в крови в норме составляет 2 нг/мл. Он инактивируется во многих тканях, но особенно в печени. Физиологически секреция глюкагона стимулируется гипогликемией, например в условиях голодания. С другой стороны, после приема пищи секреция глюкагона также повышается, и обычно считают, что данный механизм стимулирует секрецию инсулина. Предполагают, что в этом случае секретируется кишечный глюкагон, который не усиливает гликогенолиз. Кроме того, секреция глюкагона стимулируется при увеличении в крови аминокислот и подавляется при повышении концентрации жирных кислот или гипергликемии. Последний эффект относится к панкреатическому глюкагону, тогда как секреция кишечного глюкагона под влиянием гипергликемии стимулируется.
№ слайда 13

Описание слайда:
Механизм действия и эффекты глюкагона Глюкагон воздействует главным образом на печень, где немедленно стимулирует гликогенолиз, а спустя более продолжительное время – глюконеогенез и кетогенез. Очищенный рецептор глюкагона из печени крысы и человека представляет собой гликопротеин с мол. массой 60000. Глюкагон взаимодействует с рецептором и активирует аденилатциклазу, увеличивая продукцию цАМФ. Глюкагон способствует расщеплению гликогена, белков и триацилглицеролов. Он ингибирует синтез белка и стимулирует активность лизосом. Глюкагон стимулирует липолиз; вызывая фосфорилирование и тем самым активацию триацилглицероллипазы, а также сильно ингибирует липогенез. В условиях пониженного окисления глюкозы, что часто сопровождает действие глюкагона, это приводит к кетогенезу. Глюкагон не оказывает действия на гликоген мышц, по-видимому, из-за отсутствия в них глюкагоновых рецепторов.
№ слайда 14

Описание слайда:
Действие глюкагона Глюкагон оказывает сильное инотропное и хронотропное действие на миокард вследствие увеличения образования цАМФ (то есть оказывает действие, подобное действию агонистов β-адренорецепторов, но без вовлечения β-адренергических систем в реализацию этого эффекта). Результатом является повышение артериального давления, увеличение частоты и силы сердечных сокращений;В высоких концентрациях глюкагон вызывает сильное спазмолитическое действие, расслабление гладкой мускулатуры внутренних органов, в особенности кишечника, не опосредованное аденилатциклазой;Гипергликемия – при избытке и не своевременной секреции глюкагона;Гипогликемия – при недостаточной секреции глюкагона.О чём может сигнализировать избыток и недостаток глюкагона: Значительное увеличение концентрации глюкагона в крови является признаком глюкагономы — опухоли а-клеток островков Лангерганса. Так же концентрация глюкагона в плазме крови может повышаться при сахарном диабете, феохромоцитоме, циррозе печени, болезни и синдроме Ицен-ко-Кушинга, почечной недостаточности, панкреатите, травме поджелудочной железы. Тем не менее повышение его содержания в несколько раз выше нормы отмечают только при глюкагон-секретирующих опухолях. Низкая концентрация глюкагона в крови может отражать общее снижение массы поджелудочной железы, вызванное воспалением, опухолью или панкреатэктомией.
№ слайда 15

Описание слайда:
Заключение Инсулин – гормон поджелудочной железы. Необходимость в котором возникает тогда, когда в крови повышается содержание глюкозы. Бетта-клетки в этом случае усиливают выброс инсулина, и он, попав в кровяное русло, начинает активно действовать. Во-первых, он делает мембраны клеток организма более проницаемыми для глюкозы, и клетки начинают поглощать ее, а во-вторых, способствует превращению глюкозы в гликоген, который откладывается в печени и мышцах. Благодаря этим мерам содержание сахара в крови снижается. Есть у инсулина антагонист. В роли его противника выступает гормон глюкагон, продуцируемый Альфа-клетками островков Лангерганса. Глюкагон все делает «наоборот». Если инсулин способствует отложению глюкозы в печени и мышцах в виде гликогена и снижает содержание сахара в крови, то глюкагон, напротив, включает механизмы, извлекающие гликоген из депо и повышающие содержание сахара в крови. Эти два гормона являются не только главными регуляторами уровня глюкозы в крови, но принимают участие в управлении деятельностью самой поджелудочной железы. При этом инсулин, в частности, стимулирует синтез пищеварительных ферментов железистыми клетками, а глюкагон тормозит их продукцию и блокирует выделение ферментов из клеток.
Источник