Игх при раке поджелудочной железы

Карциномы ЖКТ — PDF (2.3Mb)
Карциномы ЖКТ
Колоректальный рак является третьим по частоте диагностируемым раком в Соединенных Штатах (за исключением рака кожи) среди мужского и женского населения. Показатели заболеваемости колоректальным раком снижаются на протяжении последних двух десятилетий (с 66,3 случаев на 100000 человек в 1985 году до 45,5 случаев в 2006 году). Это связывают с увеличением использования колоректальных скрининг-тестов, которые позволяют обнаруживать и удалять полипы ЖКТ до их перерождения в рак. В отличие от общего сокращения, среди взрослого молодого населения в возрасте до 50 лет, для которого скрининг не рекомендуется из-за средней степени риска, заболеваемость раком ободочной и прямой кишки увеличивались с 1994 года примерно на 2% в год у мужчин и женщин.
Смертность
В 2016 году США смертность от колоректального рака ожидается на уровне 49500 случаев. Смертность от колоректального рака снизились в обоих группах мужчин и женщин за последние несколько десятилетий, с более крутым снижением в последний период времени. Это снижение отражает снижение показателей заболеваемости и улучшение ранней диагностики и лечения.
Признаки и симптомы
Ранние стадии рака ободочной и прямой кишки обычно не имеют симптомов, поэтому, чтобы выявить заболевание на этой ранней стадии часто необходим скрининг. Прогрессирование болезни может вызвать кровотечение из прямой кишки, появление крови в кале, изменение в опорожнении кишечника, схваткообразные боли в нижней части живота.
Иммуногистохимия (ИГХ) при раке толстой кишки
Применение ИГХ при раках толстого кишечника рассматривается на нескольких уровнях: для характеристики опухолей (эндокринный или эпителиальный тип), наследственной предрасположенности и для целей прогноза. Преобладающее использование ИГХ это определение возможных или предполагаемых метастазов, в которых толстой кишки является возможным первичным. Типичной локализацией для метастазов толстой кишки являются печень и легкие, оба органа, которые могут производить морфологию рака идентичную метастазам из толстой кишки. ИГХ, ( класс I правил регулирования FDA), используется после первичной диагностики опухоли путем гистопатологического исследования и не включается для клиницистов как независимое исследование.
Метастатическая карцинома
Наиболее часто применение иммуногистохимии в изучени опухолей печени – это определение источника метастаза, когда первичная локализация опухоли не известна. Развитие и применение панели для иммунных окрашиваний может помочь решить почти все диагностические проблемы. 2-6 Цитокератины (CK) 7 и CK 20 – первая ступень в идентификации многих опухолей и с дополнительными иммунными реакциями относительно специфичными для опухолей женского и мужского полового тракта, нередко дает возможность идентифицировать первичную локализацию метастатической опухоли.
Желудок
Иммуногистохимические исследования (ИГХ) , как правило, не требуются для оценки доброкачественных и злокачественных эпителиальных опухолей желудка, так как гистопатология, как правило, обеспечивает диагностику, но ИГХ нужна при изучении метастатического рака желудка, когда источник происхождения опухоли не ясен, или когда макроскопические / рентгенологическое проявления опухоли сбивают с толку (например, рак желудка напрямую и широко прорастает в печень и гистологически неотличим от холангиокарциномой). К тому же, ИГХ может быть полезна для идентификации некоторых вариантов желудочных карцином, включая гепатоидную аденокарциному, в которой печеночная дифференцировка может быть подтверждена позитивной реакцией на альфа-фетопротеин AFP.
Аденокарцинома
Аденокарциномы желудка будут реагировать со многими антителами
против кератинов, включая AE1 & AE3, CK35betaH11, CK 18, CK 19, CK 7, и CK 20. Когда CK 7 и CK 20 используются вместе, многие аденокарциномы желудка будут окрашиваться как CK 7 так и CK 20.5,8-10.
Примерно 25% случаев будет иметь фенотип CK 7 + / CK 20-, или CK 7- / CK 20+), и небольшое число случаев будет отрицательным для обоих маркеров. Первоначально считалось, что CDX-2 — специфический маркер для рака толстой кишки, будет реактивными в более чем 50% от случаев 11-12 и может быть свидетельством меньшей степени инвазивности. 13-14 Даже
Нер Пар-1, полезный маркер для гепатоцитов, будет положительным в более чем в 50% рака желудка, в том числе перстневидноклеточной карциномы.15 Количество и качество образования слизи карциномой желудка, с точки зрения иммуногистохимического исследования муцина, может быть
прогностически важным; экспрессия MUC2 связана с плохим прогнозом выживания.
Нейроэндокринная карцинома
Нейроэндокринная карцинома характеризуется положительным окрашиванием на синаптофизин, хромогранин, виллин и CD57.17-18 В отличие от аденокарциномы желудка, раки, происходящие во второй части двенадца-типерстной кишки могут быть отрицательными для обоих маркеров- синаптофизина и хромогранина, но часто вступают в реакцию с антителами против соматостатина. Маркер пролиферации Ki-67 и молекула адгезии Е-кадгерин, были использованы для оценки агрессивности нейроэндокринных carcinoma.19 Увеличение индекса пролиферации Ki-67 (<или = 2%, 3-20% и> 20% для G1, G2, G3 и поражений соответственно) 20 предсказывает
агрессивное поведение, и потеря Е-кадгерина может предсказать развитие
метастазов в лимфатических узлах.
Желудочно-кишечная аденокарцинома с нейроэндокринной дифференцировкой
Аденокарцинома желудка, как кишечного типа, так и типа перстневидноклеточной карциномы, могут иметь нейроэндокринную дифференцировку и что может быть не очевидно по гистологической картине, но проявляться по окрашиванию хромогранином и /или синаптофизином.
ГИСТ — гастроинтестинальные стромальные опухоли
Антитело против CD117 окрашивает большинство случаев гастроинтестинальных стромальных опухолей (ГИСТ), в том числе метастазов.21-25 Хотя могут быть вариации в распределении CD117(+) клеток в пределах данной опухоли, в большинстве случаев окрашивание является диффузным. Когда реакция на CD117 положительна в опухолях отличных от ГИСТ, окрашивание почти всегда неоднородно. Окрашивание на CD34 также можно увидеть в ГИСТ. ГИСТ негативны на CD117 в 10 -15% случаев. Антитело Dog1, как было показано, маркирует большинство CD117 отрицательных ГИСТ.26 Кроме того, потеря SDHB, как было доказано, — постоянный признак ГИСТ с дефицитом SDHB, что ,таким образом, может быть полезным для выявления особого варианта этого заболевания.
Толстый кишечник. Аденома и аденокарцинома.
Аденомы (трубчатые аденомы, тубулярные аденомы, аденомы ворсинок) демонстрируют те же иммуногистохимические реакции, что и аденокарцинома кишки. Почти все они реагируют с антителами, направленными против CK 20 и меньшинство также окрашивается очагово
с CK 7, в отличие от панкреатических аденокарцином,
большинство из которых являются CK 20 отрицательными и положительными по СК 7.
Дифференциальная диагностика метастатической колоректальногй аденокарциномы и аденокарциномы, возникающей в других местах зачастую представляет из себя сложную задачу.
Легочная аденокарцинома может напоминать колоректальную. CK 7 и CK 20
могут быть полезными в этой ситуации, поскольку CK 7, как правило, сильно
положителен в аденокарциноме легкого, а CK 20 обычно отрицателен; обратная картина наблюдается с колоректальными
аденокарциномами. Кроме того, транскрипционный фактор щитовидной железы 1 (TTF-1) обычно положителен в раковых заболеваниях легких,
а CDX-2 и бета-катенин как правило положительны в колоректальном раке. Карциномы эндометриоидного типа могут также гистологически быть неотличимы от колоректальной карциномы. Здесь, опять же, CK 7 положителен почти во всех эндометриоидных аденокарциномах и лишь слегка реактивен в колоректальной аденокарциноме. CK 20, как правило, негативен для первичных опухолей легких, но дает положительный результат на ободочной и прямой кишке.
Аденокарцинома аппендикса
Аденокарциномы аппендикса, как правило, показывают окрашивание на MUC5AC, в отличие от аденокарциномы ободочной кишки, в которой данное антитело редко реактивно. Это особенно полезно при изучении муцинозных аденокарцином, которые образуют метастазы в брюшной полости. Бета-катенин является еще одной мишенью дифференцировочных антител, положительных почти во всех ободочных аденокарциномах и отрицательных в аденокарциноме аппендикса.
У женщин с абдоминальным муцинозным карциноматозом, различие ободочной и аппендикулярной аденокарциномы из яичников играет важную роль. В ободочной опухоли, часто экспрессируются виллин и бета-катенин; в метастазах в аппендиксе часто экспрессирован виллин, но бета-катенин является редким и в овариальных муцинозных аденокарциномах ни виллин, ни бета-катенин не выявляются.
Подобно поражениям аппендикса, аденокарциномы экспрессируют MUC5AC и подобно колоректальным аденокарциномам, яичниковые муцинозные аденокарциномы экспрессируют CDX-2. Полезными добавками к основным панелям для неизвестных первичных опухолей, в которых подозреваются аппендикулярные или муцинозные опухоли яичников, являются MUC5AC и бета-катенин. Виллин также может быть полезным, поскольку он обычно имеет “brush-border” картину окрашивания и в ободочной и в аппендикулярной аденокарциномах и, как правило, цитоплазматическую в поражениях яичников и поджелудочной железы.
Инвазивная аденокарцинома протоков
Аденокарциномы поджелудочной железы, как правило, происходят из предшествующих стадий дисплазии протока поджелудочной железы.
Иммуногистохимический паттерн высокодифференцированных панкреатических интраэпителиальных неоплазий такой же, как у инвазивной аденокарциномы поджелудочной железы и не может быть использован для их дифференциальной диагностики.
Аденокарцинома протока поджелудочной железы напоминают аденокарциному желчных протоков и желчного пузыря по картине световой микроскопии, а также по иммунофенотипическим проявлениям. Панкреатические аденокарциномы реагируют
с антителами к различным цитокератинам, в том числе CK 8,
CK 17, CK 18, CK 19, CAM 5.2 и AE1 & AE3.5,32.
Аденокарциномы поджелудочной железы, как правило, являются CK 7 и
CK 20 положительными. Поджелудочная аденокарцинома также может быть
слабо позитивной по CDX-2.
Почти все аденокарциномы поджелудочной железы являются CEA и СА-125 положительными. Они также могут иметь незначительную составляющую
нейроэндокринных клеток, которые будут реагировать с антителами к соматостатину, синаптофизину, хромогранину или другим нейроэндокринным
маркерам. Терапия также может быть предсказана при положительном окрашивании на фактор роста эндотелия сосудов и отрицательном — на
SMAD4 (DPC4). Потеря экспрессии SMAD4 в эпителии желчных протоков также была показана в случае хронической желчнокаменной болезни. Хорошо дифференцированные метастатические аденокарциномы поджелудочной железы в печени могут быть сложно отличимы от доброкачественных поражений желчных протоков при исследовании биопсийного материала. Тем не менее, в отличие от доброкачественных поражений, они как правило, экспрессируют р53, цитоплазматический mCEA, и другие маркеры, включая CA-125.
Нейроэндокринные опухоли и опухоли из эндокринных клеток, низкодифференцированные и высокодифференцированные.
Низко- и высокого дифференцированные нейроэндокринные опухоли, как правило, оцениваются по иммунофенотипическим проявлениям, однако в целом, интенсивность окрашивания меньше у полноценных опухолей.
Они могут быть сгруппированы по преобладанию секретируется гормона (например: соматостатин, гастрин), но, как правило, также окрашиваются антителами к синаптофизину и хромогранину, а также к различным кератинам, в том числе CK 8, CK 18, CK и 35betaH11. CK 7 и
CK 20, как правило, негативны. CD56 и CD57, как правило,
окрашиваются более интенсивно в высокодифференцированных нейроэндокринных опухолях, чем в низкодифференцированных; в мембранном рисунке CD56 также будет положительным в большей степени, нежели SATB2. Поэтому SATB2 является хорошим маркером идентификации рака ободочного происхождения при работе с опухолью неизвестного происхождения. Другим потенциальным полезным свойством
полезность SATB2 является выявление нейроэндокринных опухолей и
карцином левой толстой и прямой кишки, так как SATB2
как правило, отрицателен в других нейроэндокринных новообразованиях
ЖКТ, поджелудочной железы и легких.
Новость от 26/04/2017
Источник
Резюме. Представлено наблюдение из практики по морфологической диагностике редко встречающейся гигантоклеточной опухоли поджелудочной железы, в котором отмечен возможный различный ее гистогенез — эпителиальный или мезенхимальный. Гигантоклеточная опухоль поджелудочной железы выявлена при КТ-исследовании у больной К., 51 год, диагностирована клиническим цитологом по материалу пункции опухоли, подтверждена гистологическим и иммуногистохимическим методами исследования операционного материала. Положительная реакция на виментин и CD68 позволяет подтвердить ее мезенхимальный генез.

Гигантоклеточная опухоль (ГКО) поджелудочной железы (ПЖ) является редким новообразованием с неустановленным потенциалом злокачественности и спорным гистогенезом. Согласно Международной гистологической классификации опухолей ПЖ данный патологический процесс необходимо дифференцировать между протоковой аденокарциномой — индифферентной карциномой с остеокластоподобными гигантскими клетками и неэпителиальной опухолью [2, 10]. Эти две нозологические единицы, имеют различные биологические потенции и иммуногистохимический (ИГХ) профиль, и как следствие, — разное клиническое течение и прогноз.
В историческом аспекте первое описание морфологических признаков ГКО ПЖ как «необычной карциномы» сделано еще в середине ХХ века [17], а затем дополнено сообщением в начале ХХІ века [19]. Накопленный с тех пор международный опыт позволил установить некоторые клинические и морфологические особенности данной нозологической формы, что нашло свое отражение в ряде руководств по патологии [3, 6, 11]. По данным литературы, опухоль чаще всего возникает на 6–7-м десятилетии жизни, в большинстве случаев у женщин, с преимущественным поражением тела и хвоста ПЖ. Согласно данным литературы, цитологическое исследование материала, полученного при тонкоигольной аспирационной биопсии (ТИАБ) под УЗ-контролем, позволяет установить точный морфологический диагноз еще на дооперационном этапе. Различия в клеточном составе, установленные морфологически и иммуногистохимически, позволяют выделить по меньшей мере 2 подтипа данного новообразования — остеокластоподобная гигантоклеточная опухоль (ОГКО) и плеоморфная гигантоклеточная карцинома (ПГКК). Предполагается также наличие между этими вариантами промежуточных форм [12], обозначаемых как смешанный тип. Указанные подтипы имеют несколько различный биологический потенциал, что предопределяет различный характер течения и лечения. ПГКК характеризуется наличием в цитологических препаратах 3–4 типов клеток [5, 13, 15], основными из которых являются причудливые полиморфные многоядерные гигантские клетки, имеющие положительную ИГХ-реакцию на цитокератины низкой молекулярной массы и негативную реакцию на мезенхимальные маркеры, а также примесь гигантских многоядерных клеток типа остеокластов. Данная опухоль может сопровождаться повышением уровня сывороточного СА 19–9 [4, 18] и характеризуется худшим прогнозом. ПГКК расценивается как исходящая из клеток протокового эпителия ПЖ, и эпителиальное происхождение данной опухоли не подвергается сомнению. В противоположность этому ОГКО ПЖ морфологически более напоминает доброкачественную ГКО кости, а также других паренхиматозных органов, в которых она описана (печень, щитовидная железа, околоушная слюнная железа, молочная железа) [4]. Она отличается более благоприятным течением и прогнозом, чем классическая аденокарцинома ПЖ. Цитограмма ОГКО ПЖ характеризуется большим количеством гигантских многоядерных клеток, сходных с остеокластами, а также наличием популяции одноядерных клеток с атипией различной степени выраженности. В настоящее время имеется достаточно подробное описание цитоморфологии этой опухоли [12], где авторы отмечают такие детали как фон мазка (кровь без примеси детрита и элементов воспаления), взаиморасположение клеточных элементов, количество и ультраструктурные особенности ядер многоядерных клеток (5–30 однотипных округло-овальных ядер с просматривающимися ядрышками). При электронной микроскопии [8, 9, 14] в гигантских и «стромальных» клетках выявлен богатый гранулярный эндоплазматический ретикулум и гранулы белковой природы, идентичные описанным в ацинарных клетках ПЖ. Гигантские клетки имели микроворсинки, а между «стромальными» клетками определялись многочисленные десмосомы. Эти данные позволяли предполагать, что именно эпителиальные, в частности — ацинарные, элементы являются предшественниками опухолевого клона клеток. Однако иммунофенотип остеокластоподобных клеток, детально изученный рядом авторов позднее [5, 7, 15], оказался идентичен таковому клеток классической ГКО кости (положительная реакция на CD4, CD13, CD45, CD68, CD71 и виментин, негативная реакция на цитокератины, раково-эмбриональный антиген и лизоцим), что свидетельствует в пользу их мезенхимального, гистиоцитарного происхождения. К тому же отсутствие в этой клеточной популяции мутации гена K-ras как наиболее важной соматической мутации в клетках на ранних стадиях канцерогенеза [1] опровергает их эпителиальную природу [15]. Ряд авторов [7] предполагают, что наличие остеокластоподобных гигантских клеток в ткани опухоли может быть связано с циркулирующими моноцитарными стволовыми клетками, которые стимулируются местными тканевыми факторами или факторами, продуцируемыми опухолью, такими как цитокины, влияющими на пролиферацию и дифференцировку в остеокластоподобные гигантские клетки. Еще ближе к пониманию гистогенеза этой «необычной карциномы» подводит нас в своей работе современный автор, указывая на общие черты одноядерных опухолевых клеток и остеокластов [16]. И возможно, правы те авторы, которые предполагают, что недифференцированная карцинома с остеокластоподобными гигантскими клетками и ПГКК могут представлять морфологический спектр с «чистой» ОГКО на одном конце и ПГКК на другом [12]. Соотношение же эпителиального и мезенхимально-макрофагального компонентов зависит, вероятно, от степени молекулярной мимикрии опухолевых клеток. Неоднозначная генетическая интерпретация ГКО, по данным литературы, и редкость встречаемости этой формы в ПЖ послужило основанием для настоящей публикации.
Пациентка К., 51 год, находилась на обследовании и лечении в Национальном институте рака в отделении опухолей органов брюшной полости и забрюшинного пространства с 21.06.2011 г. по 26.07.2011 г.
Диагноз при поступлении: опухоль крючковидного отростка ПЖ, T2NxM0, стадия ІІ, клиническая группа ІІ.
Из анамнеза жизни известно, что 23.08.2007 г. пациентке выполнена резекция правого яичника и маточной трубы и аднексэктомия слева по поводу фолликулярных кист.
При поступлении пациентка предъявляла жалобы на слабость, болезненность в эпигастральной области, преимущественно в левом подреберье. Со слов пациентки при очередном контрольном обследовании по месту жительства опухоль не была выявлена, но, учитывая наличие жалоб, больную направили на дообследование и для выбора тактики лечения в Национальный институт рака. При клиническом обследовании: кожа и видимые слизистые бледнорозовые, чистые. При пальпации органов брюшной полости отмечала болезненность в подреберье больше слева. Опухоль не пальпировалась. Печень у реберной дуги чувствительная при пальпации, край ее острый. В нижней части живота ни опухоли, ни болезненности не отмечено. Пациентка прошла полное клинико-рентгенологическое и лабораторное обследование.
На электрокардиограмме от 17.06.2011 г. выявлены умеренные изменения миокарда.
При фиброколоноскопии от 23.06.2011 г. установлен хронический колит.
Эзофагогастродуоденоскопия от 21.06.2011 г. позволила констатировать, что слизистая пищевода не изменена. Слизистая желудка гиперемирована, складки эластичные.
Результат компьютерной томографии (КТ) от 17.06.2011 г.: в забрюшинном пространстве определяется увеличение крючка головки ПЖ за счет гиподенсного образования. Размеры его — 2,2 × 2,6 см. В головке, теле, хвосте паренхима ПЖ не изменена, сохраняется ее дольчатая структура. Панкреатический проток не расширен. К образованию тесно прилежит левая тонкокишечная вена. На этом же уровне определяется нижняя панкреатодуоденальная артерия. Ствол верхней брыжеечной вены и артерия в опухолевой процесс не вовлечены. Образование частично сдавливает отдел двенадцатиперстной кишки. Данных об увеличенных лимфатических узлах не выявлено. Со стороны соседних органов и их структуры патологические изменения не выявлены (рис. 1).
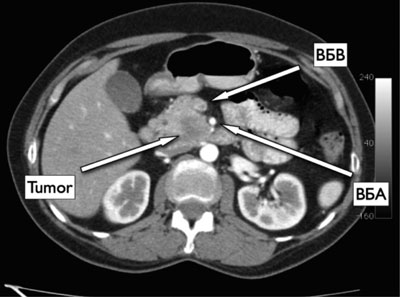
Рис. 1. КТ. Опухоль крючковидного отростка ПЖ. ВБВ — верхняя брыжеечная вена, ВБА — верхняя брыжеечная артерия
При консультации кардиолога от 30.06.2011 г. выявлена метаболическая кардиопатия, СН 0. Климактерический синдром.
Для верификации патологического процесса в ПЖ выполнена диагностическая пункция под контролем УЗИ. Получен кровянистый материал, из которого приготовлены 4 мазка на предметных стеклах и отправлены в цитологическую лабораторию, где они окрашены по методу Паппенгейма (рис. 2, 3). При исследовании цитологических препаратов выявлена кровь и большое количество одноядерных и многоядерных клеток, которые располагались разрозненно и в скоплениях. Одноядерные клетки имели различную форму и размеры. Преобладали элементы вытянутой формы. Среди них отмечены овальные и реже — округлые экземпляры. Цитоплазма их тонкая, базофильная, отростчатая, почти во всех клетках мелковакуолизированная. Одноядерные клетки определялись в группах и в виде небольших пластов, напоминающих соединительнотканные и гистиоцитарные с признаками пролиферации. Ядра в них окрашивались в фиолетовые тона средней интенсивности, немного отличались по форме и размерам. Чаще они были вытянутые и овальные, встречались и округлые. Определялись дистрофически измененные ядра, лишенные цитоплазмы. При этом они имели неровные контуры и окрашивались в более светлые тона по сравнению с сохранными ядрами. Структура хроматина мелкозернистая, чаще — равномерная. Изредка встречались ядра с глыбчатой структурой хроматина. В части клеток определялись единичные мелкие ядрышки. Многоядерные клетки имели от 2–3 округлых небольших ядер до нескольких десятков. Ядра были мономорфные, неравномерно располагались по всей цитоплазме, в центре и по периферии. Они были преимущественно округлой формы, часть из них содержала по 1–2 укрупненных ядрышка. Окрашивались ядра с одинаковой интенсивностью. Цитоплазма клеток базофильная, хорошо развита, неправильной многоугольной отростчатой формы. В ней часто определялись мелкие вакуоли и оксифильная зернистость. По всем структурым признакам многоядерные клетки соответствовали остеокластам. Описанная картина цитограммы позволила клиническому цитологу констатировать ГКО. Признаки атипии ни в одноядерных, ни в многоядерных клетках, которые могли бы отражать злокачественность опухоли не найдены.
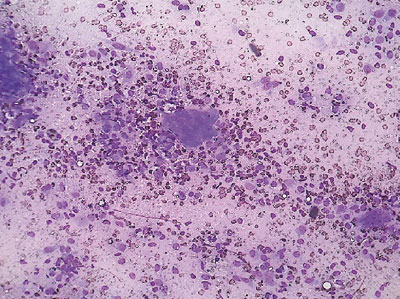
Рис. 2. Цитологический препарат. Опухоль ПЖ — ГКО. Окраска по Паппенгейму. Ув. 200
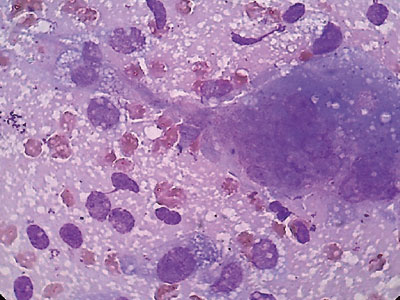
Рис. 3. Фрагмент рис. 2. Ув. 1000. Одноядерные и многоядерная клетки с вакуолизированной отростчатой цитоплазмой
Учитывая полученные данные клинического обследования, результатов компьютерного и цитологического исследований, решено выполнить максимальный объем оперативного вмешательства — панкреатодуоденальную резекцию.
06.07.2011 г. проведена панкреатодуоденальная резекция с лимфодиссекцией по принятой в клинике методике (рис. 4).
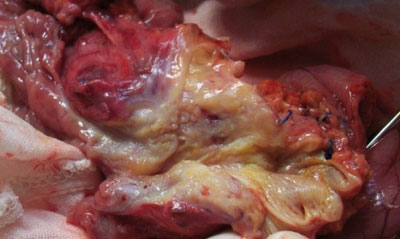
Рис. 4. Операционный препарат
На утро следующего дня после операции состояние удовлетворительное, пациентка в сознании, ориентируется в пространстве. Гемодинамика стабильная: АД = 80/60 мм. рт. ст., ЧСС = 88 уд. в мин, ЧД = 17. Показатели крови соответствовали течению общего состояния пациентки в послеоперационный период, без выраженных отклонений от нормы.
В гистологическую лабораторию доставлен материал больной К., 51 год, после выполненной панкреатодуоденальной резекции. Макроскопическое описание: ПЖ с опухолью и двенадцатиперстной кишкой, желчный пузырь, лимфатические узлы. На разрезе — опухолевый узел размерами 2 х 2,5 х 3 см с неровными контурами, с кальцинатами, структура опухоли неоднородной консистенции. Желчный пузырь и сальник без особенностей.
Патологогистологическое заключение № 27762 — 71/2011: гигантоклеточная опухоль поджелудочной железы (синоним — фиброзная гистиоцитома). Желчный пузырь — явления хронического холецистита. В лимфатических узлах и в большом сальнике элементы опухоли не определяются.
Микроскопически опухоль имеет многоузловое строение. Узелки размерами 7–12 мм разделены прослойками фиброзной ткани. В составе опухолевых узелков преобладают одноядерные клеточные элементы, преимущественно отростчатой или веретеновидной формы, часть из них подобна гистиоцитарным клеткам. Среди перечисленных клеточных элементов находятся множественные гигантские многоядерные клетки. Последние имеют неправильную или вытянутую форму (рис. 5 а, б). Местами обнаруживаются небольшие кровоизлияния в паренхиму опухоли. В опухоли содержится множество мелких кровеносных сосудов.
Для уточнения гистогенеза опухоли проведены ИГХ исследования с использованием следующих антител:
- Monoclonal Mouse Antibody to Human Cytokeratin Clone AE1/AE3 (DBS, США);
- Monoclonal Mouse Anti-Vimentin, Clone V9 (Dako, Дания);
- Monoclonal Mouse Anti-Human Neuron-Specific Enolase, Clone BBS/NC/VI-H14 (Dako, Дания);
- Polyclonal Rabbit Anti-Human S100 protein, (Dako, Дания);
- Monoclonal Mouse Anti-Human CD68 Clone PG-M1 (Dako, Дания);
- Monoclonal Mouse Anti-Human CD1a, Clone 010 (Dako, Дания);
- Monoclonal Mouse Anti-Human Smooth Muscle Actin, Clone 1A4 (Dako, Дания);
- Monoclonal Mouse Anti-Human Ki-67 Antigen, Clone MIB-1 (Dako, Дания).
Выполненные ИГХ исследования показали, что большинство одноядерных и все многоядерные клетки опухоли экспрессируют винментин (рис. 5 в). Около 40% одноядерных клеток и все гигантские многоядерные клетки дают позитивную реакцию на CD68 (рис. 5 г). Гладкомышечный актин экспрессируют одиночные клетки в составе опухолевых узелков, а также клетки в составе фиброзных тяжей. Местами в опухоли обнаруживаются небольшие группы клеток, экспрессирующие S100-белок. В соединительнотканных септах, разделяющих опухолевые узелки, встречаются одиночные или группы клеток, позитивные на панцитокератин. Позитивная реакция на Ki-67 выявляется в ядрах 8% опухолевых клеток.
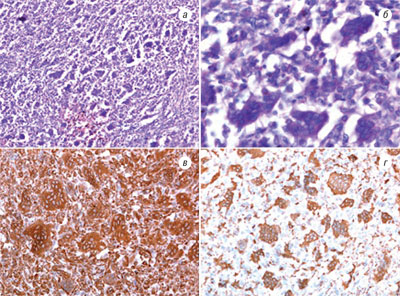
Рис. 5. Гистологический препарат. ГКО ПЖ. Окр. гематоксилином и эозином: а) ув. 100; б) ув. 400; в) экспрессия виментина в клетках опухоли, ув. 200; г) экспрессия CD68 в клетках опухоли, ув. 200
Результаты ИГХ исследований подтверждают гистиоцитарный генез ГКО ПЖ.
При выписке пациентка жалоб не предъявляла. В удовлетворительном состоянии выписана под наблюдение онколога по месту жительства. Рекомендовано контрольное обследование в НИР через 3 мес.
При контрольном обследовании от 01.11.2011 г.: КТ органов грудной, брюшной полости, забрюшинного пространства; УЗИ органов брюшной полости и забрюшинного пространства; общий анализ крови, биохимический анализ крови — по данным клинического осмотра прогрессирования опухолевого процесса не выявили. Рекомендовано продолжение наблюдения.
При повторном контрольном обследовании: КТ от 14.03.2012 г. — в легких без очаговых образований. Лимфоузлы средостения не увеличены. Синусы свободные. Печень однородной плотности. ПЖ после удаления головки с сохранением ее тела и хвоста. Вирсунгов проток не расширен. Селезенка однородной плотности. Стенки желудка не утолщены. Мезентериальные и забрюшинные лимфатические узлы не увеличены. В малом тазу: мочевой пузырь с ровными стенками. В костях скелета в зонах исследования без деструктивных изменений. Данные о рецидиве или метастазах не выявлены. Рекомендовано контрольное обследование через 4–6 мес.
Таким образом, проведенные цитологическое, гистологическое и ИГХ исследования редко встречающейся ГКО ПЖ свидетельствуют о мезенхимальном ее генезе, что не исключает так называемого эпителио-мезенхимального перехода, о чем неоднократно упоминается в новых экспериментальных работах.
Литература
1. Амосенко Ф.А., Казубская Т.П., Громыко О.Е. и др. (2009) Мутации в генах K-ras, BRCA1/2, CHEK2 и микросателлитные маркеры (потеря гетерозиготности в локусах 9p, 17p и 18q) при спорадических аденокарциномах поджелудочной железы. Молекулярная биология, 43 (3): 414–421.
2. Паклина О.В., Щеголев А.И., Галил-Оглы Г.А. и др. (2005) Классификация опухолей экзокринной части поджелудочной железы. Архив патологии, 3: 45–50.
3. Пальцев М.А., Аничков Н.М. (2005) Атлас патологии опухолей человека, М.: Медицина, 259.
4. Singhal A., Shrago S.S., Li S.-F. et al. (2010) Giant cell tumor of the pancreas: a pathological diagnosis with poor prognosis. Hepatobiliary Pancreat Dis Int, 9: 433–437.
5. Bauditz J., Rudolph B., Wermke W. (2006) Osteoclast-like giant cell tumors of the pancreas and liver. World J Gastroenterol, 12: 7878–7883.
6. Nguyen G.-K. (2008) Essentials of abdominal fine needle aspiration cytology, 1st Ed; 20–21.
7. Goldberg R.D., Michelassi F., Montag A.C. (1991) Osteoclast-like gian cell tumor of the pancreas: immunophenotypic similarity to giant cell tumor of bone. Hum Pathol, 22: 618–622.
8. Jalloh S.S. (1983) Giant cell tumour (“osteoclastoma”) of the pancreas — an epithelial tumour probably of pancreatic acinar origin. J Clin Pathol, 36: 1171–1175.
9. Jeffrey I., Crow J., Ellis B.W. (1983) Osteoclast-type giant cell tumour of the pancreas. J Clin Pathol, 36: 1165–1170.
10. Kloppel G., Solcia E., Longnecker D.S. et al. (1996) Histological Typing of Tumours of the Exocrine Pancrease. World Health Organization International Histological Classification of Tumors, 2-nd Ed. — Berlin .
11. Koss L.G., Melamed M.R. (2006) Koss’ Diagnostic Cytology and Its Histopathologic Bases, 5th Ed: 1443.
12. Layfield L.J., Bentz J. (2008) Giant-cell containing neoplasms of the pancreas: an aspiration cytology study. Diagnostic Cytopathology, 36 (4): 238–244.
13. Mullick S.S., Mody D.R. (1996) “Osteoclastic” Giant Cell Carcinoma of the Pancreas. Acta Cytologica.; 40 (5): 975–979.
14. Rosai J. (1968) Carcinoma of pancreas simulating giant cell tumor of bone. Electron-microscopic evidence of its acinar cell origin. Cancer, 22: 333–344.
15. Sakai Y., Kupelioglu A.A., Yanagisawa A. et al. (2000) Origin of giant cell in osteoclast-like giant cell tumors of the pancreas. Hum Pathol, 31: 1223–1229.
16. Schramm Henning M. (2011) Extraterritorial osteoclast traits of primary cancer cells. Journal of Solid Tumors, 1 (2): 65–79.
17. Sommers S.C., Meissner W.A. (1954) Unusual carcinoma of the pancreas. Arch Patol, 58: 101–111.
18. Trepeta R.W., Mathur B., Lagin S. et al. (1981) Giant cell tumor (“osteoclastoma”) of the pancreas: a tumor of epithelial origin. Cancer, 48: 2022–2028.
19. Zou X.P., Yu Z.L., Li Z.S. et al. (2004) Clinicopathological features of giant cell carcinoma of the pancreas. Hepatobiliary Pancreat Dis Int, 3: 300–302.
Л.С. Болгова, О.М. Грабовий, А.В. Лукашенко, Т.М. Ярощук, Є.О. Логінова,Т.А. Магась, М.О. Волк
Національний інститут раку, Київ
Резюме. Подано спостереження із практики стосовно морфологічної діагностики гігантоклітинної пухлини підшлункової залози, що рідко зустрічається, в якому відзначено можливий різний її гістогенез — епітеліальний чи мезенхімальний. Гігантоклітинна пухлина підшлункової залози виявлена при КТ-дослідженні у хворої К., 51 рік, діагностована клінічним цитологом за матеріалом пункції пухлини, підтверджена гістологічним і імуногістохімічним методами дослідження операційного матеріалу. Позитивна реакція на віментин і СД68 дозволяє підтвердити її мезенхімальний генез.
Ключові слова: гігантоклітинна пухлина підшлункової залози, цитологічна, гістологічна, імуногістохімічна діагностика, мезенхімальний генез.
L.S. Bolgova, A.N. Grabovyi, A.V. Lukashenko, T.M. Yaroschuk, Ye.A. Loginova, T.A. Magas, M.A. Volk
National Cancer Institute, Kyiv
Summary. Рractice observation on the morphological diagnostics of a rare giant cell tumor of the pancreas is provided; possibility of different histogenesis — epithelial or mesenchymal — is noted in it. Giant cell tumor of the pancreas was revealed in patient K., 51 years old, during CT investigation; puncture of the tumor material was diagnosed by clinical cytologist, was confirmed histological and immunohistochemical methods of analysis of surgical specimens. Positive reaction to vimentin and CD68 can confirm its mesenchymal genesis.
Key words: giant cell tumor of the pancreas, cytological, histological, immunohistochemical diagnostics, mesenchymal genesis.
Источник



