Интраэпителиальная неоплазия поджелудочной железы
Протоковая аденокарцинома — опухоль эпителиального происхождения, развивающаяся из клеток, выстилающих протоки поджелудочной железы. Процесс может затрагивать любую часть железы, но наиболее частой локализацией служит ее головка. Это одно из наиболее распространенных онкологических заболеваний поджелудочной железы. Опухоль чрезвычайно злокачественна и в большинстве случаев приводит к летальному исходу. Ежегодно в США заболевает 44 000 человек, 38 000 погибает. Тенденция такова, что протоковая аденокарцинома в своей летальности вскоре может опередить смертность от рака груди и толстой кишки.
Чаще всего данное заболевание встречается в промежутке между 55 и 84 годами. Особую роль играет наследственная предрасположенность: риск заболеть возрастает на 40% у людей, имеющих трех и более родственников первой линии, двух — на 10% и на 6% при наличии одного такого родственника. Табакокурение, частое употребление алкоголя, хронический панкреатит, ожирение так же предрасполагают к этому заболеванию. Имеются данные о связи с сахарным диабетом II типа и инфицированием Helicobacter pylori.
Считается, что аденокарцинома в своем развитии имеет некоторую стадийность. Всё начинается с преинвазивной стадии — панкреатической интраэпителиальной неоплазии. Это поражение эпителия стимулируется накоплением генетических мутаций. Наиболее распространенной является мутация в онкогене K-ras (встречается в 90% случаев). Другими часто встречающимися нарушениями служат мутация в Her-2 и потеря антионкогенных свойств p16, p53 и SMAD4.
Макроскопически опухоль выглядит как неоднородная, склерозированная, грубая бело-желтая масса. Границы карциномы нечеткие, опухоль инфильтрирует окружающие ткани. Микроскопически практически во всех случаях определяется периневральная инвазия. Присутствуют сосудистые и лимфатические микрометастазы; часто обнаруживается некроз опухоли. Даже в тех случаях, когда аденокарцинома локализована, она имеет низкую степень дифференцировки, и ее очень сложно обнаружить на ранних, курабельных стадиях.
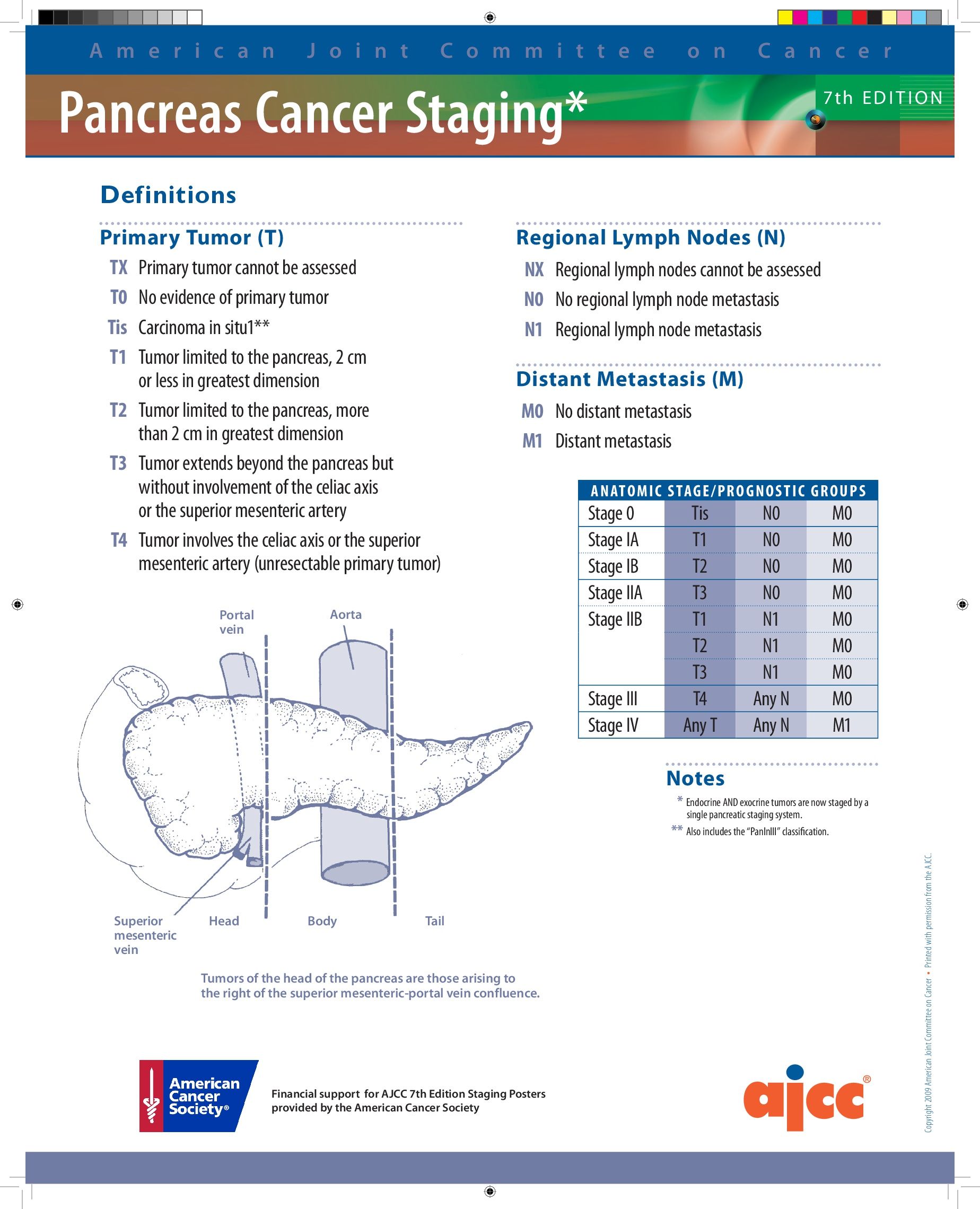
Рисунок 1 | Классификация рака поджелудочной железы по TNM.
TX: Невозможно оценить состояние первичной опухоли
T0: Отсутствуют признаки рака в поджелудочной железе
Tis: Самые начальные проявления рака без распространения опухоли — карцинома in situ
T1: Диаметр опухоли 2 см и менее, находится в пределах поджелудочной железы
T2: Диаметр опухоли более 2 см, находится в пределах поджелудочной железы
T3: Опухоль выходит за пределы поджелудочной железы, но в крупные артерии или вены рядом с органом не проникает
T4: Опухоль выходит за пределы поджелудочной железы и проникает в крупные артерии или вены рядом с органом. Опухоль категории T4 неоперабельна.
NX: Невозможно оценить cостояние регионарных лимфатических узлов.
N0: Отсутствуют признаки рака в регионарных лимфатических узлах.
N1: Опухоль распространяется на регионарные лимфатические узлы.
MX: Невозможно обнаружить отдаленные метастазы.
M0: Опухоль не метастазирует.
M1: В отдаленных органах выявляются метастазы. Рак поджелудочной железы метастазирует преимущественно в печень, легкие и на брюшину.
Стромальный компонент — опухолевое микроокружение — занимает около 70% всей массы опухоли. Строма слабо васкуляризована и обладает высоким интерстициальным давлением. Тем самым данные условия ведут к доминированию наиболее устойчивых, наиболее агрессивных субклонов. Эти субклоны резистентны к химиотерапии и хорошо адаптированы к экстремальным условиям. Таким образом, строма создает мощный барьер для эффективной лекарственной доставки и обеспечивает опухолевым клеткам стимулирующую среду.
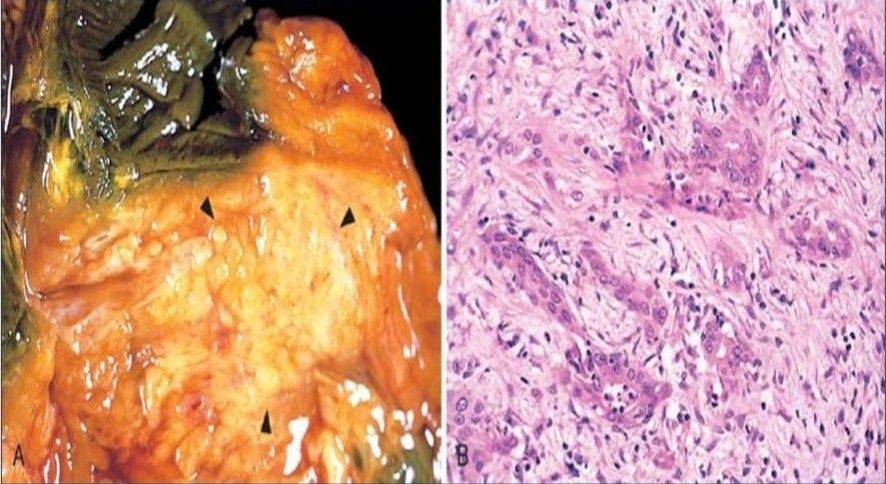
Манифестация клинических симптомов происходит на более поздних стадиях, когда вероятность эффективного хирургического лечения составляет лишь 20%. Характер проявлений зависит от локализации патологического процесса. Как говорилось выше, наиболее часто поражается головка поджелудочной железы — в 60-70% случаев. Этой локализации присущи симптомы обтурации общего желчного протока: механическая желтуха, сопровождающаяся кожным зудом; ахоличный кал, темная моча. Присутствует и болевой синдром. В остальных случаях, при поражении тела и хвоста патогномоничным симптомом является наличие болей и потеря веса. Иногда аденокарцинома дебютирует как острый панкреатит. Среди общих симптомов также встречаются астения, анорексия, тошнота, рвота, диарея.
При подозрении на аденокарциному поджелудочной железы всем пациентам назначают исследование печеночного профиля. Маркером аденокарциномы служит CA 19-9, который повышается в 75-85% случаев, однако он недостаточно специфичен и не дает основания для постановки точного диагноза. Тем не менее, повышение данного маркера свидетельствует о рецидиве заболевания после оперативного лечения.
Золотым стандартом среди инструментальных методов исследования является компьютерная томография. Помимо этого диагностической ценностью обладают магнитно-резонансная холангиопанкреатография, эндоскопическая ретроградная холангиопанкреатография, абдоминальное УЗИ, чрескожная чреспечёночная холангиография, эзофагогастродуоденоскопия. Целью исследований является выяснение степени распространения опухоли, инвазии в окружающие ткани, наличия метастазов. По поводу биопсии ведутся споры: считается, что вмешиваться нужно, если возникла обтурационная желтуха, либо в том случае, когда опухоль достигла существенных размеров или дала распространенные метастазы. В таком случае биопсия нужна для определения тактики химиотерапии.
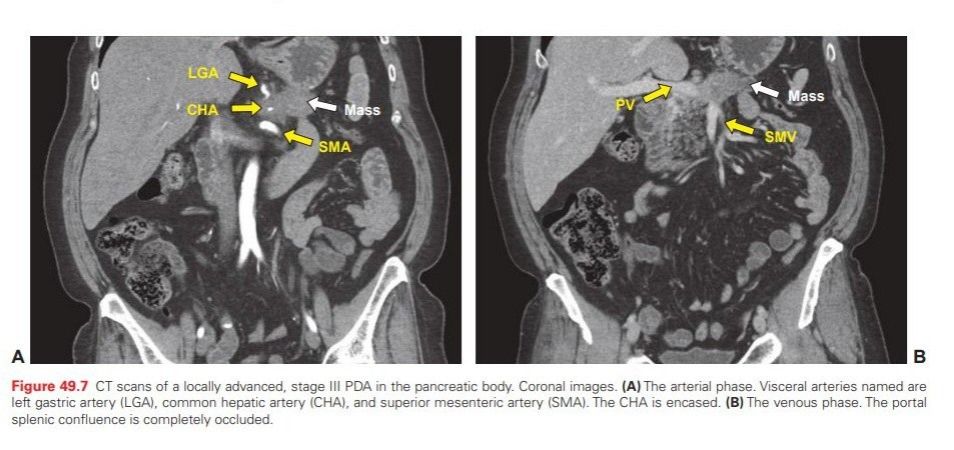
Терапия аденокарциномы поджелудочной железы проводится комплексно. Наиболее обнадеживающим является хирургическое лечение. К сожалению, на момент выявления опухоль чаще всего достигает значительных размеров, прорастая в рядом расположенные сосуды, и радикальная операция становится невозможна. Исходя из этого, предлагают следующие критерии, наличие которых допускает возможность резектабельности: отсутствие метастазов; отсутствие или небольшое вовлечение в опухолевый процесс крупных сосудов; при вовлечении вен должна иметься возможность их реконструкции; пациент должен быть в состоянии перенести оперативное вмешательство. При поражении головки поджелудочной железы производят процедуру Whipple — панкреатодуоденэктомию. В случае поражения тела и хвоста проводят дистальную панкреатэктомию.
Химиотерапия проводится в двух вариантах: адъювантном и неоадъювантном. Неоадъювантная терапия позволяет уменьшить размеры опухоли, более четко разграничить здоровые и пораженные ткани, для того чтобы хирургическая операция имела больше шансов на успех. Адъювантная химиотерапия, согласно рекомендациям Национальной всеобщей онкологической сети, рекомендована пациентам, хорошо перенесшим резекцию. При нерезектабельной опухоли и отдаленных метастазах проводят паллиативную химиотерапию. Лучевая терапия — довольно неоднозначный метод лечения. Существуют различные данные об ее эффективности. В некоторых случаях вред, причиняемый здоровым тканям поджелудочной железы и окружающим органам превышает и без того незначительную эффективность. Однако иногда неоадъювантная лучевая терапия достаточно успешно уменьшает размеры опухоли, обеспечивая ее резектабельность.
Возлагаются большие надежды на таргетную и иммунную терапию. Активно изучаются методы воздействия на онкоген K-ras. Таргетное уменьшение размеров стромы снизит злокачественность и позволит с большей эффективностью проводить лечение аденокарциномы поджелудочной железы.
Разрабатываются вакцины, эффективность которых уже начали испытывать. Прогноз при протоковой аденокарциноме поджелудочной железы неблагоприятный. Пятилетняя выживаемость достигает 7,2%. У прооперированных пациентов она может возрастать до 22%.
Источники
Devita Jr V. T., Lawrence T., Rosenberg S. A. Cancer: Principles & Practice of Oncology: Annual Advances in Oncology. – Lippincott Williams & Wilkins, 2012.
Pancreatic Ductal Adenocarcinoma [Электронный ресурс]. – Режим доступа: https://www.pancreapedia.org/reviews/pancreatic-ductal-adenocarcinoma, свободный. – Загл. с экрана.
Pancreatic Cancer Treatment (PDQ®)–Patient Version [Электронный ресурс]. – Режим доступа: https://www.cancer.gov/types/pancreatic/patient/pancreatic-treatment-pdq#section/_162, свободный. – Загл. с экрана.
Stark A. P. et al. Long-term survival in patients with pancreatic ductal adenocarcinoma //Surgery. – 2016. – Т. 159. – №. 6. – С. 1520-1527.
Источник
Впервые опухоль описана в 1982 г. как новообразование с гиперпродукцией муцина, располагающееся внутри протоков ПЖ с экзофитным ростом в виде сосочков (триада К. Охеши). В течение последующего десятилетия появлялись единичные сообщения о выявлении муцинозных злокачественных опухолей ПЖ, однако отсутствие единого определения не позволяло классифицировать эти находки. Только в 1994 г. для таких опухолей было предложено вышеуказанное название, которое вошло в общепринятую терминологию и сохранилось и по сей день. С тех пор число публикаций, посвященных этой проблеме, резко увеличилось.
Эпидемиология
Внутрипротоковые папиллярные муцинозные опухоли относительно редки, их доля составляет до 3% от всех экзокринных опухолей ПЖ и 18% среди кистозных опухолей ПЖ. Несколько чаще болеют мужчины; возрастной диапазон при первичной диагностике составляет 37—80 лет (чаще 60—70 лет), средний возраст — 64 года. Вероятно, истинная частота внутрипротоковых папиллярных муцинозных опухолей значительно выше, поскольку многим больным выставляют диагноз острого или хронического панкреатита, что обусловлено рядом причин.
Во-первых, средний возраст клинической манифестации этой опухоли составляет 60-70 лет, когда подавляющее большинство больных имеет тяжелые сопутствующие заболевания, каждое из которых может привести к смерти. Во-вторых, аутопсию проводят не у всех больных, а если и выполняют, то при очевидной причине смерти (например, при остром инфаркте миокарда), поэтому ПЖ не уделяют должного внимания. По нашему опыту работы с различными отечественными патоморфологами при отсутствии макроскопически или пальпаторно определяемой опухоли, вскрытие ПЖ по её протоку практически не проводят.
Поскольку опухоль папиллярная, пропальпировать её невозможно, в ряде случаев невозможно даже увидеть её при осмотре макропрепарата (на поперечном срезе протока). Только лишь в том случае, если больной скончался от диагностированного обструктивного панкреатита, причина которого не ясна, есть хороший шанс диагностировать эту опухоль на аутопсии. В-третьих, внутрипротоковая папиллярная опухоль склонна к медленному прогрессированию. Аналогично (с длительно сохраняющимися симптомами) протекает и ХП.
При адекватной лекарственной терапии и отсутствии серьёзного мониторинга (с использованием всех доступных методик визуализации) как исходно, так и в динамике, течение заболевания может продолжаться несколько лет, пока не произойдёт озлокачеетвление со всеми вытекающими последствиями. В-четвёртых, как ни печально это признавать, значительный вктад в гиподиагностику внутрипротоковых папиллярных муцинозных опухолей вносит низкая осведомлённость как практических врачей, так и некоторых морфологов о существовании этой опухоли.
Патоморфология
Опухоль характеризуется внутрипротоковой пролиферацией муцинпродуцирующих клеток, располагающихся в виде сосочков. Гиперсекреция муцина и затруднение оттока секрета при большом количестве сосочков в пределах одного протока может приводить к его кистозному расширению. Если очагов опухолевого роста несколько (фокальный или диффузный тип опухоли), расширение протоков ПЖ выше места сужения может носить ограниченный характер.
Клеточная атипия варьирует от минимальной до тяжёлой, что предполагает подразделение этих опухолей на аденомы, пограничные опухоли и интрацуктальные карциномы (т.е. на доброкачественные, пограничные и злокачественные опухоли). Кроме того, кпеточная дифференцировка может быть различной — интестинальной, панкреатобилиарной и онкокистозной. В основном внутрипротоковые папиллярные муцинозные опухоли растут медленно, однако в 30% случаев они прорастают окружающие ткани и метастазируют. Наиболее частое расположение опухоли — проток ПЖ в проекции её головки. Предполагают, что опухоли, возникшие из второстепенных протоков, имеют лучший прогноз, нежели те, что происходят из основного протока ПЖ.
До сих пор отсутствуют иммуногистохимические и молекулярные маркёры опухоли, не совсем изучены механизмы изменчивости папиллярного компонента, степени секреции муцина, причин вариабельного распространения опухоли и т.п. В ряде случаев эту опухоль крайне трудно отличить от других новообразований, в частности от панкреатической интраэпителиальной неоплазии (PanlNs), поэтому в последние годы в действующую классификацию внесены поправки, благодаря которым можно разграничить эти опухоли.
Этиопатогенез
Этиопагогенез внутрипротоковых папиллярных муцинозных опухолей в настоящее время остаётся загадкой. Интересен следующий факт — такая опухоль, ассоциированная с цистадеиокарциномой, гистологически характеризуется наличием инвазивного компонента с трубчатой или муцинозной структурой. Тубулярная инвазия имеет сходство с протоковой цистадеиокарциномой, в то время как муцинозная часть опухоли представлена коллоидом (муцинозная некистозная карцинома). Кроме того, внутрипротоковые папиллярные опухоли с тубулярной, подобной протоковой иистаденокарциноме, инвазией, характеризуются панкреатобилиарным типом дифференцировки клеток, в то время как опухоль с муцинозноподобной инвазией характеризуется гастроинтестинальным фенотипом.
Исследования последних лет, в некоторой степени приоткрывающие завесу таинственности над патогенезом этой опухоли, посвящены изучению продукции муцина опухолевыми клетками. Было обнаружено, что опухоли с различной дифференцировкой клеток (разным фенотипом) продуцируют разные муцины. Так, опухоли с гастроинтестинальным фенотипом, продуцируют MUC-2, а опухоли с панкреатобилиарным фенотипом — только MUC-1. Кроме того, был обнаружен третий тип опухоли, способный к одновременной продукции муцинов обоих типов — MUC-1 и MUC-2.
Эта разновидность в последствии была названа онкокистозным подтипом внутрипротоковой папиллярной муцинозной опухоли. Результаты этих исследований наводят на мысль, что термин внутрипротоковая папиллярная муцинозная опухоль — собирательное понятие, объединяющее, по крайней мере, три разновидности опухолей, достаточно близких по строению, но различных по иммунофенотипу секретируемого ими муцина. Наиболее часто выявляют гастроинтестинальный MUC-2- фенотип.
Гастроинтестинальный MUC-2+ фенотип составляет одну иммунофенотипическую группу с MUC-2+ коллоидной (муцинозной некистозной) карциномой, что предполагает возможность превращения внутрипротоковой папиллярной муцинозной опухоли в эту разновидность злокачественного новообразования. MUC-l+ панкреатобилиарный тип связан, возможно, с протоковой цистадеиокарциномой. Третий тип протоковой папиллярной опухоли — онкокистозный, возможно, может озлокачествляться, трансформируясь в карциному, однако гистологические и биологические особенности последней остаются неизученными.
Молекулярные механизмы, вктючающиеся при нарушении регуляции гена MUC при внутрипротоковой папиллярной опухоли, остаются пока неизвестными. Возможно, они определяются другими клетками, что косвенно подтверждается различным прогнозом при разных типах папиллярной опухоли — как мы отмечали выше, MUC-2+ тип отличается более благоприятным течением. Существует предположение о существовании неидентифицированной в настоящее время мутации, определяющей развитие интрадуктальной папиллярной муцинозной опухоли. Предположение это основано на факте частой ассоциации этих опухолей с другими внепанкреатическими злокачественными новообразованиями, а также с синдромом Пейтца—Егерса. Диагностика
Клиническая картина
Характерны симптомы острого или хронического панкреатита, реже опухоль выявляют случайно. Частота тяжёлых деструктивных панкреатитов при внутрипротоковой папиллярной опухоли не превышает 2%.
Большинство симптомов аналогичны таковым при ХП — боли в эпигастрии с усилением после приёма пищи, диспептические расстройства, астенические симптомы, признаки эндо- и экзокринной недостаточности, похудание.
Механическая желтуха возникает в 20% случаев, сс появление косвенно свидетельствует о злокачественном варианте опухоли. Крайне редко обнаруживают асцит.
Частота встречаемости сахарного диабета при внутрипротоковых папиллярных муцинозных опухолях достигает 11%, однако истинная причина эндокринной недостаточности до сих пор не установлена. Если речь идёт о протоковой аденокарциноме, быстро распространяющейся по паренхиме ПЖ с замещением опухолевой тканью островков Лангерганса, то, как правило, говорят о панкреатогенном сахарном диабете, вторичном по отношению к раку ПЖ. При внутрипротоковых папиллярных опухолях инвазия в паренхиму ПЖ происходит не так часто, и менее выражена, чем при раке, поэтому механизм диабета при этих новообразованиях не совсем понятен. Возможно, сахарный диабет развивается на фоне рецидивирующего обструктивного панкреатита, приводящего к воспалительным, деструктивным, кистозным, фиброзным и атрофическим изменениям как экзо-, так и эндокринной части ПЖ.
Дефицит массы тела обнаруживают у 42% больных. Как и при панкреатите, он обусловлен рядом причин. Во-первых, гиперпродукция муцина на ранних этапах развития опухоли может приводить с временной обструкции выводных протоков ПЖ, что обусловливает болевой абдоминальный синдром после приёма пищи. Дальнейший рост опухоли приводит к уменьшению просвета поражённого протока (или протоков) с нарастанием клинических проявлений. Боль вынуждает больных отказываться от приёма пищи, чтобы предотвратить, таким образом, её повторное возникновение (ситофобия). Во-вторых, растущая, метаболически активная опухоль потребляет для собственных нужд всё необходимое. Нарушение обмена веществ обусловлено и сахарным диабетом, осложняющим течение опухоли.
В-третьих, нарушенный отток панкреатического сока в просвет ДПК приводит к развитию экзокринной недостаточности ПЖ, способствуя нарушению пищеварения и всасывания питательных веществ.
Методы визуализации. Для скрининга, как и при других опухолях ПЖ, используют УЗИ и КТ. Эффективность диагностики существенно повышается при информированности врачей о существовании этой необычной опухоли. На эффективность диагностики влияет также расположение опухоли (в основном протоке ПЖ или в более мелких протоках).
Во всех случаях, когда при скрининговом УЗИ выявляют дилатацию протока ПЖ при отсутствии объективной причины блока (опухоли головки ПЖ больших размеров, камней в общем жёлчном протоке, опухоли БДС и т.п.) и анамнестических данных заранее имевшую место патологию, способствующую развитию Рубцовых изменений БДС и терминального отдела протока ПЖ, в первую очередь надо думать о наличии у больного внутрипротоковой папиллярной опухоли. При диффузной форме опухоли может быть расширено несколько протоков, при сегментарной — как правило, один.
Другой важнейший признак внутрипротоковых папиллярных опухолей — распространённая атрофия паренхимы ПЖ, обычно пропорциональная степени протоковой дилатации. Далеко не всегда при УЗИ можно выявить чёткие зоны внутрипротоковых блоков, а уж тем более определить, чем они вызваны — муциновыми «пробками» или папиллярными разрастаниями. Третий признак опухоли патогномоничен — наличие гипоэхогенных микро- или макрокистозных изменений паренхимы ПЖ по типу «пчелиных сот»; связь этих кист с дилатированными протоками при УЗИ выявляют не всегда.
В ряде случаев у больных обнаруживают кальцификацию и панкреатолитиаз, обусловленные как рецидивирующим панкреатитом, так и отложением солей кальция в муциновых «пробках».
При КТ с контрастированием зона опухоли значительно лучше накапливает контрастное вещество, чем окружающая паренхима. В просвете расширенного протока ПЖ можно выявить гиперэхогенные включения, соответствующие муциновым «пробкам» или папиллярным разрастаниям.
При длительном течении новообразования, расположенного в головке ПЖ, опухолевая инфильтрация вместе с кистозными изменениями протоков может достигать больших размеров, занимая всю головку железы. В результате сдавливается интрапанкреатический отдел общего жёлчного протока с развитием билиарной гипертензии. В ряде случаев у больных возникает асцит, обусловленный пропотеванием жидкостного компонента кист, поскольку стенка кист может быть достаточно тонкой, а давление внутри кист значительно большим, чем в полости брюшины.
Выраженная протоковая дилатация при отсутствии атрофических изменений паренхимы, особенно при наличии чётко определяемых внутрилротоковых папиллярных разрастаний, — признак озлокачествления опухоли. Даже при начальных этапах озлокачесгвления всегда присутствует кистозный компонент, что важно учитывать при дифференциальной диагностике с протоковой аденокарциномой. Наличие кистозного расширения коллатеральных протоков в сочетании с внутрипротоковыми разрастаниями существенно упрощает диагностику диффузных форм. При сегментных формах результаты КТ не столь специфичны.
Несмотря на ряд условно специфичных признаков при УЗИ, КТ и МРТ, необходимо выявить сами внутрипротоковые папиллярные разрастания. Ранее с этой целью применяли только ЭРХПГ, однако совершенствование программ КТ и МРТ, появление ЭУС и МРХПГ позволяет в настоящее время с достаточной точностью выявлять внутрипротоковые разрастания. Достаточно чувствительный метод диагностики внутрипротоковых папиллярных опухолей — проведение МРХПГ с внутривенным ведением карбахола (секретина). Самый современный метод диагностики, позволяющий осуществить визуальный осмотр протока ПЖ и произвести биопсию опухоли. — вирсунгоскопия, дополняющая ЭУС.
Дифференциальная диагностика с первичными панкреатитами основана на возрастном критерии (в среднем 42 года при рецидивируюшем хроническом панкреатите), половом критерии (хроническим панкреатитом, не связанным с очевидной патологией билиарного тракта, страдают преимущественно мужчины), а также на факте отсутствия у многих больных внутрипротоковой папиллярной опухолью отягощенного анамнеза по злоупотреблению алкоголем и табакокурению.
Дифференциальная диагностика с серозной цистаденомой достаточно трудна и основана на возрастных (при пистаденомах средний возраст больных на Шлет меньше), половых (цистаденома встречается у женщин в 7 раз чаще) отличиях и более благоприятном течении (чаше скрытом) цистаденомы. Расположение опухоли, демографические признаки, образ жизни не позволяют разграничить эти кистомы. Внутрипротоковая папиллярная опухоль чаще протекает с клиническими проявлениями и с развитием осложнений, чем при цистаденомах.
Дифференциальная диагностика с муцинозной цистаденомой также трудна, однако она имеет меньшее значение, поскольку в обоих случаях показано радикальное хирургическое лечение. Отмечают некоторые возрастно-половые, клинические и топографические отличия, поскольку мупинозная цистаденома встречается, в подавляющем большинстве случаев, у женщин среднего возраста, в 93% случаев она располагается в теле и хвосте ПЖ, практически всегда протекает бессимптомно.
Лечение
Всем больным внутрипротоковой папиллярной муцинозной опухолью показано хирургическое лечение в виде панкреатодуоденальной резекции либо панкреатэктомии, несмотря на высокий средний возраст больных (65—70 лет), имеющих много сопутствующих заболеваний. До операции должен быть установлен морфологический диагноз.
Ориентация на хирургическое лечение у всех больных в обязательном порядке вполне оправдана, поскольку даже при доброкачественной папиллярной опухоли на момент первичного установления диагноза риск озлокачествления высок; значительна вероятность развития рецидивирующего обструктивного панкреатита, грозного своими осложнениями. В специализированных центрах, занимающихся хирургией ПЖ, летальность после панкреатодуоденальной резекции при внутрипротоковых папиллярных муцинозных опухолях не превышает 5%, при дистальной резекции смертельных случаев, как правило, и вовсе нет.
Маев И.В., Кучерявый Ю.А.
Опубликовал Константин Моканов
Источник


