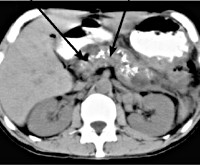
Эндокринная функция поджелудочной железы животных
Поджелудочная железа (Pancreas) — железа двойной функции: внешнесекреторной и внутрисекреторной. Внешнесекреторная функция заключается в синтезе и выделении в двенадцатиперстную кишку сока, содержащего пищеварительные ферменты и электролиты, внутрисекреторная — в синтезе и выделении в кровь гормонов.
Внешнесекреторная часть железы сильно развита и составляет более 95 % ее массы. Она имеет дольчатое строение и состоит из альвеол (ацинусов) и выводных протоков. Основная масса ацинусов (железисто-пузырьковидные концевые отделы) представлена панкреатическими клетками — панкреацитами — секретируемыми клетками.
Внутрисекреторная часть железы представлена островками Лангерганса, которые составляют около 30 % массы железы. Различают несколько видов островков Лангерганса по способности секретировать полипептидные гормоны: А-клетки продуцируют глюкогон, В-клетки — инсулин, D-клетки — самостатин. Основную массу островков Лангерганса (около 60 %) составляют В-клетки.
Поджелудочная железа лежит в брыжейке двенадцатиперстной кишки, на печени, разделяясь на правую, левую и среднюю доли. Проток поджелудочной железы открывается в двенадцатиперстную кишку самостоятельно или вместе с желчным протоком. Иногда встречается добавочный проток, который впадает в двенадцатиперстную кишку самостоятельно. Иннервируется поджелудочная железа симпатическими и парасимпатическими нервами (n. vagus).
У собак железа длинная, узкая, красноватого цвета, образует более объемистую левую ветвь и более длинную правую ветвь, достигающую почек. Поджелудочный проток открывается в двенадцатиперстную кишку вместе с желчным протоком. Иногда встречается добавочный проток. Абсолютная масса железы 13-18 г.
У крупного рогатого скота поджелудочная железа располагается вдоль двенадцатиперстной кишки от 12-го грудного до 2-4-го поясничного позвонка, под правой ножкой диафрагмы, частично на лабиринте ободочной кишки. Состоит из поперечной и правой продольной ветвей, соединяющихся под углом в правой стороне. Выводной проток открывается обособленно от желчного протока на расстоянии 30-40 см от него (у овец вместе с желчным протоком). Абсолютная масса железы у крупного рогатого скота 350-500 г, у овец 50-70 г.
У лошадей на поджелудочной железе различают среднюю часть — тело, прилежащее к воротному изгибу двенадцатиперстной кишки. Левый конец железы, или хвост, длинный и узкий, достигает слева слепого мешка желудка, соединяясь с ним, селезенкой и левой почкой. Правый конец железы, или головка, доходит до правой почки, слепой и ободочной кишки. Поджелудочный проток открывается вместе с печеночным. Иногда встречается дополнительный проток. Цвет железы желтоватый, абсолютная масса до 250-350 г.
У свиней на железе различают среднюю, правую и левую доли. Через среднюю долю проходит воротная вена печени. Железа лежит под двумя последними грудными и двумя первыми поясничными позвонками. Проток один, открывается на 13-20 см дистальнее устья желчного протока. Абсолютная масса железы 150 г.
Внешнесекреторная (экзогенная) функция поджелудочной железы. Основной продукт внешнесекреторной функции поджелудочной железы — пищеварительный сок, который содержит 90 % воды и 10% плотного осадка. Плотность сока 1,008-1,010; рН 7,2-8,0 (у лошадей 7,30-7,58; у крупного рогатого скота 8). В состав плотного осадка входят белковые вещества и минеральные соединения: бикарбонат натрия, хлорид натрия, хлорид кальция, фосфорнокислый натрий и др.
Сок поджелудочной железы содержит протеолитические и нуклеолитические ферменты (трипсин, хемотрипсин, карбоксипептидазы, эластазу, нуклеазы, аминопептидазу, коллагеназу, дипептидазу), амилолитические ферменты (а-амилазу, мальтазу, лактазу, инвертазу) и липолитические ферменты (липазу, фосфолипазу, холинэстеразу, карбоксиэстеразу, моноглицеридлипазу, щелочную фосфатазу). Трипсин расщепляет белки до аминокислот и выделяется в виде неактивного трипсиногена, который активируется ферментом кишечного сока энтерокиназой. Химотрипсин расщепляет белки и полипептиды до аминокислот и выделяется в форме неактивного химотрипсиногена; активируется трипсином. Карбоксиполипептидазы действуют на полипептиды, отщепляя от них аминокислоты. Дипептидазы расщепляют дипептиды на свободные аминокислоты. Эластаза действует на белки соединительной ткани — эластин, коллаген. Протаминаза расщепляет протамины, нуклеазы — нуклеиновые кислоты на мононуклеотиды и фосфорную кислоту.
При воспалении поджелудочной железы, аутоиммунных процессах протеолитические ферменты становятся активными уже в самой железе, вызывая ее разрушение. а-Амилаза расщепляет крахмал и гликоген до мальтозы; мальтаза — мальтозу до глюкозы; лактаза расщепляет молочный сахар на глюкозу и галактозу (она имеет существенное значение в пищеварении молодняка), инвертаза — сахарозу на глюкозу и фруктозу; липаза и другие липолитические ферменты расщепляют жиры на глицерин и жирные кислоты. Липолитические ферменты, в частности липаза, секретируются в активном состоянии, но расщепляют только жир, эмульгированный желчными кислотами. Амилазы, также как и липазы, в соке поджелудочной железы находятся в активном состоянии.
Из электролитов в соке поджелудочной железы содержатся натрий, калий, хлор, кальций, магний, цинк, медь и значительное количество бикарбонатов, обеспечивающих нейтрализацию кислого содержимого двенадцатиперстной кишки. Тем самым создается оптимальная среда для активных ферментов.
Доказано, что помимо перечисленного выше действия сок поджелудочной железы обладает свойством регуляции микробной ассоциации в двенадцатиперстной кишке, оказывая определенное бактерицидное действие. Прекращение поступления в кишечник панкреатического сока ведет к усиленному бактериальному росту в проксимальном отделе тонкого кишечника у собак.
Эндокринная (гормональная) функция поджелудочной железы. Важнейшими гормонами поджелудочной железы являются инсулин, глюкогон и соматостатин.
Инсулин образуется в В-клетках из предшественника — проинсулина. Синтезируемый проинсулин поступает в аппарат Гольджи, где расщепляется на молекулу С-пептида и молекулу инсулина. Из аппарата Гольджи (пластинчатый комплекс) инсулин, С-пептид и частично проинсулин поступают в везикулы, где инсулин связывается с цинком и депонируется в таком состоянии. Под влиянием различных стимулов инсулин освобождается от цинка и поступает в прекапиллярное пространство. Основным стимулятором секреции инсулина служит глюкоза: при ее повышении в крови усиливается синтез инсулина. В определенной степени этим свойством обладают аминокислоты аргинин и лейцин, а также глюкогон, глетрин, секретин, глюкокортикоиды, соматостатин, никотиновая кислота. Инсулин в крови находится в свободном и связанном с белками плазмы состоянии. Распад инсулина происходит в печени под влиянием глютатионтрансферазы и глютатионредуктазы, в почках под влиянием инсулиназы, в жировой ткани под влиянием протеолитических ферментов. Проинсулин и С-пептид тоже подвергаются дегидратации в печени. Его биологическое действие обусловлено способностью связываться со специфическими рецепторами клеточной цитоплазматической мембраны.
Инсулин усиливает синтез углеводов, белков, нуклеиновых кислот и жира. Он ускоряет транспорт глюкозы в клетки инсулинозависимых тканей (печень, мышцы, жировая ткань), стимулирует синтез гликогена в печени и подавляет глюконеогенез (образование глюкозы из неуглеводных компонентов), гликогенолиз (распад гликогена), что в конечном итоге ведет к снижению уровня сахара в крови. Этот гормон ускоряет транспорт аминокислот через цитоплазматическую мембрану клеток, стимулирует синтез белка. Инсулин участвует в процессе включения жирных кислот в триглицериды жировой ткани, стимулирует синтез липидов и подавляет липолиз (распад жира).
В регуляции синтеза белка и утилизации углеводов вместе с инсулином участвуют кальций и магний. Концентрация инсулина в крови человека 15-20 мкЕД/мл.
Глюкогон — полипептид, секреция которого регулируется глюкозой, аминокислотами, гастроинтестинальными гормонами (панклеозимин) и симпатической нервной системой. Секреция глюкогона усиливается при снижении в крови сахара, СЖК, раздражении симпатической нервной системы, а угнетается при гипергликемии, повышении уровня СЖК, соматостатина. Под влиянием глюкогона стимулируется глюконеогенез, ускоряется распад гликогена, т. е. увеличивается продукция глюкозы. Под действием глюкогона ускоряется синтез активной формы фосфорилазы, участвующей в образовании глюкозы из неуглеводных компонентов (глюконеогенез). Глюкогон способен связываться с рецепторами адипацитов (клеток жировой ткани), способствуя распаду триглицеридов с образованием глицерина и СЖК. Глюконеогенез сопровождается не только образованием глюкозы, но и промежуточных продуктов обмена веществ — кетоновых тел, развитием кетоацидоза. Содержание в плазме крови глюкогона у человека составляет 50-70пг/мл. Концентрация этого гормона в крови увеличивается при голодании (голодный кетоз у овец), хронических заболеваниях печени.
Соматостатин — гормон, основной синтез которого осуществляется в гипоталамусе, а также в D-клетках поджелудочной железы. Соматостатин подавляет секрецию СТГ, АКТГ, ТТГ, гастрина, глюкогона, инсулина, ренина, секретина, вазоактивного желудочного пептида, желудочного сока, панкреатических ферментов и электролитов. Содержание соматостатина в крови повышается при сахарном диабете I типа, D-клеточной опухоли поджелудочной железы (соматостатиноме). Говоря о гормонах поджелудочной железы, следует отметить, что энергетический баланс в организме поддерживается сплошными биохимическими процессами, в которых непосредственное участие принимают инсулин, глюкогон и частично соматостатин. Так, во время голодания уровень в крови инсулина снижается, а глюкогона повышается, усиливается глюконеогенез. Благодаря этому поддерживается минимальный уровень глюкозы в крови. Усиление липолиза сопровождается повышением в крови СЖК, которые используются сердечной и другими мышцами, печенью, почками в качестве энергетического материала. В условиях гипогликемии источником энергии становятся и кетокислоты.
Нейроэндокринная регуляция функции поджелудочной железы. Деятельность поджелудочной железы находится под влиянием парасимпатической (n. vagus) и симпатической (чревные нервы) нервной системы, гипоталамогипофизарной системы и других желез внутренней секреции. В частности, блуждающий нерв играет определенную роль в регуляции ферментообразования. Секреторные волокна входят также в состав симпатических нервов, иннервирующих поджелудочную железу. При стимуляции отдельных волокон блуждающего нерва с усилением сокоотделения происходит и его торможение. Основоположником отечественной физиологии И. П. Павловым доказано, что отделение поджелудочного сока начинается при виде корма или раздражении рецепторов полости рта и глотки. Этот феномен необходимо учитывать в случаях назначения голодной диеты при остром панкреатите у собак, кошек и других животных, не допуская их зрительного и обонятельного контакта с кормом.
Наряду с нервной происходит и гуморальная регуляция функции поджелудочной железы. Поступление соляной кислоты в двенадцатиперстную кишку вызывает секрецию поджелудочного сока даже после перерезки блуждающих и чревных (симпатических) нервов и разрушения продолговатого мозга. Это положение лежит в основе назначения медикаментов, снижающих секрецию поджелудочного сока при остром панкреатите. Под влиянием соляной кислоты желудочного сока, поступающего в кишечник, из клеток слизистой оболочки тонкой кишки выделяется просекретин. Соляная кислота активирует просекретин, превращая его в секретин. Всасываясь в кровь, секретин действует на поджелудочную железу, усиливая выделение ею сока: одновременно он тормозит функцию обкладочных желез, чем препятствует чрезмерно интенсивной секреции соляной кислоты железами желудка. Секретин в физиологическом отношении является гормоном. Под влиянием секретина образуется большое количество поджелудочного сока, бедного ферментами и богатого щелочами. Учитывая эту физиологическую особенность, лечение острого панкреатита направлено на снижение секреции соляной кислоты в желудке, подавление активности секретина.
В слизистой оболочке двенадцатиперстной кишки образуется также гормон панкреозимин, который усиливает образование ферментов в поджелудочном соке. Подобное действие оказывают гастрин (образуется в желудке), инсулин, соли желчных кислот.
Тормозящее влияние на секрецию панкреатического сока оказывают нейропептиды — гастроингибирующий полипептид (ГИП), панкреатический полипептид (ПП), вазоактивный интерстинальный полипептид (ВИП), а также гормон соматостатин.
При лечении плотоядных животных с нарушением внешнесекреторной функции поджелудочной железы необходимо иметь в виду, что на молоко выделяется мало сока, на мясо, черный хлеб — много. При кормлении мясом выделяется много трипсина, при кормлении молоком — много липазы и трипсина.
Источник
Внутрисекреторные элементы железы. Поджелудочная железа — орган, расположенный в изгибе двенадцатиперстной кишки. Ее экзокринные структуры (ацинусы) вырабатывают поджелудочный сок. У большинства рыб поджелудочная железа диффузная, состоящая из мелких разбросанных долек. Эндокринные клетки, по-видимому, аналогичны таковым у млекопитающих.
Эндокринная часть железы представлена островками Лангерганса —светлыми образованиями размером 50— 500 мкм, состоящими из разных типов эпителиальных клеток (альфа-, бета-и дельта-клеток).
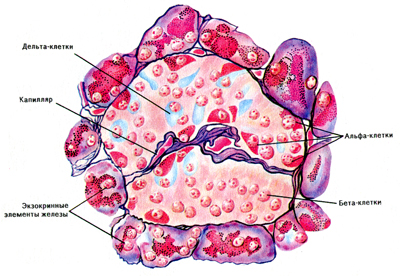
Островковая ткань занимает по объему 2—3 % у моногастричных животных и до 10 % у жвачных. Она не связана с выводными протоками железы.
Альфа-клетки располагаются обычно по периферии островка, содержат гранулы. Они продуцируют гормон глюкагон. Бета-клетки (их большинство) более крупные, заполняют центр островка, вырабатывают гормон инсулин. Дельта-клетки — немногочисленные, темные, содержат гормоны гастрин и соматостатин.
Инсулин, его строение и функция. Инсулин представляет собой белок с мол. массой 5700. Его предшественник — одноцепочный полипептид, содержащий у крупного рогатого скота и свиней 81 аминокислотный остаток. Он хранится в гранулах клеток до сигнала о выделении. При поступлении сигнала из молекулы проинсулина под действием пептидаз «выстригается» С-пептид и остается инсулин, состоящий из двух цепей — А и В (соответственно 21 и 30 АК-остатков), связанных дисульфидными мостиками. Скорость выделения инсулина прямо пропорциональна концентрации глюкозы в крови: она тем выше, чем выше уровень глюкозы. На секрецию инсулина влияет также содержание в плазме аминокислот, адреналина, глюкагона, секретина. В плазме большая часть инсулина связана с белками-переносчиками. Период полураспада его составляет 10—15 мин. Более 80 % гормона распадается в печени и почках.
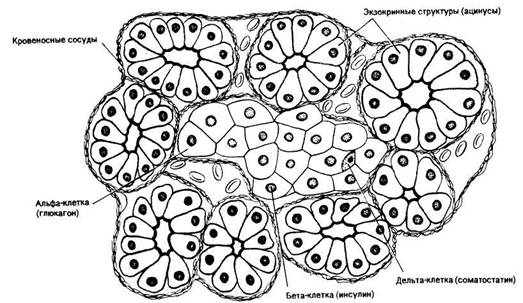
Рис. Срез поджелудочной железы (видны экзокринные структуры и клетки островковой ткани).
Рецепторы инсулина, с которыми он прочно связывается, находятся на мембране клеток печени, волокон скелетных мышц и клеток жировой ткани (адипоцитов). Эти рецепторы являются молекулами гликопротеина.
Вторичный внутриклеточный посредник, высвобождающийся при взаимодействии инсулина с рецептором, неизвестен; определенную роль в запуске инсулина, по-видимому, играют ионы Са+ +
Физиологическая роль инсулина стала выясняться при изучении метаболических сдвигов у животных с удаленной поджелудочной железой или с разрушенной (аллоксаном) островковой тканью, а также у индивидуумов, страдающих сахарным диабетом. Этот комплекс сдвигов включает: усиление процессов гликогенолиза и глюконеогенеза; снижение утилизации глюкозы периферическими тканями (кроме клеток центральной нервной системы); гипергликемию и глюкозурию; повышенное окисление жирных кислот в печени, избыточное образование кетоновых тел, кетонемию; снижение переноса аминокислот в клетки, замедление скорости синтеза белков в периферических тканях, избыточное образование и экскрецию мочевины.
Все эти симптомы свидетельствуют о наличии двух основных нарушений: а) затрудненной утилизации и резервировании глюкозы, ее выделении с мочой; б) превращении других питательных веществ в глюкозу. Нарушения метаболизма исчезают при введении инсулина, уровень глюкозы в крови нормализуется.
Инсулин выполняет в организме следующие основные функции:
увеличивает проницаемость клеток скелетных мышц, миокарда, жировой ткани для глюкозы, чем способствует ее утилизации;
стимулирует синтез гликогена в печени и мышцах;
снижает интенсивность глюконеогенеза в тканях, способствуя захвату аминокислот клетками и биосинтезу белка (эффект, противоположный АКТГ);
усиливает поглощение печенью и жировой тканью свободных жирных кислот и отложение их в форме триглицеридов (резервного жира), соответственно снижает образование кетоновых тел и накопление кислых продуктов;
у жвачных животных способствует поглощению глюкозы молочными железами, усиливает их снабжение «предшественниками» за счет периферийных тканей.
Экзогенное введение высоких доз инсулина или его повышенная секреция при новообразованиях островковой ткани могут вызвать резкую гипогликемию, что сопровождается общей слабостью, потоотделением, иногда судорогами и потерей сознания (гипогликемическая кома вследствие недостаточного обеспечения глюкозой клеток мозга). В крови при этом возрастает концентрация глюкокортикоидов, что частично компенсирует гипогликемию путем усиления процессов глюконеогенсза. Усиленная секреция инсулина у некоторых млекопитающих приводит к наступлению сезонной спячки, что также связано с гипогликемией.
Глюкагон. Глюкагон секретируется бета-клетками островкового аппарата поджелудочной железы. Представляет собой одноцепочечный нолинентид, состоящий у крупного рогатого скота из 29 АК-остатков и имеющий мол. массу 3500. Образуется из проглюкагона путем ферментативного отщепления 8 АК-остатков от его С-конца.
Период полураспада глюка гона в крови 5 —10 мин. Распад происходит преимущественно в почках.
Секреция глюкагона как и инсулина) регулируется уровнем глюкозы в крови. При его снижении секреция глюкагона возрастает, предположительно в результате выделения СТГ, играющего в данном случае роль тронного гормона. Способствуют выделению глюкагона аминокислота аргинин, соматостатин (вырабатывается дельта-клетками поджелудочной железы) и гормон пищеварительного тракта холецистокинин.
Глюкагон -— функциональный антагонист инсулина, повышающий уровень сахара в крови. Этот гипергликемический эффект глюкагона обусловлен: а) стимуляцией (подобно адреналину) распада гликогена в печени; б) торможением гликолитического распада глюкозы до молочной кислоты (путем ингибирования печеночной пируваткиназы).
В высоких концентрациях глюкагон стимулирует в печени процессы глюконеогенеза, т. е. образования глюкозы из аминокислот, пировиноградной кислоты, пропионовой кислоты.
Глюкагон влияет также на липидный обмен. Он ускоряет окисление жирных кислот в печени с образованием большого количества кетоновых тел, стимулирует освобождение глицерина и жирных кислот из жировой ткани.
Механизм действия глюкагона обычен: связывание гормона с рецепторами плазматической мембраны печеночных клеток, активация аденилатциклазы, синтез цАМФ и высвобождение глюкозы в кровь через ряд последовательных стадий (каскад усиления).
В эндокринных клетках тонких кишок животных образуется глюкагон, отличный по структуре и свойствам от поджелудочного. Он выделяется под влиянием глюкозы, находящейся в кишечнике, и, всасываясь в кровь, стимулирует секрецию инсулина бета-клетками островковой ткани. Когда глюкоза абсорбируется выделившийся инсулин обеспечивает ее депонирование в печени.
Источник