Оптимальное ph амилазы поджелудочной железы
Медицина / Физиология / Физиология (статья)
Физиология поджелудочной железы. Панкреатический сок. Амилаза
Статья |
9-08-2018, 12:53
|
 Поджелудочная железаПоджелудочная железа представляет собой орган бледно-желтого цвета, мягкой консистенции, длина которого составляет примерно 12-15 сантиметров, масса около 100 г; расположена поперечно в верхней части живота. Форма поджелудочной железы напоминает цилиндр с хорошо различимыми хвостом, телом и головкой. Головка поджелудочной железы находится в изгибе двенадцатиперстной кишки, тело находится за желудком, хвост направлен к селезенке (см рисунок).
Поджелудочная железаПоджелудочная железа представляет собой орган бледно-желтого цвета, мягкой консистенции, длина которого составляет примерно 12-15 сантиметров, масса около 100 г; расположена поперечно в верхней части живота. Форма поджелудочной железы напоминает цилиндр с хорошо различимыми хвостом, телом и головкой. Головка поджелудочной железы находится в изгибе двенадцатиперстной кишки, тело находится за желудком, хвост направлен к селезенке (см рисунок).
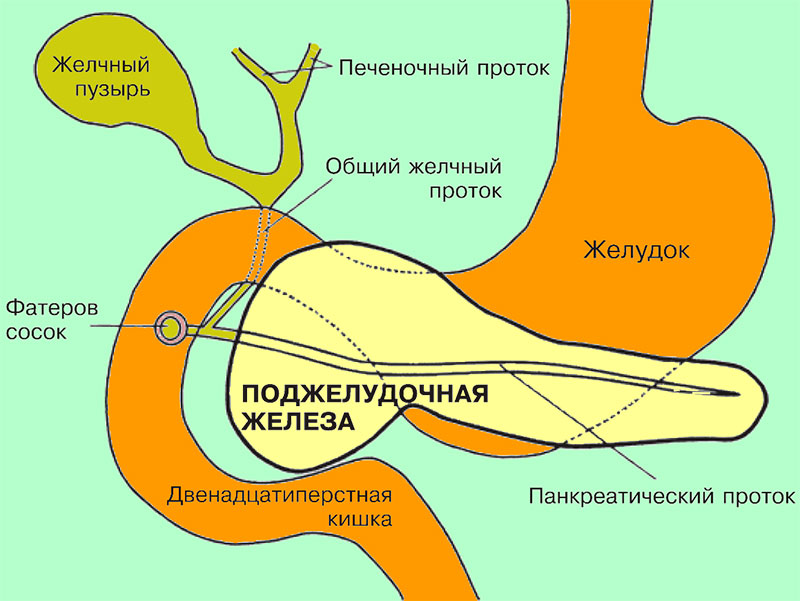
Поджелудочная железа и ее расположение по отношению к другим органам
Гистологическое строение поджелудочной железы представляет собой сложную альвеолярную структуру, состоящую из двух основных видов ткани, которые осуществляют внешнесекреторную (экзокринную) и внутрисекреторную (эндокринную) деятельность. Большая часть тканей органа выполняют экзокринную функцию. Примерно 90% поджелудочной железы занимает ацинарная ткань, в которой образуется панкреатический сок – жидкость для переваривания пищи в кишечнике.
Ацинарная ткань состоит из миллионов ацинусов – ационарных клеток, которые окружают микроскопические выводные протоки. Ацинус – функциональная единица ткани поджелудочной железы, внешне напоминающие виноградные гроздья. Мелкие выводные протоки объединяются, формируя крупные протоки, в которые из всех ацинусов собирается панкреатический сок и выводится в вирсунгов проток (панкреатический проток; лат. ductus pancreaticus) – главный (центральный) проток железы, который проходит вдоль всего органа. Вирсунгов проток выходит из головки поджелудочной железы и объединяется с общим желчным протоком возле фатерова соска (располагается в стенке двенадцатиперстной кишки). В фатеровом соске находится гладкая мышца – сфинктер Одди. Через сфинктер Одди в просвет двенадцатиперстной кишки поступают желчь и панкреатический сок.
Отметим, что примерно у 20% людей проток поджелудочной железы отдельно впадает в кишечник (на 1-2 см выше фатерова соска).
Среди ацинарной ткани расположены островки поджелудочной железы – островки Лангерганса, — группы клеток поджелудочной железы, выполняющих внутрисекреторную (эндокринную) функцию, наибольшее скопление которых находится в хвосте поджелудочной железы. Островки Лангерганса не связаны с протоками поджелудочной железы – они окружены кровеносными сосудами (капиллярами); их основная функция – продукция панкреатических гормонов. Островки Лангерганса состоят их трех основных типов клеток – α, β и δ. Каждый тип этих клеток отвечает за производство разных гормонов. В α-клетках поджелудочной железы продуцируется глюкагон, в β-клетках (эти клетки наиболее многочисленные) – инсулин, в δ-клетках – соматостатин. Эти гормоны поступают непосредственно в кровь и принимают участие в метаболизме.
Глюкагон и инсулин участвуют в регуляции углеводного обмена. Более подробно с функциями этих гормонов можно ознакомится в статье «Физиология углеводного обмена».
Панкреатический сок
Панкреатический сок – экзокринный продукт ационарной ткани поджелудочной железы, представляющий собой щелочную жидкость (pH примерно 8), в которой содержаться разные электролиты (в том числе ионы калия, хлора, натрия, бикарбоната) и пищевые ферменты. Электролиты в панкреатическом соке присутствуют в той же концентрации, что и в плазме крови (за исключением бикарбоната, концентрация которого примерно в 4 раза выше, чем в плазме, что обуславливает щелочную реакцию панкреатического сока).
В двенадцатиперстную кишку поступает примерно 1500-3000 мл панкреатического сока в сутки. Основная функция панкреатического сока заключается в ферментативном расщеплении пищи в тонкой кишке (отметим, что процесс пищеварения (ферментативного расщепления) начинается в ротовой полости, затем в желудке и двенадцатиперстной кишке). Благодаря своей щелочной среде, панкреатический сок ощелачивает (до pH 7-7,5) кислое содержимое желудка (частично переваренная пища), которое поступает из желудка в двенадцатиперстную кишку, таким образом панкреатические ферменты могут полноценно выполнять свою функцию.
В зависимости от субстрата воздействия, ферменты панкреатического сока делят на три группы:
- Амилаза – расщепляет углеводы
- Липаза – расщепляет жиры
- Протеаза – расщепляет протеины (белки)
Отметим, что амилаза и липаза секретируются в активной форме, а протеаза – в виде проферментов, которые способны расщеплять протеины только после активации (вступления в связь (реакцию) с другими веществами) в двенадцатиперстной кишке. Например, трипсин (кишечный протеолитический фермент) образуется из трипсиногена – неактивного панкреатического профермента. Таким образом, секреция протеаз в виде неактивных проферментов защищают саму поджелудочную железу от ферментативного разрушения.
Состав и объем панкреатического сока регулируется в основном гормонами. Холецистокинин (панкреозимин) – нейропептидный гормон, секретирующийся в двенадцатиперстной и тонкой кишке в ответ на поступление пищи из желудка. Основная функция холецистокинина – синтез пищевых ферментов в ацинарных клетках. Секретин – пептидный гормон, секретируемый в тонкой кишке, стимулирующий секрецию бикарбоната в ацинарных клетках.
Нервная система также участвует в регуляции образования панкреатического сока. Мысли о еде, запах и вид пищи, а также наличие ее в ротовой полости, стимулируют блуждающий нерв, который в свою очередь стимулирует секрецию панкреатического сока. Сфинктер Одди, расположенный в фатеровой (печеночно-поджелудочной) ампуле, отвечает за непосредственную регуляцию поступления панкреатического сока в просвет двенадцатиперстной кишки – при поступлении пищи сфинктер открывается.
То есть, объем, состав и выделение панкреатического сока регулируются с помощью нервно-гуморальных механизмов и зависят от текущих пищеварительных потребностей организма.
Когда панкреатический сок выполнил свою функцию, 99% содержащихся в нем жидкости и электролитов при прохождении через толстую кишку всасываются обратно в кровь.
Амилаза
Амилаза – пищеварительный фермент, входящий в состав пищеварительного сока и слюны (слюна выделяется в ротовой полости тремя парами слюнных желез). Слюнная и панкреатическая амилаза функционируют только в желудочно-кишечном тракте, расщепляя крахмал – основная форма углеводной пищи, является крупным полимером, мономером которого является глюкоза. В результате действия амилазы на крахмал образуется смесь трех видов молекул:
- Дисахарид мальтозы (состоит из двух объединенных между собой молекул глюкозы
- Декстрин (полисахарид, представляющий собой короткие цепи, состоящие примерно из восьми молекул глюкозы)
- Глюкоза
Глюкоза, которая образуется в результате расщепления крахмала амилазой, через слизистую оболочку кишечника попадает в кровь. Мальтоза и декстрин поддаются дальнейшему ферментативному расщеплению мальтазой и изомальтазой (кишечные ферменты), в результате чего образуются молекулы глюкозы, которые могут усваиваются, попадая в кровь.
Амилаза, как и другие ферменты, эффективно действует только в ограниченных пределах кислотно-щелочного баланса (pH). Оптимальный pH для действия амилазы составляет 7,1.
Процесс ферментативного расщепления крахмала амилазой, содержащейся в слюне, начинается в ротовой полости в процессе пережевывания пищи. Когда пищевой комок попадает в желудок, pH которого 2-3, действие слюнной амилазы прекращается. Если пища во рту находится недолго, слюнная амилаза расщепляет лишь незначительную часть крахмала – основная его часть поддается ферментативному расщеплению панкреатической амилазой в двенадцатиперстной и тощей кишках.
В нормальном (здоровом состоянии) незначительное количество амилазы попадает в кровь. Основное количество амилазы попадает в кровь из поджелудочной железы, из слюнных желез в кровь поступает лишь незначительная ее часть. Попадая в результате физиологического обновления клеток поджелудочной и слюнных желез в кровь, амилаза не выполняет каких-либо функций. Поскольку молекула амилазы имеет небольшие размеры, по сравнении с другими ферментами, она способна проникать через клубочки почек и относится к числу немногих ферментов, обнаруживаемых в норме в моче.
Источник
Ферментативный гидролиз крахмала.
Ферментативный гидролиз крахмала протекает под влиянием ферментов амилаз, которые содержатся в слюне, соке поджелудочной железы, крови, печени, мозге. Источниками амилаз в промышленности служат проросшие зерна злаков (солод) и культуры плесневых грибов.
Известны а- и -амилазы, которые несколько различаются по характеру действия. Под влиянием а-амилазы процесс гидролитического расщепления крахмала задерживается главным образом на стадии декстринов, а мальтозы образуется немного, тогда как под действием Р-амилазы расщепление идет в сторону преимущественного
образования мальтозы. Последовательно этот процесс можно представить следующим образом.
Мальтоза под действием фермента мальтазы (а-глю-козидазы) распадается на две молекулы a-D-глюкозы. Встречается также фермент глюкоамилаза, катализирующий распад крахмала до глюкозы.
Ход процесса гидролитического расщепления крахмала можно проследить с помощью реакций Троммера, Бенедикта или Ниландера (см. раздел VII), характеризующих восстанавливающие свойства углеводов.
При ферментативном гидролизе крахмала увеличивается количество свободных гликозидных гидроксилов, обусловливающих восстанавливающие свойства, и поэтому мальтоза и глюкоза способны восстанавливать окись меди до закиси, гидрат окиси висмута или окись серебра до металлов.
Реактивы: а) слюна. Свежую слюну разводят в 10 раз дистиллированной водой: б) крахмал, -ный раствор; в) раствор иода в иодистом калии (раствор Люголя): в нескольких миллилитрах воды растворяют 1 г иодистого калия, в концентрированном растворе соли растворяют 1 г иода и доливают водой до 300 мл; г) едкий натр, 5%-ный раствор; д) сернокислая медь -ный раствор.
В две пробирки наливают по -ного раствора крахмала, в одну из них добавляют 1 мл разведенной слюны (1 : 10), в другую — 1 мл воды и ставят на 10 мин.
в водяную баню, нагретую до 37—38° (внимательно следят за температурой, не допуская ее повышения), или, еще лучше, в ультратермостат, после чего охлаждают пробирки под краном. Проделывают реакции Троммера и с иодом, для чего содержимое каждой пробирки делят пополам.
Инактивация ферментов высокой температурой.
Являясь белковыми веществами, ферменты весьма чувствительны к температуре, при которой протекает реакция. Температурный оптимум действия ферментов теплокровных животных составляет 37—38° С. При небольшом повышении температуры (например, 40—45° С) скорость ферментативных реакций вначале повышается, но уже при дальнейшем нагревании (выше 50° С) падает, а при 70—80° утрачивается. Кипячение влечет за собой полную потерю каталитической активности ферментов вследствие денатурации их белковой части (апоферментов). При температурах ниже нуля скорость ферментативных реакций значительно понижается, но сами ферменты не разрушаются и при осторожном оттаивании восстанавливают свою активность.
Реактивы: а) слюна, разведенная в 5 раз дистиллированной водой; б) крахмал, 1%-ный раствор; в) раствор иода в иодистом калии (см. предыдущую работу); г) реактивы для реакции Троммера (см. предыдущую работу).
В две пробирки наливают по 1 мл разведенной слюны. Содержимое одной из них нагревают до кипения и кипятят 2—3 мин. Затем в обе пробирки добавляют по 1 мл раствора крахмала и ставят на 10 мин. в водяную баню, нагретую до 38° С, после чего проделывают реакции Троммера и с иодом. Убеждаются, что в пробирке, в которой фермент был инактивирован кипячением, расщепления крахмала не произошло.
Специфичность действия ферментов.
Это одно из важнейших свойств ферментов. Каждый фермент воздействует лишь на определенное вещество или группу веществ, близких по своей структуре. Различают следующие виды специфичности: а) абсолютную, когда ферменты катализируют лишь одну реакцию превращения какого-либо вещества. Например, уреаза (карбамид — амидогидролаза) катализирует только реакцию гидролитического расщепления мочевины до аммиака и двуокиси
углерода; б) групповую, когда ферментом катализируются реакции превращения близких по своей структуре веществ, построенных по одному типу. Так, сахараза (Р-фруктофуранозидаза) катализирует реакцию гидролитического расщепления сахарозы с освобождением молекул глюкозы и фруктозы, но тот же фермент катализирует также реакцию частичного гидролиза трисахарида рафинозы (а-галактозидо-а-глюкозидо-р-фруктозида), при которой освобождается лишь молекула фруктозы, а связь между галактозой и глюкозой остается ненарушенной; в) стереохимическую, которая проявляется в том, что фермент катализирует реакцию расщепления или синтеза только одного из стереоизомеров, не воздействуя на другой. Окисление L-молочной кислоты до пировиноградной катализируется ферментом лактатдегидрогеназой, тогда как тот же процесс D-молочной кислоты катализируется другим ферментом — -лактатде-гидрогеназой.
Реактивы: а) слюна, разведенная в 10 раз дистиллированной водой; б) сахароза, 1%-ный раствор; в) крахмал, 1%-ный раствор; г) реактивы для реакции Троммера.
В две пробирки наливают по 1 мл разведенной слюны, затем в одну из них добавляют 1 мл раствора сахарозы, а в другую — столько же раствора крахмала. Обе пробирки прогревают 10 мин. в водяной бане при температуре 38° С, после чего охлаждают и с содержимым каждой из них проделывают реакцию Троммера. Убеждаются, что амилаза катализировала лишь процесс гидролитического расщепления крахмала и не оказала действия на сахарозу.
Влияние pH среды на активность амилазы слюны.
Каждый фермент проявляет максимум своего каталитического действия при строго определенном pH среды. Наивысшую активность многие ферменты проявляют в изоэлектрической точке.
Оптимальное значение pH для пепсина составляет 1,5-2,0, амилазы слюны -6,8-7,0, трипсина — 7,8, липазы поджелудочной железы — 7,0-7,8. Было, однако, показано, что ферменты, катализирующие одни и те же реакции, но выделенные из различных субстратов, проявляют оптимум действия при неодинаковых значениях pH. Так, оптимум действия кишечной сахаразы наблюдается
при pH 6,2, а сахаразы, выделенной из дрожжей, — при pH 4,6-5,0. Оптимум pH амилазы слюны составляет 6,8-7,0, а амилаза солода проявляет максимум каталитической активности при pH 4,4-4,5.
Реактивы: а) слюна, разведенная дистиллированной водой в 100 раз; б) крахмал, 0,5%-ный раствор; в) лимонная кислота, 0,1 М раствор (19,212 г кислоты в 1 л); г) фосфорнокислый натрий двузамещенный М раствор (содержит 36,62 г соли в 1 л); д) раствор Люголя (раствор иода в иодистом калии); е) хлористый натрий, 1%-ный раствор.
В 7 однотипных пробирок пипетками наливают растворы лимонной кислоты и фосфорнокислого натрия в количествах, указанных в табл. 4, получая таким образом буферные смеси со значениями pH от 5,6 до 8,0. В каждую пробирку добавляют по 10 капель 1 %-ного раствора хлористого натрия, 0,5%-ного раствора крахмала, разведенной в 100 раз слюны и перемешивают.
Табл. 4. Фосфатно-цитратные буферные смеси
Пробирки ставят на 10 мин. в водяную баню при температуре 38° С, после чего быстро охлаждают, добавляют во все пробирки по 1 капле раствора Люголя, перемешивают и наблюдают окраску. Устанавливают, при каком pH произошло наиболее полное расщепление крахмала (желтая или буровато-желтая окраска с иодом). Реакция весьма специфична и показательна.
Источник
Амилаза (диастаза) первый, открытый в 1833г. фермент пищеварения, расщепляющий крахмал до мальтозы. Именно амилаза приводит к появлению сладковатого вкуса при длительном пережёвывании крахмалосодержащих продуктов без добавления сахара. Амилаза присутствует в слюне (птиалин), где начинает процесс пищеварения. По субстратной специфичности существует три типа амилаз, обозначаемых альфа, бета и гамма.
α-Амилаза является кальций-зависимым ферментом. К этому типу относятся амилаза слюнных желез и амилаза поджелудочной железы. α-амилаза гидролизирует полисахаридную цепь крахмала и других длинноцепочечных углеводов, приводя к образованию олигосахаридов различной длины. У животных α-амилаза является основным пищеварительным ферментом. Активность α-амилазы оптимальна при нейтральной pH 6,7-7,0. Фермент обнаружен также у растений при прорастании семян, в грибах и бактериях.
β-Амилаза присутствует у бактерий, грибов и растений, но отсутствует у животных. При созревании фруктов β-амилаза расщепляет плодовый крахмал на сахара, что приводит к сладкому вкусу зрелых плодов. В семенах она активна на стадии предшествующей прорастанию. β-амилаза пшеницы является ключевым компонентом при образовании солода. Бактериальная β-амилаза участвует в разложении внеклеточного крахмала.
γ-Амилаза. В отличие от других амилаз γ-амилаза наиболее активна в кислых условиях при pH 3.
Амилаза – фермент, содержащийся преимущественно в пищеварительном тракте. При повреждении органов, содержащих амилазу, большое количество ее попадает в кровь и выделяется с мочой при этом 50% ее реабсорбируется канальцами, возвращаясь в кровяное русло. Повышение уровня амилазы наблюдается при воспалениях и новообразованиях поджелудочной железы, асците и беременности (состоянии постоянного давления на поджелудочную железу), воспалении слюнных желез, почечной недостаточности, энтеритах, сахарном диабете; у собак уровень общей амилазы повышен при кормлении углеводистыми кормами (каши, фрукты).
Различают три изофермента амилазы, два из них являются основными по количественному и диагностическому значению: панкреатическая амилазу (Р-изофермент) (амилаза, вырабатываемая в поджелудочной железе) и амилаза слюны (S-изофермент).
Изофермент амилазы, характерный для поджелудочной железы, синтезируется ацинарными клетками поджелудочной железы и секретируется в кишечный тракт через систему протоков поджелудочной железы. Большая часть панкреатической амилазы расщепляется в дистальной части тонкого кишечника трипсином, лишь небольшое количество попадает в кровь. Уровень панкреатической амилазы (так же, как и общей амилазы) сыворотки крови возрастает при острых панкреатитах, при хирургических и травматических повреждениях поджелудочной железы. Но по клинической чувствительности и специфичности диагностическая ценность исследования панкреатической α-амилазы в выявлении острых панкреатитов на 38% выше чувствительности общей α-амилазы. Активность панкреатической α-амилазы в сыворотке крови составляет 30-55% от общей амилазы, в моче — 60-70%. Диагностическая чувствительность панкреатической амилазы в сыворотке крови для острого панкреатита составляет 92%, специфичность — 85%.
Особенности изменения активности изоферментов при некоторых патологических состояниях:
— увеличение активности Р-изофермента при: панкреатите (до 75-80%), перфорирующей язве, непроходимости кишечника, мезентериальном инфаркте
— увеличение активности S –изофермента при: повреждении слюнных желез
— увеличение активности S- и Р –изоферментов при: почечной недостаточности, перитоните, диабете.
При остром панкреатите содержание амилазы увеличивается через 5 – 6 часов от начала острого приступа и сохраняется повышенным в 6-10 раз в течение 2 – 5 дней. Увеличение активности ее в плазме, как правило, не отражает тяжесть заболевания, а подчас наоборот деструкция поджелудочной железы может не сопровождаться значительным увеличением концентрации панкреатической α–амилазы в плазме.
Понижение уровня амилазы в крови встречается при недостаточности работы органов, вырабатывающих этот фермент: недостаточность поджелудочной железы после тяжелого острого панкреатита, панкреонекроз (отмирание большей части поджелудочной железы).
Определение амилазы в крови производится с помощью биохимического анализа. Для получения достоверных результатов анализа кровь рекомендуется сдавать в утренние часы, не менее чем через 8 часов после последнего приема пищи.
Источник