Преждевременная активация ферментов поджелудочной железы
В
поджелудочной железе синтезируются
проферменты ряда протеаз: трипсиноген,
химотрипсиноген, проэластаза,
прокарбоксипептидазы А и В. В кишечнике
они путём частичного протеолиза
превращаются в активные ферменты
трипсин, химотрипсин, эластазу и
карбок-сипептидазы А и В.
Активация
трипсиногена происходит
под действием фермента эпителия
кишечника энтеропептидазы.
464
Этот
фермент отщепляет с N-конца молекулы
трипсиногена гексапептид Вал-(Асп)4-Лиз.
Изменение конформации оставшейся части
полипептидной цепи приводит к формированию
активного центра, и образуется активный
трипсин. Последовательность Вал-(Асп)4-Лиз
присуща большинству известных
трипсиноге-нов разных организмов — от
рыб до человека.
Образовавшийся
трипсин активирует
химотрипсиноген, из
которого получается несколько активных
ферментов (рис. 9-3). Химотрипсиноген
состоит из одной полипептидной цепи,
содержащей 245 аминокислотных остатков
и пяти дисульфидных мостиков. Под
действием трипсина расщепляется
пептидная связь между 15-й и 16-й
аминокислотами, в результате чего
образуется активный π-химотрипсин.
Затем под действием π-химотрипсина
отщепляется дипептид сер(14)-арг(15), что
приводит к образованию δ-химотрипсина.
Отщепление дипептида тре(147)-арг(148)
завершает образование стабильной формы
активного фермента — α-химотрипсина,
который состоит из трёх полипептидных
цепей, соединённых дисульфидными
мостиками.
Остальные
проферменты панкреатических протеаз
(проэластаза и прокарбоксипептидазы
А и В) также активируются трипсином
путём частичного протеолиза. В результате
образуются активные ферменты — эластаза
и карбокси-пептидазы А и В.
2. Специфичность действия протеаз
Трипсин
преимущественно гидролизует пептидные
связи, образованные карбоксильными
группами аргинина и лизина. Химотрипсины
наиболее активны в отношении пептидных
связей, образованных карбоксильными
группами ароматических аминокислот
(Фен, Тир, Три).
Карбоксипептидазы
А и В — цинксодержащие ферменты, отщепляют
С-концевые остатки аминокислот. Причём
карбоксипептидаза А
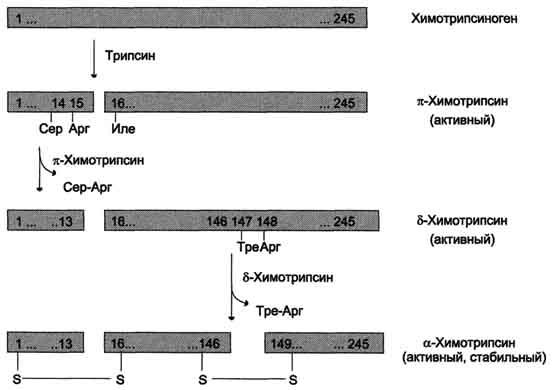
Рис.
9-3. Активация химотрипсиногена. Молекула
химотрипсиногена состоит из 245
аминокислотных остатков и имеет пять
дисульфидных мостиков. На схеме показаны
участки фермента, подвергающиеся
протеолизу. а-Химотрипсин — активная
стабильная форма фермента — состоит из
трёх полипептидных цепей, ковалентно
связанных между собой двумя дисульфидными
мостиками и нековалентно — за счёт
водородных связей и гидрофобных
взаимодействий.
465
отщепляет
преимущественно аминокислоты, содержащие
ароматические или гидрофобные радикалы,
а карбоксипептидаза В — остатки аргинина
и лизина.
Последний
этап переваривания — гидролиз небольших
пептидов, происходит под действием
ферментов аминопептидаз и дипептидаз,
которые синтезируются клетками тонкого
кишечника в активной форме.
Аминопептидазы последовательно
отщепляют N-концевые аминокислоты
пептидной цепи. Наиболее известна
лейцинаминопептидаза — Zn2+-
или Мn2+-содержащий
фермент, несмотря на название, обладающий
широкой специфичностью по отношению
к N-концевым аминокислотам.Дипептидазы расщепляют
дипептиды на аминокислоты, но не
действуют на трипептиды.
В
результате последовательного действия
всех пищеварительных протеаз большинство
пищевых белков расщепляется до свободных
аминокислот.
В.
Защита клеток от действия протеаз
Клетки
поджелудочной железы защищены от
действия пищеварительных ферментов
тем, что:
эти
ферменты образуются
в виде неактивных предшественников в
клетках поджелудочной железы и
активируются только после секреции в
просвет кишечника. Таким образом, место
синтеза и место действия этих ферментов
пространственно разделены.в
клетках поджелудочной железы
присутствует белок-ингибитор
трипсина, образующий
с активной формой фермента (в случае
преждевременной активации) прочный
комплекс.
В
полости желудка и кишечника протеазы
не контактируют с белками клеток,
поскольку слизистая оболочка покрыта
слоем слизи, а каждая клетка содержит
на наружной поверхности плазматической
мембраны полисахариды, которые не
расщепляются протеазами и тем самым
защищают клетку от их действия.
Разрушение
клеточных белков протеазами происходит
при язвенной болезни желудка или
двенадцатиперстной кишки. Однако
начальные механизмы возникновения
язвы ещё мало изучены.
Г.
Транспорт аминокислот в клетки
Аминокислоты,
образовавшиеся при переваривании
белков, быстро всасываются в кишечнике.
Транспорт их осуществляется двумя
путями: через воротную систему печени,
ведущую прямо в печень, и по лимфатическим
сосудам, сообщающимся с кровью через
грудной лимфатический проток. Максимальная
концентрация аминокислот в крови
достигается через 30-50 мин после приёма
белковой пищи (углеводы и жиры замедляют
всасывание аминокислот). Всасывание
L-аминокислот (но не D-изомеров) — активный
процесс, требующий затраты энергии.
Аминокислоты переносятся через кишечную
стенку от слизистой её поверхности в
кровь (рис. 9-4). Перенос через щёточную
кайму осуществляется целым рядом
переносчиков, многие из которых действуют
при участии Nа+-зависимых
механизмов симпорта, подобно переносу
глюкозы (см. раздел 7).
Различная
скорость проникновения аминокислот
через мембраны клеток указывает на
наличие транспортных систем, обеспечивающих
перенос аминокислот как через внешнюю
плазматическую мембрану, так и через
внутриклеточные мембраны. В настоящее
время известно по крайней мере пять
специфических транспортных систем,
каждая из которых функционирует
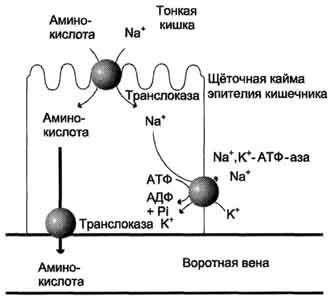
Рис.
9-4. Механизм всасывания аминокислот в
кишечнике. L-аминокислота
поступает в энтероцит путём симпорта
с ионом Na+.
Далее специфическая транслоказа
переносит аминокислоту через мембрану
в кровь. Обмен ионов натрия между
клетками осуществляется путём
первично-активного транспорта с помощью
Nа+,К+-АТФ-азы.
466
для
переноса определённой группы близких
по строению аминокислот:
нейтральных,
с короткой боковой цепью (аланин, серии,
треонин);нейтральных,
с длинной или разветвлённой боковой
цепью (валин, лейцин, изолейцин);с
катионными радикалами (лизин, аргинин);с
анионными радикалами (глутаминовая и
аспарагиновая кислоты);иминокислот
(пролин, оксипролин).
Причём
к числу Nа+-зависимых
относятся переносчики аминокислот,
входящих в первую и пятую группы, а
также переносчик метионина. Независимые
от Na+ переносчики
специфичны для некоторых нейтральных
аминокислот (фенилаланин, лейцин) и
аминокислот с катионными радикалами
(лизин).
Аминокислоты
конкурируют друг с другом за специфические
участки связывания. Например, всасывание
лейцина (если концентрация его достаточно
высока) уменьшает всасывание изолейцина
и валина.
Одна
из специфических транспортных систем
для некоторых нейтральных аминокислот
функционирует в кишечнике, почках и,
по-видимому, мозге. Она получила название
γ-глутамильного цикла (рис. 9-5).
В
этой системе участвуют 6 ферментов,
один из которых находится в клеточной
мембране, а остальные — в цитозоле.
Ключевую роль в транспорте аминокислоты
играет мембранно-связан-ный фермент
γ-глутамилтрансфераза. Этот
фермент является гликопротеином и
катализирует перенос γ-глутамильной
группы от глутатиона (иногда другого
γ-глутамильного пептида) на транспортируемую
аминокислоту и последующий перенос
комплекса в клетку. Глутатион представляет
собой трипептид — γ-глутамилцистеинилглицин,
который находится во всех тканях
животных. Реакция протекает следующим
образом (см. схему А на с. 468).
Аминокислота,
связанная с γ-глутамильным остатком,
оказывается внутри клетки. В следующей
реакции происходит отщепление
γ-глутамильного
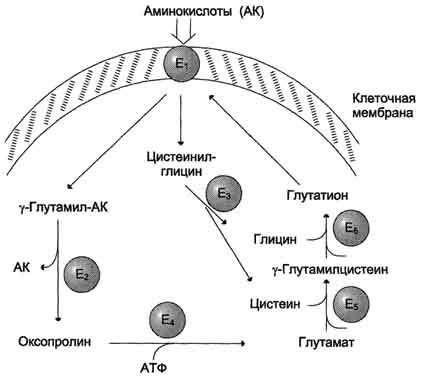
Рис.
9-5. γ-Глутамильный
цикл. Система
состоит из одного мембранного и пяти
цитоплазматических ферментов. Перенос
аминокислоты внутрь клетки осуществляется
в комплексе с глутамильным остатком
глутатиона под действием
γ-глутамилтрансферазы. Затем аминокислота
освобождается, а γ-глутамильный остаток
в несколько стадий превращается в
глутатион, который способен присоединять
следующую молекулу аминокислоты. Е1 —
γ-глутамилтрансфераза; Е2 —
у-глутамилциклотрансфераза; Е3 —
пептидаза; Е4 —
оксопролиназа; Е5 —
γ-глутамилцистеинсинтетаза; Е6 —
глутатионсинтетаза.
467
остатка
под действием фермента
γ-глутамилциклотрансферазы (см. схему
Б).
Дипептид
цистеинилглицин расщепляется под
действием пептидазы на 2 аминокислоты
— цис-теин и глицин. В результате этих
3 реакций происходит перенос одной
молекулы аминокислоты в клетку (или
внутриклеточную структуру). Следующие
3 реакции обеспечивают регенерацию
глутатиона, благодаря чему цикл
повторяется многократно. Для транспорта
в клетку одной молекулы аминокислоты
с участием γ-глутамильного цикла
затрачиваются 3 молекулы АТФ.
Д.
Нарушение переваривания белков и
транспорта аминокислот
Небольшую
долю продуктов переваривания белка
составляют негидролизованные короткие
пептиды. У некоторых людей возникает
иммунная реакция на приём белка, что,
очевидно, связано со способностью к
всасыванию
таких
пептидов. Продукты полностью переваренного
белка (аминокислоты) лишены антигенных
свойств и иммунных реакций не вызывают.
У
новорождённых проницаемость слизистой
оболочки кишечника выше, чем у взрослых,
поэтому в кровь могут поступать антитела
молозива (секрет молочных желёз,
выделяющийся в первые дни после родов,
обогащённый антителами и антитоксинами).
Это усугубляется наличием в молозиве
белка — ингибитора трипсина. Протеолитические
ферменты в пищеварительных секретах
новорождённых обладают низкой
активностью. Всё это способствует
всасыванию в кишечнике небольшого
количества нативных белков, достаточного
для обеспечения иммунной реакции.
Очевидно, подобное усиление всасывающей
способности кишечника является причиной
наблюдаемой иногда непереносимости
белков пищи (например, молока и яиц) у
взрослых людей.
Гниение
Известно,
что микроорганизмы кишечника
для своего роста также нуждаются в
доставке с пищей определенных аминокислот.
Микрофлора кишечника располагает
набором ферментных систем, отличных
от соответствующихферментов животных тканей и
катализирующих самые разнообразные
превращения пищевых аминокислот.
В кишечнике создаются оптимальные
условия для образования ядовитых
продуктов
распада аминокислот: фенола,индола, крезола, скатола, сероводорода,
метилмер-каптана, а также нетоксичных
для организма соединений: спиртов, аминов, жирных
кислот,кетокислот, оксикислот и
др.
Все
эти превращения аминокислот,
вызванные деятельностью микроорганизмовкишечника,
получили общее название «гниение белков в
кишечнике». Так, в процессе
распада серосодержащих
аминокислот (цистин, цистеин, метионин)
в кишечнике образуются сероводород H2S
и метил-меркаптан CH3SH.
Диаминокислоты – орнитин и лизин –
подвергаются процессудекарбоксилирования с
образованием аминов –
путресцина и кадаверина.
Из
ароматических аминокислот: фенилаланин, тирозин и триптофан –
при аналогичном
бактериальном декарбоксилировании образуются
соответствующие амины: фенилэтиламин,
параоксифенилэтиламин (или тира-мин)
и индолилэтиламин (триптамин).
Кроме того, микробные ферментыкишечника
вызывают постепенное разрушение боковых
цепей циклическихаминокислот,
в частности тирозина и триптофана,
с образованием ядовитых продуктов
обмена – соответственно крезола и фенола, скатола и индола.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
B. Снижение уровня ферментов в панкреатическом соке
C. Повышение активации ферментов в двенадцатиперстной кишке
D. Снижение секреции панкреатического полипептида
E. Повышение уровня холецистокинина
Патофизиология печени. Печеночная недостаточность.
1. У больного 38 лет, который перенес гепатит и продолжал употреблять алкоголь, развились признаки цирроза печени с асцитом и отёками на нижних конечностях. Какие изменения состава крови стали решающими в развитии отеков?
A. Гипоальбуминемия
B. Гипоглобулинемия
C. Гипохолестеринемия
D. Гипокалиемия
E. Гипогликемия
2. У полной женщины 52 лет установлен цирроз печени. Лабораторно: гипоальбуминемия, гиперглобулинемия. Визуально: отеки рук, век, ног. Наиболее вероятной причиной отеков является изменение:
A. Онкотическое давления крови
B. Буферной емкости крови
C. Кислотно-основного равновесия
D. Дезинтоксикационной функции печени
E. Гликогенсинтетической функции печени
3. У больного диагностирован асцит. На животе выступают крупные сосуды синюшного оттенка. Признаком какой гипертензии является данное явление?
A. Портальной
B. Малого круга кровообращения
C. Эссенциальной
D. Церебро-ишемической
E. Почечной
4. Больной Н. поступил с жалобами на диспепсические расстройства, мелену, геморроидальные кровотечения. При исследовании выявлено расширение сети венозных сосудов на передней стенке живота в комплексе с увеличением его размеров. Какая патология ЖКТ может проявляться такими симптомами?
A. Портальная гипертензия
B. Кишечная аутоинтоксикация
C. Язвенная болезнь
D. Колит
E. Энтерит
5. У больного с алкогольным циррозом печени жалобы на общую слабость, одышку. Установлено снижение артериального давления, асцит, расширение поверхностных вен передней стенки живота, спленомегалия. Какое нарушение гемодинамики наблюдается у больного?
A. Синдром портальной гипертензии
B. Недостаточность левого желудочка сердца
C. Недостаточность правого желудочка сердца
D. Коллапс
E. Тотальная сердечная недостаточность
6. У больного после отравления грибами появилась жёлтая окраска кожи и склер, тёмный цвет мочи. Какой пигмент вызывает окраску мочи больного при гемолитической желтухе?
A. Стеркобилин
B. Моноглюкуронид билирубина
C. Неконъюгированный билирубин
D. Вердоглобин
E. Биливердин
7. Больная хроническим гепатитом жалуется на повышение чувствительности к барбитуратам, которые ранее она переносила без симптомов интоксикации. С нарушением какой функции печени это связано в наибольшей мере?
A. Метаболической
B. Желчеобразующей
C. Гемодинамической
D. Гемопоэтической
E. Фагоцитарной
8. У женщины 57 лет после длительного болевого приступа в правом подреберье появилась желтуха, после чего больная обратилась к врачу. Возникло подозрение на наличие у больной острого калькулёзного холецистита. Исследование какого показателя крови свидетельствует о непроходимости жёлчных протоков?
A. Свободного и связанного билирубина
B. Белковых фракций
C. Общего количества липидов
D. Мочевой кислоты
E. Остаточного азота
9. Мальчику 15 лет установлен диагноз острого вирусного гепатита. Исследование какого показателя крови необходимо провести для подтверждения острого поражения печёночных клеток?
A. Активность аминотрансфераз (АЛТ и АСТ)
B. Содержание свободного и связанного билирубина
C. Скорость оседания эритроцитов
D. Уровень холестерина
E. Содержание белковых фракций
10. При гепатите, инфаркте миокарда в плазме крови больных резко возрастает активность аланин- и аспартатаминотрасфераз. Каковы причины роста активности этих ферментов в крови?
A. Повреждение мембран клеток и выход ферментов в кровь
B. Повышение активности ферментов гормонами
C. Недостаток пиридоксина
D. Рост скорости синтеза аминокислот в тканях
E. Увеличение скорости распада аминокислот в тканях
11. Больному 25 лет установлен диагноз хронического гепатита. Больной жалуется на потерю массы тела на 10 кг на протяжении 2 месяцев. Объективно: кожа сухая, шелушащаяся, бледная с желтоватым оттенком, мелкоточечные кровоизлияния на коже, кровоточивость десен. Нарушение какой функции печени отражают мелкоточечные кровоизлияния и кровоточивость десен:
A. Белковосинтетической
B. Пигментообразующей
C. Гликогенсинтетической
D. Детоксикационной
E. Депонирующей
12. Больной Ж., 48 лет, находится в реанимации после отравления четыреххлористым углеродом. Состояние тяжелое, больной без сознания, пульс нитевидный, слабого наполнения, ЧСС 40 уд/мин АД 75/40 мм рт.ст., дыхание периодическое типа Биота. В крови прямой билирубин – 155 мкмоль/л. В моче высокое содержание аммиака и билирубина. Что явилось основной причиной описанного состояния у больного?
A. Печеночная недостаточность
B. Кардиогенный шок
C. Дыхательная недостаточность
D. Сердечная недостаточность
E. Почечная недостаточность
13. У больного 35 лет развилась иммунная гемолитическая анемия. Какой показатель сыворотки крови возрастает в наибольшей степени?
A. Непрямой билирубин
B. Прямой билирубин
C. Стеркобилиноген
D. Мезобилиноген
E. Протопорфирин
14. Мужчина 28 лет, поступил с жалобами на тошноту, рвоту, боль в правом подреберье. Объективно: желтушность кожи, склер, температура тела повышена, печень увеличена, моча темная, кал гипохоличный, гипербилирубинемия (билирубин прямой и непрямой), билирубинурия, уробилинурия, гипопротеинемия, снижение свертываемости крови. Для какого из нижеперечисленных состояний наиболее характерны эти изменения?
Источник
В
физиологических условиях клетки
поджелудочной железы, продуцирующие
пищеварительные ферменты, защищены от
самопереваривания благодаря наличию
уникальных механизмов. Во-первых, эти
ферменты вырабатываются в виде неактивных
форм. Во-вторых, субклеточные компартменты,
содержащие зимогенные гранулы,
анатомически разделены. В-третьих,
проферменты в секреторных гранулах
упакованы в комплексе с ингибиторами
протеаз и окружены белком паракристаллином.
И, наконец, в-четвертых, в зимогенных
гранулах присутствуют низкие концентрации
ионизированного кальция, а рН внутренней
среды гранул смещено в кислую сторону,
что препятствует преждевременной
активации проферментов в клетках
поджелудочной железы. При несостоятельности
этих механизмов создаются условия для
внутриклеточной активации проферментов
и самопереваривания (аутодигестии)
клеток поджелудочной железы, т.е. для
развития острого панкреатита.
Причины,
вызывающие острый панкреатит, бывают
экзогенные и эндогенные. К экзогенным
причинам относятся:
прием
больших доз алкоголя, особенно при
наличии сопутствующей желчнокаменной
болезни (ЖКБ);вирусы
(эпидемического паротита, Коксаки и
др.);травмы,
хирургические вмешательства, инвазивные
диагностические исследования;прием
некоторых лекарственных препаратов
(диуретиков тиазидового ряда, этакриновой
кислоты, фуросемида; азатиоприна,
вальпроевой кислоты, эстроген-содержащих
препаратов, тетрациклина, сульфаниламидов,
пентамидина и др.);укус
скорпиона.
Острый
панкреатит может быть вызван эндогенными
причинами:
обструкцией
общего желчного протока конкрементами
при ЖКБ, а также рефлюксом желчи в
панкреатические протоки;отеком
или спазмом сфинктера Одди;гиперкальциемией,
например, при гиперфункции паращитовидных
желез;пенетрацией
в поджелудочную железу пептической
язвы.
Дислипопротеинемии
I,
IV,
V
типов, заболевания соединительной ткани
и почечная недостаточность также часто
осложняются развитием острого панкреатита.
Иногда точную причину острого панкреатита
установить не удается, и в этом случае
говорят об идиопатическом остром
панкреатите.
Патогенез
острого панкреатита можно представить
в виде схемы:
действие
патогена
развитие универсальных механизмов
повреждения экзокринных клеток
поджелудочной железы («окислительный»
и «нитрозилирующий» стресс, уменьшение
образования АТФ, увеличение содержания
внутриклеточного ионизированного
кальция)
повреждения структуры внутриклеточных
микротрубочек и микрофиламентов
нарушение выделения зимогенных гранул
в панкреатические протоки
”панкреастаз”
смешивание содержимого гранул лизосом
и зимогенных гранул
внутриклеточная активация трипсиногена
и превращение его в трипсин
запуск каскада активации остальных
проферментов и других биологически
активных веществ.
Трипсин
способен активировать панкреатическую
липазу, которая разрушает мембраны
клеток поджелудочной железы и вызывает
их жировой некроз. Активация фосфолипазы
А2 (ФЛ А2) под влиянием трипсина приводит
к расщеплению лецитина клеточных мембран
до лизолецитина, лизолецитина, обладающего
мембранотоксическим действием и
усугубляющим выраженность повреждения
клеток поджелудочной железы. Трипсин
также способствует превращению
панкреатической проэластазы в активную
эластазу. Последняя нарушает целостность
кровеносных сосудов поджелудочной
железы и увеличивает их проницаемость,
способствуя тем самым усилению отека
поджелудочной железы. Кроме того, под
влиянием трипсина из калликреиногена
образуются большие количества калликреина
и брадикинина. Эти медиаторы воспаления
способны активировать эндотелиоцитарную
конституциональную NO-синтазу
кровеносных сосудов не только поджелудочной
железы, но и всего организма. Увеличение
образования оксида азота в кровеносных
сосудах ведет к снижению их тонуса,
увеличению их проницаемости, отеку
поджелудочной железы и артериальной
гипотензии. Брадикинин, взаимодействуя
с соответствующими рецепторами, вызывает
боль, которая при остром панкреатите
может быть нестерпимой; некоторые
пациенты характеризуют ее как «чувство
вбитого кола в подреберье». Трипсин
также способствует превращению
протромбина в тромбин, что, совместно
с активацией тромбоцитов провоспалительными
цитокинами и другими медиаторами
воспаления приводит к развитию
ДВС-синдрома.
Попадание
содержимого секреторных гранул в
интерстиций поджелудочной железы
хемоаттрактантное действие компонентов
гранул
привлечение в очаг воспаления клеток
лейкоцитарного ряда
активация нейтрофилов и макрофагов
выделение в интерстициальное пространство
АФК и АФА, а также протеаз – катепсинов
B,
D,
G, коллагеназы и эластазы; образование
макрофагами провоспалительных цитокинов
ФНО-,
ИЛ-6, ИЛ-8
амплификация локального воспаления
развитие системного воспалительного
ответа.
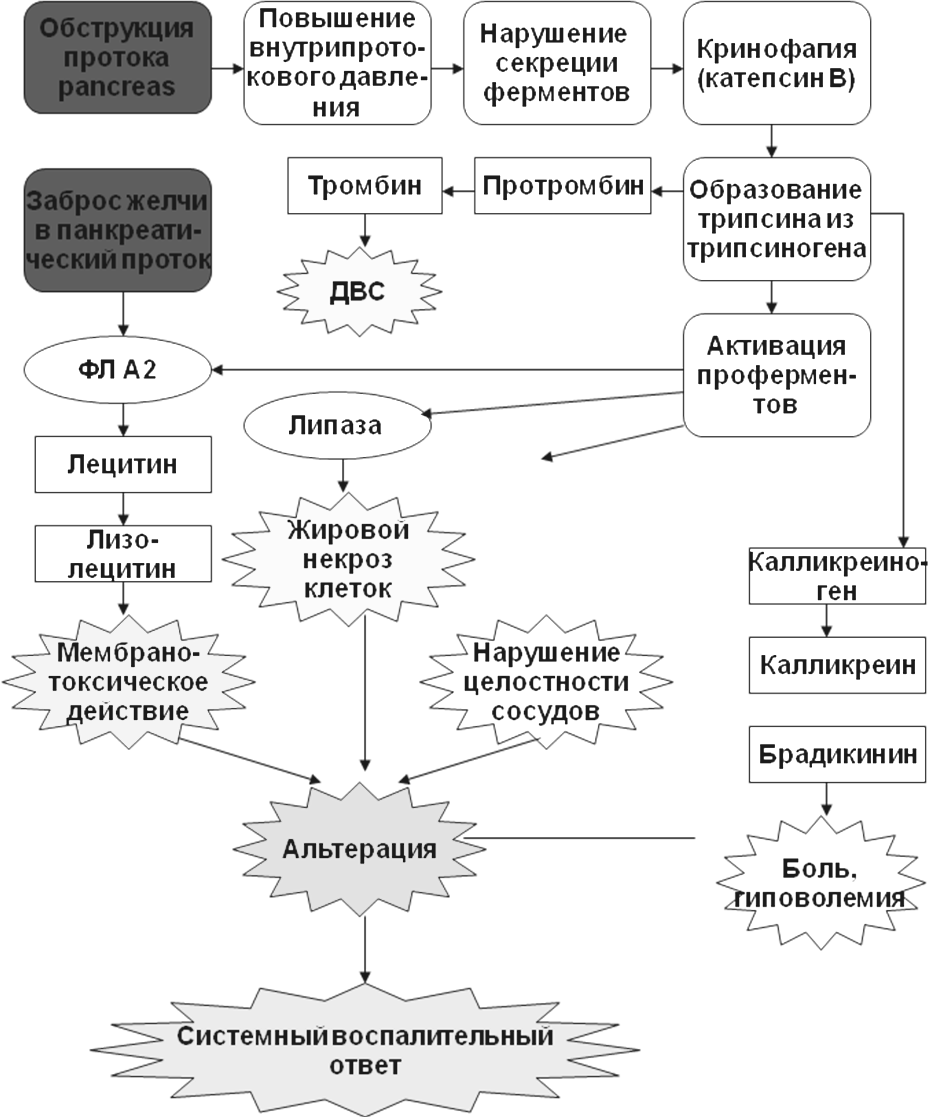
Рис.
Патогенез острого панкреатита
Существуют
некоторые особенности механизмов
возникновения острого панкреатита при
действии различных патогенов. Так, одна
из наиболее частых причин острого
панкреатита – употребление чрезмерных
количеств алкоголя. В этом случае
развитию панкреатита способствуют:
стимуляция этанолом внешнесекреторной
функции поджелудочной железы; спазм
или острый отек сфинктера Одди под
действием этанола, приводящие к увеличению
давления в протоках поджелудочной
железы; повышение активности окислительного
пути деградации этанола в поджелудочной
железе и гибель части ее паренхиматозных
клеток в результате «окислительного»
стресса. При ЖКБ могут наблюдаться спазм
или отек сфинктера Одди, либо заброс
желчи и содержимого 12-перстной
кишки
в протоки поджелудочной железы. При
этом внутриклеточной активации
проферментов предшествует активация
фосфолипазы А2.
Морфологически
острый панкреатит может проявляться
острым отеком поджелудочной железы,
геморрагическим воспалением,
панкреонекрозом и гнойным воспалением.
Достаточно часто при остром панкреатите
пациенты погибают из-за развития
системных осложнений.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник



