Рак головки поджелудочной железы операция анастомоз
Оглавление темы «Операции при раке поджелудочной железы.»:
- Показания для панкреатикодуоденэктомии по Уипплу
- Доступ и ход операции панкреатикодуоденэктомии по Уипплу
- Показания для обходных анастомозов при неудалимом раке поджелудочной железы
- Доступ и ход операции обходного анастомоза при раке поджелудочной железы
- Показания для дистальной панкреатэктомии при раке поджелудочной железы
- Доступ и ход операции дистальной панкреатэктомии при раке поджелудочной железы
- Показания для центральной панкреатэктомии с панкреатикогастростомией
- Доступ и ход операции центральной панкреатэктомии с панкреатикогастростомией
Доступ и ход операции обходного анастомоза при раке поджелудочной железы
Вмешательство можно выполнить либо через двусторонний подрёберный доступ, либо через верхнюю срединную лапаротомию. Мы предпочитаем выполнение позадиободочной гастроеюностомии. В прошлом основным обходным желудочным анастомозом при неоперабельном периампулярном раке была впередиободочная гастроеюностомия.
После такой операции нередко возникала задержка опорожнения желудка, вследствие чего больные, не имевшие дуоденальной обструкции или застоя желудочного содержимого до операции, вынуждены были оставаться в стационаре на долгое время для лечения этого осложнения. Позже мы стали выполнять позадиободочную гастроеюностомию. Прооперировав более 200 больных, мы лишь в немногих случаях столкнулись с задержкой опорожнения желудка.
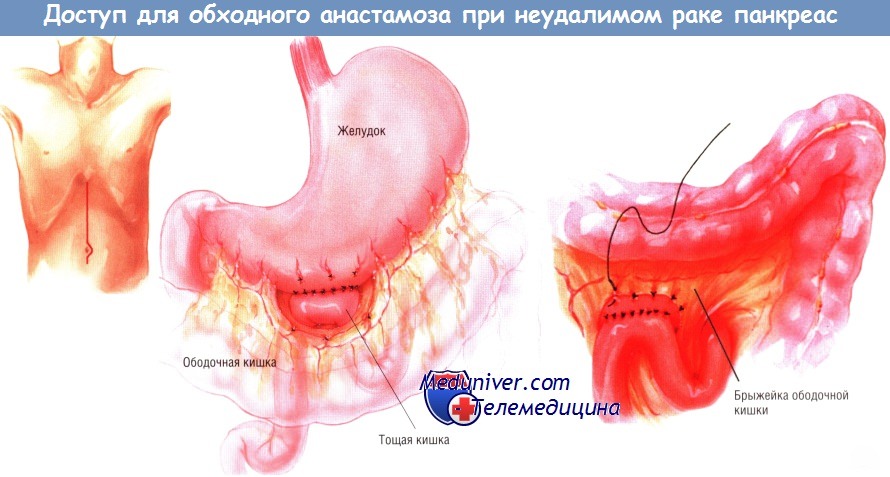
Большую кривизну желудка отделяют от сальника в наиболее свисающей области. После этого проксимальную петлю тощей кишки, расположенную чуть ниже связки Трейтца, протягивают кверху через отверстие в брыжейке поперечной ободочной кишки и накладывают гастроеюноанастомоз «бок в бок».
Внутренний непрерывный ряд швов создают синтетической рассасывающейся нитью № 3/0, тогда как наружный ряд отдельных узловых швов делают шёлком № 3/0. Соустье прикрепляют к отверстию в брыжейке ободочной кишки со стороны желудка, чтобы исключить образование внутренней грыжи, в которой могут ущемиться петли тонкой кишки.
Следующую петлю тощей кишки проводят наверх через отдельное отверстие в брыжейке поперечной ободочной кишки. Выполняют холецистэктомию, если она не была сделана ранее. Пересекают общий желчный проток и прошивают дистальный конец желчного дерева. После этого выполняют гепатикоеюностомию «конец в бок» одним рядом одиночных узловых швов синтетической рассасывающейся нитью № 4/0. Эта петля должна быть не меньше 45 см длиной.
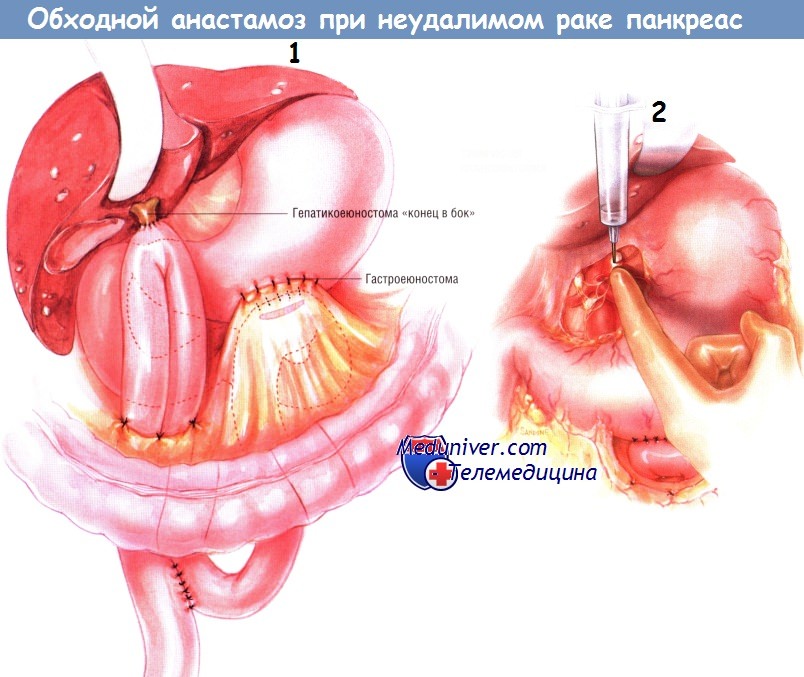
В её основании, между приводящей и отводящей кишками, делают анастомоз «бок в бок», расположенный ниже отверстия в брыжейке ободочной кишки. Внутреннюю линию швов этого соустья делают рассасывающейся синтетической нитью № 3/0, а наружную — одиночными узловыми шёлковыми швами № 3/0. Обе (приводящую и отводящую) ветви кишечника прикрепляют к отверстию в брыжейке поперечной ободочной кишки и друг к другу серией одиночных узловых швов шёлком № 4/0.
Химическая спланхнэктомия — рутинный этап данной операции. Её выполняют, инъецируя 20 мл 50% спирта по бокам от аорты на уровне чревного ствола. В результате происходит перерыв чревных нервов, идущих к чревному сплетению. Результаты химической спланхнэктомии были оценены в проспективном рандомизированном двойном слепом исследовании и свидетельствуют о том, что она уменьшает боли или предупреждает их возникновение в последующем.
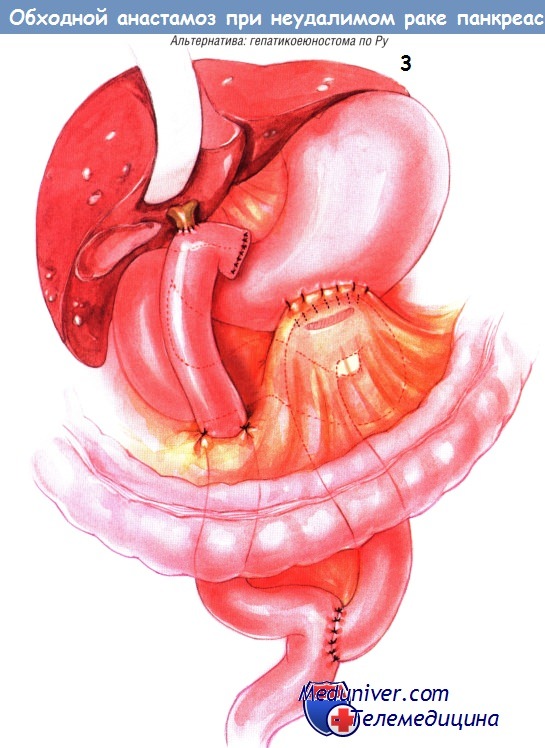
Альтернативный способ создания двойного обходного соустья — создание У-образного анастомоза по Ру дистальнее гастроеюностомы. Целостность пищеварительного тракта восстанавливают еюноеюностомией «бок в бок», её внутренний шов — непрерывный, из рассасывающегося синтетического материала, а наружный — из одиночных узловых швов шёлком № 3/0. Бранша анастомоза по Ру должна быть около 60 см длиной. Повторим вновь, что выполняют холецистэктомию и пересечение общего желчного протока. Дистальный отдел протока прошивают и перевязывают.
Гепатикоеюноанастомоз «конец в бок» выполняют одним рядом одиночных узловых швов синтетической рассасывающейся нитью № 4/0. Браншу анастомоза по Ру подшивают к отверстию в брыжейке поперечной ободочной кишки одиночными швами шёлком № 4/0.
— Также рекомендуем «Показания для дистальной панкреатэктомии при раке поджелудочной железы»
Источник
Ниже дан краткий обзор радикальных и паллиативных вмешательств при раке ПЖ.
В настоящее время хирургическое лечение остается единственно эффективным методом, однако опухоль можно удалить только на ранних стадиях (до 15% опухолей головки ПЖ), а операционный риск чрезвычайно высок. Радикальную операцию можно выполнить всего лишь у 1 — 5% больных, что обусловлено, в первую очередь, поздней диагностикой.
Выделяют следующие радикальные операции: гастропанкреатодуоденальная резекция, панкреатэктомия, дистальные комбинированные резекции ПЖ, расширенная субтотальная и тотальная панкреатодуоденэктомия. Радикальные операции технически очень сложны, их могут выполнить только высококвалифицированные хирурги в крупных центрах. Летальность после этих операций составляет от 27% при дистальной резекции ПЖ — до 17—39% при расширенной панкреатэктомии, пятилетняя выживаемость не превышает 8%. Последний факт обусловлен, прежде всего, тем, что у 50% больных в послеоперационном периоде возникает рецидив опухоли и в 90—95% случаев на первом году после операции развиваются отдалённые метастазы.
Существует мнение, что панкреатодуоденальную резекцию необходимо выполнять во всех случаях при подозрении на рак ПЖ даже без гистологической или цитологической верификации. Данное мнение отчасти обусловлено тем, что даже при лапаротомии и интраоперационном гистологическом исследовании частота ложноотрицательных ответов превышает 10%.
Перед операцией можно лишь предварительно судить о возможности удаления опухоли. Окончательное решение принимают после интраоперационного осмотра органов брюшной полости при исключении отдалённых метастазов и местной распространённости процесса. Наиболее часто во время операции обнаруживают такую причину нерезектабельности опухоли, как опухолевая инфильтрация забрюшинной клетчатки, включая нервные сплетения и поражение метастазами регионарных лимфатических узлов.
Панкреатодуоденальная резекция — основной тип радикальной операции при расположении опухоли в головке ПЖ. Нельзя её выполнить при прорастании опухолью нижней полой вены, аорты, верхней брыжеечной артерии и воротной вены. Для принятия окончательного решения следует отделить ДПК и головку ПЖ от подлежащих нижней полой вены и аорты, что позволяет судить и о вовлечённости верхней брыжеечной артерии; важна также оценка возможности диссекции воротной вены и верхней брыжеечной вены.
Удалённый при панкреатодуоденальной резекции анатомический препарат состоит из общего желчного протока, жёлчного пузыря, головки, шейки и секреторной части ПЖ, ДПК, проксимальной части тощей кишки, малого и части большого сальника, дистальной половины желудка. Кроме тою, иссечению подлежит паракавальная клетчатка, удаляют супрапилорические, инфрапилорические, передние и задние панкреатодуоденальные лимфатические узлы, лимфатические узлы гепатодуоденальной связки и по ходу общей печёночной артерии. Иссекают верхнюю брыжеечную вену (при изолированном опухолевом её поражении) или место се слияния с воротной веной. Такая лимфодиссекция улучшает прогноз, в то время как травматичность вмешательства увеличивается незначительно.
Простое перечисление удалённых органов свидетельствует о сложнейшей технике вмешательства. Ведь хирургу ещё предстоит выполнить серию восстановительных манипуляций — панкреатоностомию, билиодигестивный анастомоз (см. рис. 5-21), гастроеюностомию и межкишечный анастомоз. Средняя продолжительность операции составляет 6,5—7 ч.

Рис. 5-21. Стандартная панкреатодуоденальная резекция (операция Уиппла). Схема. В ходе операции удаляют общий жёлчный проток, жёлчный пузырь, двенадцатиперстную кишку, антральный отдел желудка, головку и часть тела поджелудочной железы: а — линии резекции; б — картина после резекции и перед реконструкцией (А-А — панкреатоеюноанастомоз, В-В — холедохоеюноанастомоз, С-С — гастроеюноанастомоз); в — состояние после резекции
Важны три технических приёма во время выполнения панкреатодуоденальной резекции — объём резекции паракавальной клетчатки и забрюшинной сосудистой диссекции, а также сохранение пилорического отдела желудка.
Особое внимание резекции паракавальной клетчатки уделяют потому, что именно в этой зоне чаще всего возникают рецидивы опухоли. Резекцию сосудов осуществляют при изолированном опухолевом поражении верхней брыжеечной вены или места её соединения с воротной веной. Прорастание верхней брыжеечной артерии чаще всего сопровождается обширным метастазированием в забрюшинные лимфатические узлы, что исключает возможность удаления опухоли.
Существуют мнения, что необходимо удалять узлы чревного сплетения, что позволяет существенно уменьшить выраженность болевого абдоминального синдрома в послеоперационном периоде, особенно в поздние сроки, когда заболевание прогрессирует.
Сохранение пилородуоденального сегмента при панкреатодуоденальной резекции улучшает пищеварительные функции и способствует более быстрому восстановлению массы тела больных.
Важно выявить зону первичного расположения опухоли в ПЖ, в первую очередь для исключения периампуллярных и ампулярных аденокарционом, имеющих значительно лучший прогноз.
Результаты стандартной панкреатодуоденальной резекции во многих больницах неудовлетворительные.
Послеоперационная летальность состав.ляет 12,3%, 1 год проживает 43,1% больных, средняя выживаемость больных составляет 15,5 мес, пятилетняя выживаемость не превышает 3,5—16.7%.
Неудовлетворительные отдалённые результаты, высокая послеоперационная смертность и техническая сложность панкреатодуоденальной резекции послужили основанием для отказа от радикальных вмешательств при раке ПЖ. Однако следует помнить, что репрезентативность результатов сравнительных исследований, проводимых в разных странах, может быть неодинаковой ввиду различий в диагностических критериях и подходах к стадированию рака ПЖ. В частности, в Японии применяют собственную классификацию опухолей ПЖ, отличающуюся от применяемых в США и Европе.
Выживают после гастропанкреатодуоденальной резекции лишь те больные, у которых по данным гистологического исследования послеоперационного материала по краям резекции нет опухолевых клеток. Напротив, в случаях их обнаружения больные живут приблизительно столько же, сколько больные после химиолучевого лечения.
При подтверждённом раке ПЖ выполняют ещё более объёмные операции — тотальную панкреатэктомию и расширенную панкреато-дуоденалъную резекцию. Необходимость в панкреатэктомии обусловлена важностью удаления мультифокальных очагов рака в ПЖ и более радикальным иссечением регионарных лимфоузлов (лимфатических узлов корня селезёнки, вокруг хвоста ПЖ). Несмотря на расширенный объём операции, показатели послеоперационной летальности сократились, однако отдалённые результаты от расширения объёма операции не улучшились, преимущественно за счёт развития тяжёлого сахарного диабета.
Расширенная панкреатодуоденальная резекция предусматривает удаление сегмента воротной вены и вовлечённых в опухолевый процесс артерий с реконструкцией сосудов. Кроме того, удаляют забрюшинные лимфатические узлы от чревной артерии до бифуркации подвздошных артерий. Разработчик техники этой операции Фортнер добился уровня отдалённой выживаемости 20% при послеоперационной летальности 23%.
При нерезектабельной опухоли, наличии или угрозе возникновения желтухи, гастродуоденальной непроходимости, если предполагаемая продолжительность жизни больного составляет более 6—7 мес, производят паллиативные вмешательства, в частности наложение билиодигестивного и гастроеюнального шунта (см. рис. 5-22).

Рис. 5-22. Паллиативные вмешательства при нерезектабельном раке поджелудочной железы. Схема: а — наложение обходного холецистоеюноанастомоза. В подавляющем большинстве случаев больные хорошо переносят операцию, несмотря на выраженную желтуху у ряда из них. Вмешательство обеспечивает достаточный отток жёлчи в кишку и уменьшение (или снижение выраженности) желтухи; б — другой тип обходного билиодигестивного анастомоза, который накладывают при угрозе прорастания опухоли в пузырный проток; в — гастроеюностомия; показана при блокировании опухолью двенадцатиперстной кишки
При предполагаемой продолжительности жизни 1-2 мес показано эндоскопическое введение стента в жёлчные протоки. Установка эндопротеза вместо хирургического шунтирования (холедоходуоденостомии и гастроэнтеростомии) подходит больным с тяжёлыми сопутствующими заболеваниями и липам старческого возраста. Она позволяет уменьшить число осложнений и смертность. Использование новых стентов из металлической сетки даст возможность увеличить продолжительность их нахождения в протоках и снизить частоту возникновения холангита. Рецидивирование желтухи после установления стента чаще всего связано с его обтурацией вследствие сладжа жёлчи; в этом случае проводят замену стента.
Предоперационное дренирование жёлчных протоков с целью уменьшения холестаза не приводит к увеличению продолжительности жизни больных. Недавно описана методика дренирующих малоинвазивных операций с целью декомпрессии жёлчевыводяших путей с помощью ЭУС, позволяющей более точно произвести стентирование.
Пример паллиативной операции — введение спирта (50 мл) или фенола в зону чревного сплетения дая купирования болевого абдоминального синдрома. Такой подход позволяет уменьшить боли или даже купировать их на короткое время, однако у 2/3 пациентов болевой синдром рецидивирует в течение месяца. Блокаду чревного сплетения можно выполнять повторно, однако эффективность следующих процедур более низкая. Тем не менее блокада чревного сплетения более эффективна, чем применение наркотических анальгетиков в сроки до 6 нед.
Появление методики нейролизиса чревного сплетения с использованием ЭУС повысило эффективность вмешательства ввиду большой точности определения зоны введения спирта. Боль проходит у 52% пациентов, а у 30% удаётся уменьшить суточные дозы наркотических анальгетиков.
Существуют указания об эффективности торакоскопической сплапхнэктомии в лечении болевого абдоминального синдрома. Для улучшения результатов хирургического лечения его дополняют химио-и лучевой терапией. Применяют эти методы не только после операции, но и интраоперапионно (введение в воротную вену или печёночную артерию фторурацила, митомицина). Возможны различные схемы комбинации лучевой, химиотерапии и хирургического лечения, введение препаратов в ткань опухоли под контролем ЭУС.
В последние годы всё чаще применяют трансплантацию ПЖ, селективную трансплантацию островковых и ацинарных клеток, что позволяет существенно улучшить качество жизни больных после панкреатэктомии по поводу ранних стадий негенерализованного рака ПЖ.
Маев И.В., Кучерявый Ю.А.
Опубликовал Константин Моканов
Источник
Опухоль занимает третье место в структуре злокачественных опухолей органов пищеварительной системы, уступая по частоте лишь раку желудка и колоректальному раку. Среди причин смерти от онкологических заболе ваний он занимает у мужчин четвертое, а у женщин пятое место. Ежегодно в США регистрируют около 28 000 новых случаев рака поджелудочной же лезы. К 90-м годам двадцатого столетия частота этого заболевания в странах Северной Америки и Европы выросла по сравнению с 30-ми годами более чем в 2 раза. В России заболеваемость раком поджелудочной железы состав ляет 8,6 на 100 000 населения. Рак поджелудочной железы наиболее часто регистрируют на 6—8-м десятилетии жизни. Мужчины страдают в 1,5 раза ча ще, чем женщины . В этиологии рака поджелудочной же лезы имеет значение ряд факторов: ку рение, алкоголизм, хронический панкреатит (в особенности кальцифици- рующий панкреатит), чрезмерное упот ребление жареного мяса, животных жи ров, кофе, сахарный диабет, алиментарно-конституциональное ожирение, эк зогенные канцерогены, отягощенная наследственность, мутации гена р53 и онкогена K-ras. Необходимо отметить, что среди всех известных онкогенов, которые контролируют рост клеток, мутация одного гена из семейства K-ras обнаруживается более чем у 95 % больных аденокарциномой поджелудочной железы. Столь высокий уровень мутации ранее не был выявлен ни при одном другом виде злокачественных опухолей. Возможно, что данный способ генетического исследования (панкреатический сок больных) займет важное место в ранней диагностике рака поджелудочной железы, особенно у лиц с семейной формой заболевания.
Патологоанатомическая картина. Рак поджелудочной железы у подавляющего большинства больных (около 80 %) локализуется в головке органа, гораздо реже — в теле и хвосте железы. Еще реже наблюдают мультицентрическую локализацию опухоли, а также диффузный рак, поражающий всю поджелудочную железу. Опухоль в 80—90 % развивается из эпителия вывод ных протоков поджелудочной железы и имеет строение аденокарциномы различной степени дифференциации. При морфологическом исследовании обнаруживают также опухоль, исходящую из ацинарных клеток (ацинарная аденокарцинома) и плоскоклеточный рак. Метастазирует рак поджелудочной железы наиболее часто в забрюшинные лимфатические узлы и в лимфатические узлы, расположенные в печеночно-двенадцатиперстной связке. Гематогенное метастазирование проис ходит в печень, легкие, почки, надпочечники, кости.
Клиническая картина и диагностика. Клинические проявления заболева ния зависят от размеров новообразования и его локализации. Рак головки поджелудочной железы в ранней стадии протекает бессимптомно или проявляется общими расстройствами — слабостью, повышенной утомляемостью, диспепсическими явлениями, тяжестью в животе. Иногда возникает понос, свидетельствующий о нарушениях внешнесекреторной функции поджелудочной железы. Позднее появляются боли в животе, постоянные, тупые, локализующиеся в эпигастральной области или правом подреберье. Нередко они иррадиируют в спину, поясницу, имеют опоясывающий характер (особенно часто при прорастании опухоли в чревное нервное сплете ние). Перечисленные симптомы являются неспецифичными, обычно расцениваются как проявление хронического панкреатита или остеохондроза позвоночника. У многих больных первым и зачастую единственным симптомом рака головки поджелудочной железы является механическая желтуха, развивающаяся без предшествующего приступа острых болей в животе. Желтуха постепенно прогрессирует и сопровождается интенсивным кожным зудом. Менее чем у трети больных раком головки поджелудочной железы отмечаются боли в животе, а первым симптомом болезни является механическая желтуха. У больных с распространенным раком наблюдаются симптомы дуоденальной непроходимости, обусловленные компрессией вертикального, реже — нижнегоризонтального участка двенадцатиперстной кишки. Опухоли в теле или в хвосте из-за отсутствия клинических проявлений болезни обнаруживаются в поздней стадии, когда возникают интенсивные боли в эпигастральной области или в спине. Они усиливаются в положении больного лежа на спине и ослабевают в положении сидя или в согнутом вперед положении. При сдавлении опухолью селезеночной вены иногда наблюдают ее тромбоз, что клинически проявляется спленомегалией, реже — варикозным расширением вен пищевода (кровотечение при их разрыве) в связи с развитием регионарной портальной гипертензии. У 15—20 % больных с распространенными формами рака отмечаются клинические и лабораторные признаки впервые выявленного сахарного диабета. Иногда первым клиническим признаком рака поджелудочной железы, особенно у пожилых больных, является приступ острого панкреатита без каких-либо очевидных провоцирующих факторов.
При объективном исследовании больных раком головки поджелудочной железы довольно часто (примерно у 30—40 % пациентов) выявляют гепатомегалию и удается пропальпировать дно желчного пузыря. При механической желтухе наблюдается симптом Курвуазье. Асцит свидетельствует о запущенности опухолевого процесса и невозможности выполнения радикальной операции. У больных раком дистальных отделов поджелудочной железы данные объективного исследования малоинформативные, и лишь при запущенных новообразованиях можно пропальпировать опухоль или опухолевый инфильтрат и нередко обнаруживать асцит и спленомегалию. В рутинных анализах крови у больных с ранними формами рака подже лудочной железы обычно не выявляют каких-либо отклонений от нормы. В поздних стадиях можно обнаружить ускорение СОЭ, умеренную анемию. В биохимическом анализе крови обычно определяется гипопротеинемия, гипоальбуминемия, а у больных с механической желтухой — гипербилирубинемия, повышение уровня щелочной фосфатазы и трансаминаз, причем щелочная фосфатаза повышается в большей степени, чем трансаминазы. Значительно более информативным является определение уровня опухо левых маркеров в крови. Из всех известных маркеров наиболее чувствитель ным и специфичным (около 90 %) при раке поджелудочной железы является карбоангидратный гликопротеин (СА-19-9) эмбрионального происхож дения. У здоровых лиц его содержание в крови не превышает 37 ЕД, в то время как при раке поджелудочной железы этот показатель возрастает в десятки, а иногда и в сотни и тысячи раз. К сожалению, уровень СА-19-9 при раннем раке железы обычно не повышен, что существенно ограничивает применение данного метода в скрининговом исследовании на предмет вы явления ранних форм рака поджелудочной железы, даже у больных, входящих в группу риска. В последнее время появились сообщения о высокой степени информативности метода определения антигена СА 494 в крови при ранней диагно стике рака поджелудочной железы и особенно при дифференциальной диагностике с хроническим панкреатитом. Основное место в диагностике принадлежит инструментальным методам исследования. Рентгенологическое исследование с контрастированием желудка и две надцатиперстной кишки позволяет выявить только ряд косвенных симптомов рака поджелудочной железы, обусловленных давлением опухоли на соседние органы: деформацию и смещение желудка кпереди, смещение и развертывание «подковы» двенадцатиперстной кишки, сдавление ее нисходящей ветви с дефектом наполнения по внутреннему контуру. При значительных размерах рака тела поджелудочной железы рентгенологически можно выявить смещение малой кривизны желудка с утолщением и инфильтрацией складок слизистой оболочки в этой области, смещение и сдавление тощей кишки в области связки Трейтца. Однако эти рентгенологические данные являются поздними признаками рака поджелудочной железы. Рентгенологическое исследование позволяет обнаружить стеноз двенадцатиперстной кишки. Наиболее информативными из инструментальных методов исследования являются ультразвуковое исследование, компьютерная и магнитно-резонансная томография. Чувствительность последних двух методов несколько выше ультразвукового. Для верифика ции диагноза производят тонкоигольную пункционную биопсию новооб разования под контролем ультразвукового исследования или компьютерной томографии.
При этом у 90—95 % больных удается получить морфологическое подтверждение диагноза. В последние годы опухоли поджелудочной железы диагностируют, применяя эндоскопическое ультразвуковое исследование. При этом миниатюрный ультразвуковой датчик располагается на дистальном конце эндоскопа. Помещая его в просвете желудка или двенадцатиперстной кишки над различными отделами поджелудочной железы за счет минимального расстоя ния между датчиком и новообразованием удается выявить опухоли размером менее 1 см, что обычно невозможно при рутинном УЗИ и КТ. Чувствительность эндоскопического ультразвукового исследования в диагностике рака поджелудочной железы достигает 90 % и более. Весьма ценным способом диагностики рака поджелудочной железы является ретроградная панкреатохолангиография, при которой удается обнаружить стеноз или «ампутацию» главного панкреатического протока. Однако на основании данного способа исследования бывает довольно трудно отдифференцировать злокачественную опухоль от хронического панкреатита. У больных с протоковым раком весьма эффективным является цитологическое исследование аспирата из вирсунгова протока. Если же при ком пьютерной или магнитнорезонансной томографии удается выявить новообразование, а тем более верифицировать диагноз с помощью чрескожной пункции, необходимость выполнения данного исследования отпадает. При менявшаяся ранее селективная ангиография (целиакография и верхняя ме- зентерикография), при которой обнаруживают изменения архитектоники сосудов поджелудочной железы, появление зон гиперваскуляризации за счет вновь образованных сосудов, в настоящее время применяется редко. Это связано с гораздо более высокой информативностью неинвазивных инструментальных способов исследования
Дифференциальная диагностика. Дифференциальный диагноз следует проводить с заболеваниями желчевыводящих путей (холедохолитиаз, стриктура большого дуоденального сосочка, опухоли внепеченочных желчных протоков), доброкачественными опухолями поджелудочной железы, хроническим панкреатитом. Ведущая роль при этом отводится инструментальным методам исследования, их сочетанию с чрескожной биопсией патологиче ского очага в ткани железы. Следует отметить, что клиническая картина, а зачастую и данные инструментальных методов исследования при раке го ловки поджелудочной железы, двенадцатиперстной кишки, большого дуоденального сосочка и терминального отдела общего желчного протока весь ма схожи. Даже во время интраоперационной ревизии иногда не удается ус тановить первичную локализацию опухоли. В связи с этим данная группа новообразований, особенно при ранней стадии заболевания, обычно объединяется под термином «периампулярные опухоли». Это вполне объяснимо, так как хирургическая тактика единообразна и заключается в выполнении панкреатодуоденальной резекции.
Лечение. На ранних стадиях заболевания применяют радикальные операции, на поздних — паллиативные. Выбор метода операции зависит от лока лизации опухоли и ее размеров.
При раке головки поджелудочной железы
выполняют панкреатодуоденальную резекцию: удаляют головку и часть тела поджелу дочной железы, двенадцатиперстную кишку и 10—12 см начального отдела тощей кишки, антральныи отдел желудка, желчный пузырь и резецируют общий желчный проток, примерно на уровне впадения в него пузырного протока. Необходимо также удалить забрюшинные лимфатические узлы, а также лимфатические узлы, расположенные по ходу печеночно-двенадца- типерстной связки. У больных с небольшими опухолями стремятся сохра нить антральный отдел желудка и привратник. Реконструктивный этап операции предусматривает формирование панкреатоеюнального, холедохоеюнального и гастроеюнального анастомозов. К сожалению, резекта- бельность при раке головки поджелудочной железы составляет не более 20 % в связи с местным распространением опухоли и наличием отдален ных метастазов. Послеоперационная летальность составляет в среднем 10—15 %. В специализированных хирургических центрах этот показатель не превышает 5—8 %. Отдаленные результаты панкреатодуоденальной резекции также малоутешительны. Пятилетняя переживаемость обычно не превышает 3—8 %.
При раке головки и тела поджелудочной железы,а так же диффузном раке железы показана тотальная панкреатодуоденэктомия. Операция заключается в удалении всей поджелудочной железы, двенадца типерстной кишки, антрального отдела желудка, дистальной части общего желчного протока, селезенки и регионарных лимфатических узлов. Опера цию завершают наложением двух анастомозов — холедохоеюноанастомоза и гастроеюноанастомоза. Операция неизбежно приводит к развитию тяжелого сахарного диабета, плохо поддающегося инсулинотерапии, а отдаленные результаты операции панкреатэктомии значительно хуже, чем при панкреатодуоденальной резекции. В связи с этим данный тип вмешательства применяется редко.
При раке тела и хвоста поджелудочной железы выполняют левостороннюю (дистальную) резекцию органа в сочетании со спленэктомией. Культю проксимальной части поджелудочной железы ушивают наглухо. К сожалению, опухоли этой локализации обычно выявляют в запущенной стадии, когда радикальное хирургическое лечение невыполнимо. Отдаленные результаты дистальной резекции поджелудочной железы также малоутешительны. Средняя продолжительность жизни оперированных больных — около 10 мес, 5-летняя переживаемость — 5—8 %. Рентгенотерапия в комбинации с химиотерапией несущественно продливает жизнь как оперированных пациентов, так и при их изолированном применении у неоперабельных больных.
Паллиативные операции при неоперабельных формах рака поджелудочной железы применяют для устранения обтурационной желтухи и непроходимости двенадцатиперстной кишки. Наиболее распространенны ми паллиативными билиодигестивными операциями являются операции холецисто- и холедохоеюностомии на выключенной по Ру петле тощей кишки. При резком сужении опухолью просвета двенадцатиперстной кишки мо жет возникнуть необходимость в гастроэнтеростомии для обеспечения эва куации желудочного содержимого в тонкую кишку. Не менее эффективным, но менее травматичным способом декомпрессии желчных путей является наружная холангиостомия, выполняемая под контролем УЗИ или КТ, а также эндопротезирование терминального отдела общего желчного протока с помощью пластиковых или металлических протезов, вводимых чреспеченочно в просвет общего желчного протока и далее через его суженный участок в двенадцатиперстную кишку. Средняя продол жительность жизни больных после различных типов паллиативных вмеша тельств составляет около 7 мес. Современные методы полихимиотерапии и лучевое лечение лишь незна чительно увеличивают продолжительность жизни пациентов.
Источник



