Семейный рак поджелудочной железы
В последние годы стало укрепляться мнение, что рак — генетическая болезнь, производная от геномных изменений и характеризующаяся клеточной пролиферацией с дифференциацией и изменениями в регулирующих молекулярных факторах. Геномная неустойчивость, аллельная потеря некоторых хромосом, инактивация генов-супрессоров опухоли или активация определённых онкогенов, как предполагают, играют непосредственную роль в неопластической прогрессии.
В настоящее время выделены три класса генов, ответственных за опухолеобразование: онкогены, гены опухолевой супрессии (tumor suppressor genes) и гены, ответственные за исправление дефектов репликации ДНК (MMR — mismatch repair genes).
• Онкогены в норме ответственны за контроль клеточной пролиферации. В случае когда эти гены претерпевают видоизменение, теряется контроль, что сопровождается безудержным ростом клеток и, как следствие, формированием опухоли.
• Функция генов-супрессоров опухоли заключена в подавлении активности роста на клеточном уровне и для её потери необходимо наличие мутации в обеих аллелях гена. В случае наследования гена с одной мутированной аллелью клиническая манифестация заболевания происходит гораздо быстрее по сравнению со спорадическими случаями.
• Система MMR контролирует вновь сформированную ДНК и призвана исправлять ошибки её репликации. Дефект гена MMR ассоциируют с так называемым мутированным фенотипом. Элементы мутаций в обеих копиях гена MMR способствуют аккумуляции ошибок ДНК по всему геному, затрагивая большинство регулирующих генов, в том числе такие, как гены, преобразующие рецепторы трансформирующих факторов роста.
Недавние исследования выявили несколько молекулярных процессов, реализующих патогенез рака ПЖ (табл. 3-1). В 70% случаев выявляют мутации гена опухолевой супрессии р53, в 60—100% случаев — мутации в 12-м кодоне онкогена K-ras (табл. 3-2), кодирующего G-белок, гомологичный эпидермал ьному и трансформирующему факторам роста.
Недавно описаны мутации в кодонах 13 и 61, которые также приводят к аминокислотной замене в K-ras белке. Столь высокая распространённость мутации K-ras до настоящего момента не идентифицирована при других опухолях у человека, что предполагает определённую специфичность этой мутации для рака ПЖ.
Таблица 3-1. Частота мутаций различных генов при раке поджелудочной железы

Таблица 3-2. Частота мутации гена K-ras у больных с различной степенью дифференцировки протоковой аденокарциномы поджелудочной железы

Как известно, G-белок участвует в передаче сигнала к делению клетки от ростовых факторов к генам, ответственным за клеточную пролиферацию. До 85% точечных мутаций затрагивают кодон 12, в то время как остальные происходят в 13-м и 16-м кодонах гена.
При анализе 12-го кодона в первой или второй базе у больных с K-ras мутацией выявлены нуклеотидные замены, в частности, GGT (глицин) —> GTT (валин); GGT (глицин) —> AGT (серии); GGT (глицин) —> GAT (аспарагиновая кислота) или GGT (глицин) —> CGT (аргинин), что может предшествовать развитию злокачественного процесса.
Аминокислотная замена в 12-ом или 61-ом кодонах ослабляет гуанинтрифосфорная кислота (ГТФ)-азную активность белка, в результате чего создастся эффект постоянного проведения внутриклеточного сигнала. Замена глицина 13 приводит к увеличению скорости обмена нуклеотидов в комплексе р21- гуанинтрифосфорная кислота/гуаниндифосфорная кислота. Поскольку в клетке концентрация гуанинтрифосфорной кислоты выше, чем гуаниндифосфорной кислоты, подобная мутация также придаёт белку трансформирующие свойства.
Следует отметить, что мутации K-ras онкогена встречают не только в опухоли, но и в прилежащих к ней клетках, а также при ХП в зонах гиперплазии эпителия протоков. Последний факт косвенно подтверждает взаимосвязь ХП и рака ПЖ, поскольку мутация гена K-ras проявляется проопухолевым действием. В этом свете становится понятно, почему при НП значительно повышен риск развитая рака ПЖ.
Медиана выживаемости у больных раком ПЖ при наличии мутации K-ras составляет 8,2 мес (в 1,5 раза меньше, чем при её отсутствии). Что позволяет использовать диагностику этой мутации с прогностической целью.
Мутации генов р53, р 16 и DPC 4 супрессоров опухолевого роста приводят к несостоятельности функции этих генов и потенцированию неопластических процессов за счёт нарушений в процессе деления клеток.
Одним из наиболее изученных генов-супрессоров опухоли является ген р53. Он расположен на хромосоме 17р13.1. Продукт гена представляет собой полифункциональный белок, основная роль которого заключена в обеспечении экстренного удаления повреждённых и потенциально опасных для организма человека клеток. В норме он вызывает остановку деления повреждённой клетки с целью исправления ДНК (действует как ДНК зависимый транскрипционный активатор на переходе от G1 к S фазе), а в ряде случаев при невозможности исправления повреждения приводит к апоптозу и гибели этой клетки, что позволило образно назвать ген р53 «стражем генома». Таким образом, индукция гена р53 приводит к задержке клеточного цикла или апоптозу, мутация же гена р53 при длительном воспалительном процессе приводит к ингибированию апоптоза.
Нарушается природный антагонизм генов, регулирующих апоптоз (р53 и bcl2, c-fos, c-myc), которые реализуют свои ингибирующие эффекты через гиперпродукцию эпидермальных, тромбоцигарных и трансформирующих ростовых факторов. Извращается регенерация, усиленно пролиферируют генетические изменённые клетки, удлиняется общая продолжительность жизни клеток и увеличивается вероятность возникновения в них изменений. Всё это в конечном итоге способствует преднеопластической, а затем и неопластической пролиферации. Кроме того, процент выживаемости значительно снижен по сравнению с пациентами, у которых эти мутации не выявляются.
Среди мутаций р53 наиболее часто выявляют точечные в 4—10 экзонах и частичные делеции гена. В 50-75% случаев рака ПЖ обнаруживают повреждение обоих аллелей гена. В целом дефекты гена р53 приводят к ослаблению контроля клеточной пролиферации, снижению дифференцировки клеток и укорочению сроков жизни больных этой формой рака.
Ген-супрсесор р16 инактивируется достаточно часто при различных типах опухолей. Белок, продукт функционирования гена, выступает ключевым членом семейства ингибиторов циклинзависимых киназ, являющихся негативными регуляторами сигнального пути CDK-RB-Е2Е, ответственного за реализацию программы клеточного цикла. Ген р16 инактивируется почти в 80% спорадических аденокарцином ПЖ, причём частота гомозиготных делений этого гена достигает 41%.
Ген deleted in pancreatic carcinoma 4 (DPC 4) / SMAD 4, или ген, «уничтожающий рак поджелудочной железы», локализован на 18-й хромосоме (18q21.1) и кодирует транскрипционный фактор, опосредующий действие трансформирующего фактора роста и гена р16. Наличие мутаций этого гена часто встречают не только у больных раком ПЖ, но и при колоректальном раке, раке желудка и эндометрия, что получило название семейного ракового синдрома.
Ген-супрессор DPC 4 биаллельно инактивируется почти в 50% карцином ПЖ; в 30% случаев обнаруживают гомозиготные делеций, в 20% — гетерозиготные делеций и точечные мутации в другом аллеле.
Мнение, что рак ПЖ имеет генетически детерминированный характер, косвенно подтверждают наличием часто наблюдаемой ассоциации рака ПЖ с другими генетическими синдромами — семейным аденоматозным полипозом, наследственным ненолипозным колоректальным раком (hereditary nonpolyposis colorectal cancer — синдром HNPCC), семейным раком молочной железы (мутации гена BRCA2), синдромом Peutz—Jeghers (мутация гена STR11) и семейной атипичной множественной меланомой (FAMMM синдром). Рак ПЖ часто развивается при наличии у пациента хотя бы двух родственников с одним из вышеуказанных заболеваний. Если рак ПЖ был у двух ближайших родственников, то риск его развития возрастает в 3—18 раз, а если у грех, то в 56—57 раз.
Синдром Pentz—Jeghers — заболевание, наследуемое по аутосомнодоминантному типу с вариабельной пенетрантностью, характеризуется фенотипической пигментацией кожи и слизистых и развитием гамартоматозных полипов ЖКТ. У больных с данным синдромом отмечают чрезвычайно высокий риск онкологической гастроинтестинальной патологии, в том числе и рака ПЖ. Мутации STK11 / LKB1 (LKB1) гена, который кодирует серинтреонинкиназу, были идентифицированы как генетическая причина синдрома Peutz—Jeghers. Молекулярный анализ LKBI гена показал замену цитозина на гуанин в 246-й кодоне 6-го экзона, что привело к Туr246Х мутации,
Нуклеотидная замена приводит к преждевременной остановке кодона 246, образуется неполноценный «обрезанный» белок, предположительно потерявший киназную активность. Наличие синдрома Peutz—Jeghers повышает риск развития рака ПЖ в 132 раза.
Другим возможным геном-кандидатом, повреждения которого могут вызвать рак ПЖ, считают ген-супрессор breast cancer 2 gene (BRCA 2). Потеря гетерозиготности и гомозиготные делении по этому гену, расположенному в длинном плече 13-йхромосомы (I3ql2.1), обнаруживают в 20—25% спорадических опухолей, при этом только 2% из них считают наследуемыми. Наличие мутации гена BRCA2 в 3,5-10 раз повышают риск развития рака ПЖ
Синдром FAMMM вызывает наследуемая мутация гена р16, в 9р хромосоме и характеризуется множественными невусами, в том числе атипическими, множественной меланомой. Синдром повышает риск развития рака ПЖ в 20—34 раза, частота ассоциации с раком ПЖ достигает 40%. Изучение возможности наследования мутаций гена р1б, показало, что наследственные формы рака ПЖ, сочетающиеся с мутацией р1б достигают 5% от всех аденокарцином ПЖ, при этом у больных имеется и высокий риск развития меланомы.
Синдром HNPCC характеризуется повышенным риском колоректального рака, рака эндометрия, желудка, яичников, тонкой кишки и ПЖ. Синдром HNPCC вызывают наследуемые мутации в одном из MMR генов (особенно hMLHl и hMSH2), что приводит к микросателлитной нестабильности (одному из признаков дефекта репликации ДНК).
На роль ещё одною наследственного заболевания, приводящего к раку ПЖ, претендует НП (доминантные мутации PRSS1), в то время как наличие других мутаций, способных потенцировать развитие ХП (SPINK 1 и CFTR), по всей видимости, не повышает риск рака ПЖ.
Однако, нельзя исключать, что среди большого количества носителей мутации N34S вероятен повышенный риск развития рака ПЖ, потому что носительство данной мутации уже может служить связующим звеном между длительно существующим ХП и раком ПЖ. В целом НП характеризуется высоким риском рака ПЖ, в первую очередь ввиду большой длительности заболевания; НП повышает риск развития рака ПЖ в 50—80 раз.
Таким образом, в структуре рака ПЖ можно отдельно выделить синдром семейного рака ПЖ, ассоциирующийся с другими генетическими синдромами, составляющий суммарно до 3% от всех случаев рака ПЖ. Именно поэтому анализ наследственного анамнеза помогает идентифицировать индивидуумов при увеличенном риске развивающегося рака ПЖ (табл. 3-3).
Таблица 3-3. Риск развития рака поджелудочной железы при различных наследственных синдромах

Однако остаётся не совсем понятным, почему одни и те же генетические изменения встречают как при ХП и НП, так и при раке ПЖ, и они в ряде случаев не приводят к развитию опухолевого процесса. Существует мнение, что имеется взаимосвязь между генотипом больных раком ПЖ и повышенной экспрессией протоонкогенов при раке ПЖ, определяющая механизмы взаимообусловленности этих процессов.
Генетические методы лечения наследственных заболеваний находятся в стадии разработки. В последние годы доминирует точка зрения, что селекция пациентов с одним из вышеуказанных наследственных синдромов при наличии ряда дополнительных факторов позволяет определить показания для проведения первичной профилактики рака ПЖ — выполнения панкреатэктомии.
Например, у пациентов с НП риск развития рака ПЖ возрастает от года к году; в то же время при достижении ими среднего и пожилого возраста экзо- и эндокринная недостаточность выражены настолько сильно, что пациенты нуждаются в постоянной инсулинотерапии, заместительной ферментной терапии. В этом случае риск и объём оперативного вмешательства могут быть оправданы. Аналогично у больных НП с выраженным болевым абдоминальным синдромом, вторичной наркотической зависимостью панкреатэктомия может быть предложена как альтернатива с целью радикального лечения болевого абдоминально-то синдрома и исключения риска рака ПЖ.
Пациентам с диагностированными наследственными синдромами, повышающими риск развития рака ПЖ, необходим тщательный диагностический скрининг, Таким больным необходимо регулярно выполнять ЭУС (раз в 3—6 мес). В том случае если информации недостатомно, в порядке исключения может быть выполнена ЭРХПГ. При наличии малейшего подозрения на появления образования в паренхиме ПЖ оно должно быть подвержено пункции под контролем ЭУС. В том случае если выявлено образование в ПЖ и есть сомнительные (неоднозначные) данные пункционной биопсии, необходимо проводить оперативное лечение в объёме панкреатэктомии с профилактической (а при подтверждении малигнизации и лечебной) целью.
Поскольку ЭУС позволяет выявлять образования в ПЖ, размером 1—2 см, своевременно проведённое оперативное лечение может быть радикальным. Результаты исследований показали, что подобная тактика весьма оправдана в группах с высоким риском рака ПЖ, поскольку многие прооперированные больные имели раннюю неинвазивную панкреатическую неоплазию, включая внутрипротоковую папиллярную муцинозную неоплазию. Таким образом, нанкреатэктомия у этих больных на стадии облигатного предракового состояния была методом радикальной профилактики рака ПЖ.
К сожалению, в настоящее время отсутствуют другие методики надёжного скрининга раннего рака ПЖ, поскольку определение онкомаркёров (СА 19-9) и некоторых мутаций ДНК в панкреатическом соке не обладают достаточной чувствительностью и специфичностью. Активное развитие протеоники (методики обнаружения новых опухолевых маркёров, специфичных для конкретной опухоли белков, в биологических жидкостях), возможно, приведёт к обнаружению новых, более специфичных тестов для широкомасштабного скрининга рака ПЖ в группах повышенного риска.
Маев И.В., Кучерявый Ю.А.
Опубликовал Константин Моканов
Источник
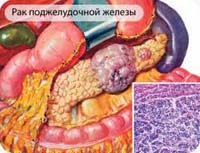
Рак поджелудочной железы – опухолевое поражение, исходящее из панкреатических протоков или паренхимы поджелудочной железы. Симптомы рака поджелудочной железы включают тошноту, потерю аппетита, боли в верхней части живота, нарушение функции кишечника, снижение массы тела, желтушное окрашивание склер и видимых слизистых оболочек. Для выявления рака поджелудочной железы используется лабораторная (определение биохимических показателей и онкомаркеров крови) и инструментальная диагностика (УЗИ, КТ, МРТ, ЭРХПГ). Радикальное лечение предполагает проведение резекции поджелудочной железы в различном объеме; возможно использование лучевого и химиотерапевтического лечения.
Общие сведения
В понятие «рак поджелудочной железы» входит группа злокачественных новообразований, развивающихся в паренхиме поджелудочной железы: головке, теле и хвостовой ее части. Основные клинические проявления этих заболеваний – боль в животе, анорексия, похудание, общая слабость, желтуха. Каждый год 8-10 человек на каждую сотню тысяч населения в мире заболевает раком поджелудочной железы. Более чем в половине случаев он возникает у лиц пожилого возраста (63% пациентов с диагностированным раком поджелудочной железы старше 70 лет). Мужчины более склонны к этому виду злокачественных образований, у них рак поджелудочной железы развивается в полтора раза чаще.
Злокачественная опухоль поджелудочной железы склонна к метастазированию в региональные лимфоузлы, легкие и печень. Непосредственное разрастание опухоли может вести к ее проникновению в двенадцатиперстную кишку, желудок, прилегающие отделы толстого кишечника.
Рак поджелудочной железы
Причины развития рака поджелудочной железы
Точная этиология рака поджелудочной железы не выяснена, но отмечают факторы, способствующие его возникновению. Однако в 40% случаев рак поджелудочной железы возникает без видимой причины. Заметно повышается риск развития рака у лиц, выкуривающих пачку и более сигарет ежедневно, употребляющий большое количество углеводсодержащих продуктов, перенесших операции на желудке.
К заболеваниям, способствующим возникновению рака поджелудочной железы, относятся:
- сахарный диабет (как первого, так и второго типа)
- хронический панкреатит (в том числе и генетически обусловленный)
- наследственные патологии (наследственная неполипозная колоректальная карцинома, семейный аденоматозный полипоз, синдром Гарднера, болезнь Гиппеля-Линдау, атаксия-телеангиэктазия)
Вероятность развития рака увеличивается с возрастом.
Классификация рака поджелудочной железы
Рак поджелудочной железы классифицируется по международной системе классификации злокачественных новообразований TNM, где T – размер опухоли, N – присутствие метастазов в региональных лимфоузлах, а M – метастазы в других органах.
Однако в данном случае классификация недостаточно информативна в отношении операбельности рака и прогноза эффективности терапии, поскольку значительную роль и перспективе излечиваемости играет общее состояние организма.
Симптомы рака поджелудочной железы
Рак поджелудочной железы сопровождается следующими клиническими проявлениями: боль в животе в области поджелудочной железы (верхняя половина, с иррадиацией в спину, иногда опоясывающая). С ростом опухоли болевой симптом усиливается. Для панкреатических болей характерно усиление ее при наклоне.
При локализации опухоли железистой ткани в области головки поджелудочной железы с подавляющем большинстве случаев отмечается желтуха, которая может сопровождаться кожным зудом, потемнением мочи и обесцвечиванием кала.
Еще одним частым симптомом злокачественной опухоли поджелудочной железы является снижение массы тела. При локализации опухоли в теле и хвосте железы похудание отмечают у всех больных, при раке головки поджелудочной железы масса тела снижается у 92% больных. Этот симптом связывают с нарушением всасывания жиров в кишечнике в результате недостаточности секторной функции поджелудочной железы.
В 64% случаев рака головки поджелудочной железы отмечается анорексия (при иных локализациях опухоли этот симптом отмечается только у 30% пациентов). При сдавлении крупной опухолью двенадцатиперстной кишки или просвета желудка может отмечаться рвота. Вторичный сахарный диабет развивается в 25-50% случаев и, как правило, сопровождается полиурией и полидипсией.
При локализации опухоли в теле или хвосте поджелудочной железы может отмечаться спленомегалия, варикозное расширение вен пищевода и желудка (с эпизодами кровотечений). Иногда клиническая картина протекает по типу острого холецистита или панкреатита. При поражении метастазами брюшины возможна непроходимость кишечника вследствие сужения просвета кишки.
Течение рака поджелудочной железы характеризуется постепенным нарастанием симптоматики, начиная от маловыраженного, слабого болевого синдрома до ярко выраженной разнообразной клиники. В случае своевременного обращения к врачу и раннего выявления опухоли прогноз лечения и дальнейшей выживаемости значительно улучшается.
Осложнения
Злокачественные образования поджелудочной железы осложняются:
- сахарным диабетом
- синдромом мальабсорбции
- расстройствами системы циркуляции желчи
- трофическими расстройствами вследствие нарушения секреторной функции поджелудочной железы.
Опухоль может прорастать в располагающиеся рядом органы – желудок, тонкий кишечник, толстую кишку. Крупные опухоли могут способствовать пережатию кишечника и непроходимости.
Диагностика рака поджелудочной железы
Диагностика рака на ранней стадии представляет определенные трудности в связи с отсутствием специфических клинических проявлений. Только в 30% случаев выявленный рак не старше двух месяцев.
Лабораторное диагностирование
- Общий анализ крови показывает признаки анемии, может отмечаться повышение количества тромбоцитов и ускорение СОЭ. Биохимическое исследование крови показывает билирубинемию, повышение активности щелочной фосфатазы, печеночных ферментов при разрушении желчных путей или метастазировании в печень. Также в крови могут отмечаться признаки развившегося синдрома мальабсорбции.
- Определение онкомаркеров. Маркер СА-19-9 определяется для решения вопроса об операбельности опухоли. На ранних стадиях этот маркер при раке поджелудочной железы не выявляется. Раковый эмбриональный антиген выявляют у половины больных раком поджелудочной железы. Однако стоит отметить, что положительным может быть анализ на этот маркер и при хроническом панкреатите (5% случаев), язвенном колите. СА-125 также отмечают у половины больных. На поздних стадиях заболевания могут обнаруживаться опухолевые антигены: CF-50, СА-242, СА-494 и др.
Инструментальная диагностика
- Эндоскопическая или трансабдоминальная ультрасонография. УЗИ органов брюшной полости исключает заболевания желчного пузыря и печени, позволяет обнаружить опухоль поджелудочной железы. Эндоскопическое исследование дает возможность произвести забор биоптата для исследования.
- Компьютерная томография и МРТ позволяют визуализировать ткани поджелудочной железы и обнаружить опухолевые образования от 1 см (КТ) и 2 см (МРТ), а так же оценить состояние органов брюшной полости, наличие метастазов, увеличение лимфатических узлов.
- Позитронно-эмиссионная томография (ПЭТ) позволяет выявлять злокачественные клетки, обнаруживать опухоли и метастазы.
- ЭРХПГ выявляет опухоли любого отдела поджелудочной железы размером от 2 см. Однако, эта процедура инвазивна и способствует развитию осложнений.

КТ органов брюшной полости. Опухоль головки поджелудочной железы (красная стрелка), выраженное расширение Вирсунгова протока с атрофией тела и хвоста поджелудочной железы (синяя стрелка)
Для выявления небольших метастазов в печени, на брыжейке кишечника или брюшине проводят диагностическую лапароскопию.
Лечение рака поджелудочной железы
Поскольку у большинства больных, страдающих злокачественной опухолью поджелудочной железы, имеются признаки нарушения всасывания и анорексия, им показана диета с повышенным содержанием жиров и белков. Медикаментозной методикой лечение рака поджелудочной железы является химиотерапия. Лечение проводят препаратами, подавляющими рост раковых клеток (фторурацил, стрептозоцин, семустин и др.). Может назначаться как один препарат, так и несколько в комплексе. Также к нехирургическим методам лечения относят лучевую терапию. Дозировки и продолжительность курса выбирают в зависимости от размера опухоли, стадии заболевания, общего состояния пациента.
Паллиативное лечение при раке поджелудочной железы направлено на снятие основных клинических симптомов: обезболивание, коррекция проходимости желчных путей для лечения желтухи. В случае невозможности восстановления циркуляции желчи назначают холестирамин, фенобарбитал. Недостаточность внешнесекреторной функции поджелудочной железы корректируют с помощью ферментных препаратов (липаза, амилаза, протеаза, панкреатин).
Хирургическое лечение рака поджелудочной железы проводится путем резекции измененных тканей железы и окружающих ее органов. Если есть возможность оперативного удаления опухоли, зачастую прибегают к радикальной операции (удаляется вся поджелудочная железа, желчный пузырь с желчным протоком, двенадцатиперстная кишка, прилегающий участок толстого кишечника и желудка). Выживаемость после такой операции составляет 25% пациентов в течение пяти лет.
Профилактика рака поджелудочной железы
Профилактика рака поджелудочной железы включает следующие меры: отказ от курения и злоупотребления алкоголем, своевременное и полное лечение заболеваний поджелудочной железы и желчевыводящих путей, должная коррекция обмена при сахарном диабете, соблюдение режима питания, сбалансированная диета без перееданий и склонности к жирной и острой пище. Внимательно относиться к симптоматике панкреатита необходимо больным, перенесшим операции на желудке.
Прогноз при раке поджелудочной железы
Лица, страдающие раком поджелудочной железы, находятся под наблюдением специалистов по гастроэнтерологии, онкологии, хирурга и радиолога.
При выявлении рака поджелудочной железы в большинстве случаев прогноз крайне неблагоприятный, порядка 4-6 месяцев жизни. Только 3% пациентов достигают пятилетней выживаемости. Такой прогноз связан с тем, что в большинстве случаев рак поджелудочной железы выявляется на поздних стадиях и у пациентов старческого возраста, что не позволяет радикально удалить опухоль.
Источник