Трансплантация поджелудочной железы техника
Техника трансплантации поджелудочной железы. Методики
История клинической трансплантации поджелудочной железы развивалась на фоне постоянного совершенствования техники оперативного вмешательства.
Первая попытка лечения СД трансплантационными методами была выполнена задолго до того, как De Mayer в 1909 г. дал название теоретически обоснованной эндокринной субстанции поджелудочной железы — инсулин, a F.G. Banting и С.Н. Best в 1921 г. выделили ее и таким образом открыли новую эпоху в лечении диабета. В декабре 1983 г., через 3 года после того, как J. von Mering и О. Minkowski экспериментально показали, что панкреатэктомия приводит к развитию сахарного диабета у собак, P. Williams в Бристоле пересадил 3 фрагмента овечьей поджелудочной железы в подкожную клетчатку 15-летнему пациенту, спустя 5 месяцев от клинической манифестации заболевания. Больной умер через 3 суток на фоне прогрессирующего кетоацидоза. Тем не менее этот эксперимент послужил мощным толчком к пониманию патогенеза заболевания и роли поджелудочной железы в углеводном обмене.
Впервые инсулинонезависимость при СД 1-го типа была достигнута 17 декабря 1966 г., когда W. Kelly и R. Lillehei одномоментно пересадили фрагмент поджелудочной железы с лигированным панкреатическим протоком и донорскую почку 28-летней пациентке, страдающей сахарным диабетом и уремией в состоянии диабетического кетоацидоза. Сегмент поджелудочной железы (тело и хвост) был трансплантирован экстраперитонеально, в левую подвздошную ямку. Инсулинонезависимость сохранялась в течение 6-ти суток послеоперационного периода. В дальнейшем у больной сформировалась панкреатическая фистула, нарастали явления панкреатита трансплантата, присоединилась раневая инфекция, и 14 февраля 1967 г. трансплантат поджелудочной железы (ТПЖ) был удален. Через 13 суток больная погибла от тромбоэмболии легочной артерии.
Вторую пересадку поджелудочной железы осуществила та же бригада хирургов. 31 декабря 1966 г. они выполнили аллогенную трансплантацию панкреатодуоденального комплекса (АТПДК) и почки 32-летнему пациенту, с наложением анастомоза между дистальной частью донорской duodenum и начальным отделом тощей кишки реципиента. В послеоперационном периоде дважды развивалась реакция отторжения трансплантата. Через 4,5 месяца на фоне септического состояния пациент скончался. К этому моменту инсулинотерапия проводилась в первоначальном объеме.
К началу 1973 г. R. Lillehei выполнил уже 13 АТПДК: у четырех пациентов была наложена наружная дуоденостома ТПЖ; у следующих 8-ми — Roux-en-Y дуоденоеюнальный анастомоз. Последней была выполнена пересадка целой поджелудочной железы, в которой для анастомоза с мочевым пузырем реципиента была использована только площадка Фатерова сосочка. Из 13 трансплантатов только один функционировал более года.
В 1978 г. J. Dubernard предложил оригинальную методику сегментарной трансплантации поджелудочной железы с окклюзией панкреатических протоков синтетическим отвердевающим полимером неопреном. По этой методике 3—10 мл неопрена инъецировались непосредственно в выводящие протоки сегмента поджелудочной железы, с последующим лигированием протоков для предотвращения экстравазации. Артериальное кровоснабжение хвоста и тела поджелудочной железы осуществлялось по селезеночной артерии, а венозный отток — через селезеночную вену, анастомозированным с наружными подвздошными сосудами реципиента.
Преимущество методики в том, что операция, по существу, сводится к наложению сосудистых анастомозов.
Окклюзия протоковой системы поджелудочной железы производится в ходе ее изъятия у донора, либо непосредственно перед наложением сосудистых анастомозов, либо через 10—14 дней после операции. В последнем случае в просвет главного панкреатического протока вводился полиэтиленовый катетер для наружного отведения экзокринного секрета и промывания протоковой системы железы с целью снижения явлений послеоперационного панкреатита.
Главный же недостаток трансплантации поджелудочной железы с окклюзией протоков — невозможность контроля уровня амилазы в экзогенном секрете. Между тем именно этот показатель зачастую служит главным маркером реакции отторжения поджелудочной железы.
Кроме того, введение неопрена вызывает прогрессирующий фиброз трансплантата и увеличивает частоту реакций отторжения.
В результате эндокринная функция большинства трансплантатов утрачивалась в среднем через 1 год после успешной пересадки, поэтому с появлением новых способов интерес к данной методике снизился. Тем не менее в некоторых европейских трансплантационных центрах метод по-прежнему используется.
Еще в 1971 г. M.L. Gliedman предложил оригинальную методику трансплантации сегмента поджелудочной железы с выведением экзокринного секрета в мочеточник (после предварительной нефрэктомии) у пациентов, находящихся в терминальной стадии диабетической нефропатии. К 1973 г. Gliedman сообщил о результатах четырех подобных трансплантаций сегментов поджелудочной железы.
На основе принципа отведения панкреатического сока в мочевы водящие пути (bladder drainage — BD) в дальнейшем было разработано множество способов трансплантации поджелудочной железы. В 1983 г. Н. Sollinger предложил отводить секрет в мочевой пузырь не посредством дуктоуретероанастомоза с нативным мочеточником реципиента, а с помощью панкреатикоцистостомии.
Но полное признание и повсеместное распространение пересадка поджелудочной железы по типу BD получила только с 1987 г., когда D.D. Nghiem и R.J. Сопу предложили использовать для анастомоза с мочевым пузырем нисходящую часть 12-перстной кишки донора с сохраненным дуоденальным сосочком и неповрежденным Вирсунговым протоком.
В настоящее время за редким исключением трансплантация поджелудочной железы по типу BD выполняется следующим образом: после МОЗ на отдельном столе проводится разделение блока печень — поджелудочная железа и/или проводится предоперационная подготовка изолированного трансплантата поджелудочной железы.
Селезенку отделяют, а селезеночные сосуды надежно перевязывают лигатурами, клипируют или прошивают степлером. Длина нисходящего участка 12-перстной кишки с головкой поджелудочной железы и большим дуоденальным сосочком рекомендуется в пределах 6—10 см; после орошения просвета кишки раствором антисептиков и противогрибковых препаратов обе культи кишки прошиваются степлером и погружаются кишечным швом по Lembert.
Селезеночную и верхнюю брыжеечную артерии трансплантата анастомозируют с общими подвздошными артериями V-образного сосудистого трансплантата, полученного от того же донора.
Используют бифуркацию аорты, общих подвздошных или бедренных артерий. При короткой портальной вене ее удлиняют по типу «конец-в-конец» при помощи трансплантата полой или общей подвздошной вен. Избыточный жир тщательно удаляется, избегая значимого контакта с паренхимой железы, а адвентициальные сосуды перевязываются. В течение всей подготовки поджелудочная железа тщательно сохраняется в охлажденном консервирующем растворе UW или Custodiol.
Производят срединную лапаротомию: этот доступ снижает риск раневой инфекции в послеоперационном периоде и позволяет выполнить одновременную пересадку поджелудочной железы и почки из одного разреза. Нередко используется и параректальный доступ.
Трансплантат поджелудочной железы помещают в правую подвздошную область головкой вниз. В левую подвздошную ямку помещают почечный трансплантат. Оба органа располагают интраперитонеально. Накладывают анастомозы между сосудами панкреатодуоденального комплекса и общими или наружными подвздошными сосудами реципиента. Двухрядным швом, вручную или степлером накладывается дуоденоцистостома длиной 3—4 см по типу «бок-в-бок». После наложения анастомозов трансплантат окутывают большим сальником и помещают в правый латеральный канал брюшной полости.
Трансплантация почки производится стандартно.
Лапаротомная рана ушивается послойно наглухо без дренирования брюшной полости. При необходимости дренирования дренажная трубка располагается непосредственно у сосудистых анастомозов и выводится наружу через контрапертуру.
Некоторые хирурги предпочитают экстраперитонеальную трансплантацию поджелудочной железы в одну из подвздошных ямок; оперативный доступ в этом случае будет аналогичен доступу, используемому для пересадки почки.
АТПЖ по типу BD обладает рядом неоспоримых преимуществ. Выведение экзокринного секрета в мочевой пузырь позволяет отслеживать уровень вырабатываемой трансплантатом амилазы и наличие воспалительных клеток с помощью анализа мочи и выявлять реакцию отторжения на ранних сроках. Отсутствие контакта с кишечным содержимым позволяет уменьшить опасность инфицирования протоков трансплантата поджелудочной железы, а мочевой катетер помогает контролировать состояние дуоденоцистоанастомоза.
Выживаемость трансплантата поджелудочной железы после изолированной пересадки по этому способу и по настоящее время существенно выше в сравнении с остальными. Однако наряду с достоинствами эта методика имеет и существенные недостатки: высокая частота инфекции мочевыводящих путей, гематурия, камнеобразование, мочевые затеки, панкреатит трансплантата поджелудочной железы, цистит, а также метаболический ацидоз и дегидратация за счет хронической потери жидкости и бикарбонатов с панкреатическим секретом. Поэтому с 1998 г. в мировой практике чаще используют отведение экзокринного секрета трансплантата поджелудочной железы в просвет кишечника реципиента.
Задача создания естественного, наиболее физиологичного дренирования панкреатического сока во внутрикишечное пространство стояла перед хирургами с самого начала освоения проблемы пересадки поджелудочной железы.
Трансплантации ПДК с наложением дуоденоеюноанастомоза были пионерскими операциями пересадки поджелудочной железы. Даже при сегментарных трансплантациях предпринимались попытки наложения инвагинационно-го панкреатикоеюноанастомоза. Однако частые осложнения в виде некрозов 12-перстной кишки и формирования фистул, связанные с ишемическим повреждением, скомпрометировали этот принцип. С совершенствованием методов консервации органов и прогрессом в области иммуносупрессии, приведшим к снижению риска ишемического или иммунологического повреждения двенадцатиперстной кишки, с начала 1990-х гг. интерес к возможности интестинального дренирования внешнего секрета трансплантированной поджелудочной железы (enteric drainage — ED) возродился.
На сегодняшний день пересадка поджелудочной железы по типу ED служит операцией выбора при SKPT и РАК.
По данным международного регистра, выживаемость пациентов после SKPT и РАК по типу ED значительно выше, чем по BD-методике, при том, что выживаемость трансплантатов различается незначительно. От 10 до 28% больных, ранее оперированных по BD-методике, в последующем подвергаются релапаротомии и реконструктивной операции по ED-типу в связи с развитием урологических осложнений.
Принципиальная техника оперативного вмешательства заключается в следующем. Выполняется срединная лапаротомия. Подготовка трансплантата поджелудочной железы аналогична операции по BD-методике, однако в этом случае к удлиняющей пластике портальной вены приходится прибегать существенно реже. Трансплантат поджелудочной железы располагается так, что хвост железы ориентирован в каудальном направлении, а головка направлена вверх, в сторону петли тощей кишки. Портальная вена анастомозируется с наружной или общей подвздошной веной реципиента вблизи нижней полой вены по типу «конец-в-бок». Общий аортоподвздошный V-образный черенок трансплантата поджелудочной железы анастомозируют с правой общей подвздошной артерией реципиента. Сначала удаляют венозные зажимы, кровотечение останавливается лигированием сосудов шелком 3—0 или 4—0. После остановки венозного кровотечения восстанавливают артериальный кровоток. Кровотечение устраняется аналогично.
После наложения сосудистых анастомозов и реваскуляризации трансплантата формируется кишечный дренаж. Для этого мобилизуют сегмент тощей кишки и отжимают его на расстоянии 40—80 см от дуоденоеюнального перехода. Рана промывается раствором антибиотика и отграничивается. Между оставшейся частью 12-перстной кишки трансплантата поджелудочной железы и мобилизованной петлей тощей кишки вручную двухрядным швом по Lambert или степлером накладывается дуоденоеюноанастомоз длиной 3—4 см по типу «бок-в-бок».
После пересадки поджелудочной железы в левый латеральный канал брюшной полости по стандартной методике трансплантируют донорскую почку.
Операционную рану закрывают послойно наглухо, при необходимости дренируют брюшную полость через отдельный прокол.
ED-вариант трансплантации поджелудочной железы имеет несколько модификаций. Некоторые хирурги использует для кишечного дренирования трансплантата Roux-петлю, сформированную из тощей или даже подвздошной кишки, при этом головка поджелудочной железы может быть направлена краниально, каудально или латерально. При анализе результатов как достоверных преимуществ, так и недостатков использования Roux-en-V петли не выявлено.
Межкишечный анастомоз может быть наложен также по типу «конец-в-конец» и «конец-в-бок».
Для наложения сосудистых анастомозов некоторые хирурги используют наружные подвздошные сосуды, а также аорту и нижнюю полую вену; в редких случаях накладывают разнонаправленные сосудистые анастомозы.
Заслуживает внимания способ дренирования Вирсунгова протока ПВХ-катетером, последовательно выведенным наружу через дуоденоеюноанастомоз и сформированную энтеростому. Метод позволяет контролировать функцию трансплантата по составу и динамике выделения панкреатического сока, на ранних сроках диагностировать реакцию отторжения, проводить профилактику ишемического панкреатита. Однако в связи с высоким риском инфекционных осложнений на фоне иммуносупрессивной терапии модификация не получила широкого распространения.
Некоторые хирурги рекомендуют накладывать анастомоз между веной трансплантата и верхней брыжеечной веной по типу «конец-в-бок», т.е. осуществлять венозный отток в систему воротной вены реципиента, что теоретически более физиологично.
Обоснованием этого считают отмеченные в ряде исследований случаи гиперинсулинемии за счет попадания секретируемого трансплантатом инсулина непосредственно в системный кровоток, минуя печеночный этап регуляции углеводного обмена. Однако практически незначительные преимущества портального дренирования связаны с немалыми техническими трудностями, и большинство хирургов выбирает системное отведение крови от ПДК, тем более что факт послеоперационной гиперинсулинемии в этом случае признают далеко не все исследователи.
Недостатки АТПДК с отведением панкреатического сока в просвет кишечника: во-первых, высокий риск хирургических послеоперационных осложнений (кишечная непроходимость и несостоятельность межкишечного анастомоза); во-вторых, невозможность использовать показатели внешней секреции железы в качестве маркера воспалительных или иммунологических осложнений.
Таким образом, в настоящее время используются три основных метода трансплантации поджелудочной железы. При выполнении АТПДК одновременно или после пересадки почки предпочтительнее использовать различные варианты интестинального дренирования экзокринного секрета трансплантата. АТПЖ с отведением панкреатического сока в мочевыводящие пути преимущественно используется при изолированных пересадках поджелудочной железы в случаях гиперлабильного диабета и предуремической диабетической нефро-патии. Сегментарная АТПЖ с окклюзией панкреатических протоков может быть рекомендована одновременно с пересадкой почки ослабленным больным, а также при длительных сроках консервации или значительном ишемическом повреждении трансплантата поджелудочной железы.
— Вернуться в оглавление раздела «Хирургия»
Оглавление темы «Хирургическая патология поджелудочной железы»:
- Инструментальная диагностика острого панкреатита у пожилых. Методика
- Консервативное лечение острого панкреатита. Принципы
- Хирургическое лечение острого панкреатита. Принципы
- Хирургические вмешательства у больных инфицированным панкреонекрозом в пожилом возрасте. Особенности
- Результаты лечения инфицированного панкреонекроза. Исходы
- Трансплантация поджелудочной железы. Показания
- Требования к трансплантату поджелудочной железы. Подготовка доноров
- Техника изъятия поджелудочно-дуоденального комплекса. Принципы
- Селекция реципиентов поджелудочной железы. Принципы
- Техника трансплантации поджелудочной железы. Методики
Источник
Способ имплантации донорской поджелудочной железы зависит прежде всего от вида трансплантата (сегмент поджелудочной железы от живого или трупного донора, целая трупная поджелудочная железа).
Хирургический доступ у реципиента — срединная лапаротомия или внебрюшинные разрезы в нижних квадрантах живота справа или слева, как при трансплантации почки. Доступ зависит в основном от избранных способов венозного дренирования трансплантата и дренирования панкреатического протока.
Реконструкцию венозного оттока донорской поджелудочной железы выполняют двумя основными способами — портальным и системным.
Портальная венозная реконструкция впервые описана R. Calne в 1984 г. и многократно модификацирована. Теоретически портальная венозная реконструкция более физиологична, так как нивелирует гиперинсулинемию путём утилизации избытка инсулина при «первом прохождении» через печень. В то же время системный венозный сброс имеет недостаток в виде периферической гиперинсулинемии с последующим развитием резистентности к инсулину и нарушениями липидного обмена. Тем не менее большинство авторов предпочитают именно системный венозный отток как технически более рациональный. Его выполняют в 90% трансплантаций, и он обеспечивает хорошие результаты жизнеспособности трансплантата и выживания реципиента.
При использовании системного венозного оттока трансплантат поджелудочной железы (целый трупный орган, дистальный фрагмент трупной поджелудочной железы или дистальный фрагмент железы живого родственного донора) имплантируют в правую подвздошную область после максимальной мобилизации подвздошных сосудов. При одновременной пересадке почки её обычно имплантируют в левую подвздошную область. Применение правых подвздошных сосудов для имплантации поджелудочной железы, с технической точки зрения, удобнее, так как они расположены поверхностно. Проксимальный конец трансплантата направлен к мочевому пузырю. Первым накладывают широкий (10-15 мм) венозный анастомоз между воротной (или селезёночной) веной трансплантата и подвздошной (общей или наружной) веной реципиента. Для создания адекватного венозного оттока устье воротной вены целого трупного трансплантата или селезёночной вены фрагментарного трансплантата расширяют продольным разрезом её наружной стенки. Отверстие в подвздошной вене реципиента формируют продольным иссечением фрагмента её стенки. Полученные отверстия сшивают непрерывным атравматическим швом (Prolen 5/0-6/0).
Артериальную реконструкцию трансплантата трупной поджелудочной железы начинают на отдельном операционном столе. Наиболее часто используют Y-образная вставка донорской подвздошной артерии для объединения в единый кровеносный бассейн верхнебрыжеечной и селезёночной артерий трансплантата (рис. 69-10).

Рис. 69-10. Предварительная артериальная реконструкция трансплантата трупной поджелудочной железы Y-образной вставкой из донорской подвздошной артерии (вид с дорсальной поверхности): 1 — воротная вена; 2 — внутренняя подвздошная артерия; 3 — латеральная ветвь Y-образной вставки; 4 — наружная подвздошная артерия, медиальная ветвь Y-образной вставки; 5 — селезёночная артерия трансплантата.
Артериальную реваскуляризацию трансплантата при системной венозной реконструкции выполняют с правой наружной или общей подвздошной артерией. При имплантации сегмента поджелудочной железы селезёночную артерию трансплантата анастомозируют с любой из подвздошных артерий реципиента, чаще всего «конец-в-конец» с пересечённой внутренней подвздошной артерией.
По окончании сосудистой реконструкции выполняют реперфузию трансплантата, то есть включение его в кровоток. Для этого восстанавливают кровоток по подвздошной вене, а затем снимают зажим с подвздошной артерии. Реперфузия сопровождается началом поступления панкреатического сока из вирсунгова протока донорского органа и постепенным снижением уровня гликемии.
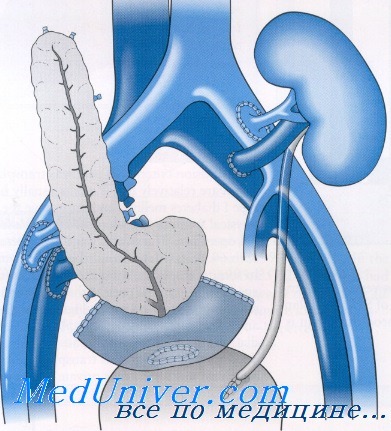
Экзокринная функция донорской поджелудочной железы зависит от вида трансплантата и конкретных анатомических условий имплантации. Наиболее распространена панкреатикоцистостомия, позволяющая осуществлять мониторирование уровня амилазы мочи как маркёра функции трансплантата. Поскольку целую трупную поджелудочную железу имплантируют вместе с донорским фрагментом двенадцатиперстной кишки, проксимальный и дистальный концы которого заглушены, анастомоз накладывают между этим фрагментом и мочевым пузырём реципиента (рис. 69-11).

Рис. 69-11. Одномоментная трансплантация поджелудочной железы и почки от умершего донора (реконструкция экзокринной секреции поджелудочной железы с применением панкреатикодуоденоцистостомии): 1 — трансплантированная поджелудочная железа; 2 — донорский фрагмент двенадцатиперстной кишки; 3 — мочевой пузырь.
При использовании дистальных фрагментов поджелудочной железы накладывают панкреатико- или панкреатоцистоанастомоз. Перед наложением такого анастомоза необходимо добиться полной остановки кровотечения из раневой поверхности трансплантата, которое возникает после реперфузии. Гемостаз раневой поверхности лучше производить, накладывая отдельные швы (PDS 6/0) в области устий кровоточащих сосудов и не использовать электрокоагуляцию. Накладывая гемостатические швы, необходимо постоянно контролировать устье панкреатического протока, чтобы не стенозировать его или не ушить наглухо. В любом случае перед наложением анастомоза целесообразно канюлировать вирсунгов проток коротким (7-10 мм) отрезком тонкой дренажной трубки для профилактики стеноза его устья в случае отёка трансплантата в послеоперационном периоде. Дренажную трубку обычно фиксируют к стенке вирсунгова протока тонкой рассасывающейся нитью типа PDS 6/0.
Для наложения панкреатикоцистоанастомоза стенку мочевого пузыря рассекают до слизистой оболочки, небольшое отверстие в которой сшивают со стенками панкреатического протока отдельными швами PDS 5/0-6/0. Второй ряд швов накладывают между мышечной оболочкой мочевого пузыря и краями раневой поверхности трансплантата (PDS 3/0-4/0). Для формирования панкреатоцистоанастомоза достаточно наложения одного ряда отдельных швов, захватывающих слизистую и мышечную оболочки стенки мочевого пузыря и края раневой поверхности трансплантата (PDS 3/0-4/0).
При длительном наблюдении реципиентов после трансплантации поджелудочной железы отмечены случаи развития цистита в результате воздействия амилазы панкреатического сока на слизистую оболочку мочевого пузыря. В таких случаях анастомоз поджелудочной железы с мочевым пузырём разобщают и накладывают панкреатико (или панкреато)-еюноанастомоз с выключенной по Ру петлёй тонкой кишки.
По мере совершенствования протоколов иммуносупрессии и уменьшения частоты хирургических осложнений энтеральный экзокринный дренаж получил более широкое распространение в качестве первичного варианта операции.
При портальном венозном дренировании трансплантат поджелудочной железы располагают в брюшной полости. При этом артерию трансплантата после Y-образной реконструкции анастомозируют с любым доступным крупным сосудом (аорта, верхняя брыжеечная артерия, общая подвздошная артерия), тогда как воротную или селезёночную вену трансплантата обычно анастомозируют с верхней брыжеечной веной реципиента (рис. 69-13).

Рис. 69-13. Одномоментная трансплантация поджелудочной железы и почки от умершего донора. Реконструкция экзокринной секреции поджелудочной железы с применением дуоденоеюностомии: 1 — трансплантированная поджелудочная железа; 2 — донорский фрагмент двенадцатиперстной кишки; 3 — тощая кишка реципиента.
Расположение трансплантата поджелудочной железы в брюшной полости не исключает формирования системного венозного оттока. В таких случаях венозный сосуд трансплантата анастомозируют с нижней полой веной или общей подвздошной веной реципиента. При расположении трансплантата в брюшной полости чаще используют энтеральный дренаж панкреатического сока (см. рис. 69-13), однако в классическом варианте при использовании трансплантата трупной поджелудочной железы в комплексе с фрагментом двенадцатиперстной кишки накладывают дуоденоцистоанастомоз.
С.В. Готье
Источник


