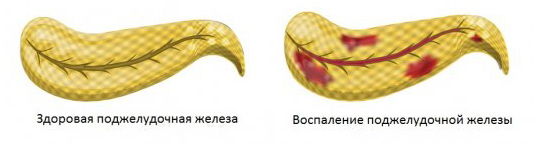
Влияние глютена на поджелудочную железу
Если у Вас проблемы с желчным пузырем, то, возможно, они вызваны непереносимостью белка зерновых, в частности, глютеном.
Глютен – обобщающее название для растительного протеина, найденного во многих крупах (в частности, в пшенице, ржи, ячмене и других).
Все большее количество проблем со здоровьем начинают связывать глютеном. Постепенно медицина начинает открывать, насколько отрицательно протеины круп и злаков влияют на здоровье. Одним из таких проблем является заболевание желчного пузыря, хотя связь между глютеном и желчным пузырем не доведена еще до широкой общественности.
Попробуем восполнить этот пробел нашим материалом на эту тему.
В настоящий момент выделяют две реакции на глютен:
— крайнее проявление всех симптомов в виде
целиакии
(предположительно поражает 1 из 100 человек, но только 5% из этих людей получают правильный диагноз (1),(2));
— более «тихое» проявление в виде
повышенной чувствительности к глютену
(она считается вероятной у 20-40% населения (3-4)).
Процент людей, подверженных влиянию глютена очень не точен, так как в настоящее время нет методологии её выявления, дающей 100% достоверность.
Прежде чем говорить о связи глютена и желчного пузыря, давайте посмотрим, что конкретно представляет из себя желчный пузырь и какую функцию в организме он выполняет.
Желчный пузырь – это небольшой мешочек в форме груши, находящийся ниже печени. У него очень простая работа:
— накапливать желчь (которая производится печенью) между приемами пищи;
— концентрировать желчь;
— выпускать желчь в тонкий кишечник, где необходимо переваривание пищи.
Желчь состоит из воды, желчных солей, желчных пигментов (производное красных кровяных телей, которые выделяются из организма с желчью), холестерола и различных электролитов. Желчные соли – это единственный компонент желчи, который обладает, собственно, пищеварительными свойствами. Желчные соли – это не то же самое, что пищеварительные энзимы (которые вырабатываются клетками желудка и поджелудочной железы), но они помогают им в пищеварении жиров и улучшают усвоение жирных кислот и жирорастворимых витаминов.
Самая главная роль желчных солей – это их свойство эмульгатора. Грубо говоря, желчные соли разбивают молекулы жира на маленькие частицы, которые смешиваются с водой.
Энзимы, расщепляющие жиры до жирных кислот (липазы) могут после этого работать эффективнее. Кроме того, желчные соли помогают всасыванию жирных кислот и холестерола (небольшое количество холестерола , попавшего в кишечник вместе с желчью, затем всасывается снова). При этом усваиваются жирорастворимые витамины — A, D, E, K1 и K2).
Если желчный пузырь неправильно функционирует, жиры перестают нормально усваиваться, а с ними и жирорастворимые витамины, что ведет к дефициту микронутриентов. Здоровье желчного пузыря является критичным для общего здоровья.
В последние десятилетия исследователи накопили достаточный опыт, говорящий о том, что целиакия связана с желчным пузырем. Приблизительно 60% пациентов имеют известные проблемы с печенью, желчным пузырем или поджелудочной железой (5). Некоторые из этих состояний могут быть связаны с недостатком микронутриентов и/или непосредственно вызываться повреждением желудочно-кишечного тракта, вызванными целиакией, в то время как другие имеют аутоимунную природу как и сама целиакия (например, когда иммунная система атакует какой-то орган также, как и тонкий кишечник) (5). В частности, первичный цирроз печени, холангит и аутоимунные формы гепатита или холангита имеют по мнению специалистов те же причины, что и сама целиакия – то есть, вызываются глютеном.
Что это означает? При целиакии (или чувствительности к глютену) глютен вызывает аутоиммунный ответ. Собственный иммунитет атакует клетки, выстилающие тонкий кишечник, вызывая характерное укорачивание кишечных ворсинок (микроскопических, похожих на маленькие пальчики, ворсинок, состоящих из колоний клеток кишечного эпителия). Это вызывает нарушения всасывания веществ, которое стимулирует иммунную систему, приводя к воспалению, а также позволяя токсинам и чужеродным протеинам всасываться через кишечник, чего в норме происходить не должно. У большинства больных целиакией, иммунная система не ограничивается атаками на клетки тонкого кишечника, поэтому часто возникают вторичные аутоиммунные заболевания разных органов.
Когда вы едите, клетки, выстилающие кишечник определяют присутствие жиров и протеина и реагируют, выделяя гормон холецистокинин. Этот гормон стимулирует выработку как пищеварительных энзимов поджелудочной железы, так и желчи из желчного пузыря. Также холецистокинин командует желудку снизить скорость пищеварения, что бы тонкий кишечник успел эффективно переварить жиры. Когда кишечник поврежден (из-за целиакии или другой паталогии), клетки тонкого кишечника (энтероциты) продуцируют меньше холецистокинина. Это означает, что желчный пузырь не получает достаточный сигнал для отпуска желчных солей в кишечник. Сниженная выработка холецистокинина известна при целиакии и может быть одним из ключевых причин дисфункции желчного пузыря при целиакии (6-8).
Важно упомянуть, что доминирующим симптомом , который может быть спровоцирован глютеном, является холецистит (воспаление желчного пузыря) или дисфункция желчного пузыря (дискинезия по гипомоторному типу), а не камни в желчном (камни присутствуют у 20% пациентов пожилого возраста и только у 2.5% среди общей численности больных целиакией).
Частота заболеваний печени и желчного пузыря у больных целиакией позволила сделать ученым вывод об их взаимосвязи. В настоящее время пациентам с необъяснимыми проблемами печени и желчного пузыря рекомендуется пройти проверку на целиакию (9-11), хотя ни один из тестов и не является 100%.
Если у вас диагностировали заболевание желчного пузыря, важно принимать во внимание возможность целиакии или повышенной чувствительности к глютену как причины этого.
Как уже упомянуто выше, все существующие на сегодняшний момент способы подтверждения целиакии не точны. Лучшим способом удостовериться, не является ли глютен причиной ваших проблем, является исключение глютена на несколько месяцев (больным целиакией иногда требуется до 5 лет, что бы восстановить вред, причиненный глютеном (12)). При этом недостаточно навсегда отказаться от глютена, так как антитела, возникающие в ответ на глютен могут распознавать другие протеины как глютен, «путать» их. Иными словами, даже если вы не едите глютен, ваше тело может продолжать думать, что вы его едите (к белкам, схожим с глютеном относятся белки в кофе, шоколаде, яичные белки, молочный белок – в целом, лучше следовать аутоимунному палео-протоколу)
Дополнительным обнадеживающим (и одновременно подтверждающим связь глютена и болезней желчного пузыря) фактором стало исследование, опубликованное в 2012 году и показавшее, что безглютеновая диета приводит к восстановлению функции желчного пузыря (13) при существовавшей дискинезии! В исследовании срок диеты составлял 1-2 года.
Какой вывод из этого? Между заболеваниями желчного пузыря и целиакией существует прямая связь. Дискинезия желчного пузыря может быть одним из первых симптомов целиакии. Таким образом, если вы страдаете заболеваниями желчного пузыря, то лучше как можно скорее обратиться к диете.
Mia специально для PaleoPlanet.
При перепечатке обязательна ссылка на PaleoPlanet.ru!
1 Lohi S et al. “Increasing prevalence of coeliac disease over time.” Aliment Pharmacol Ther. 2007 Nov 1;26(9):1217-25.
2 https://www.mayoclinic.com/health/cel…CTION=symptoms
3 https://www.gastroendonews.com/ViewAr…672&a_id=16015
4 https://www.glutenfreesociety.org/glu…n-sensitivity/
5 Freeman HJ.” Hepatobiliary and pancreatic disorders in celiac disease.” World J Gastroenterol. 2006 Mar 14;12(10):1503-8. https://www.wjgnet.com/1007-9327/full/v12/i10/1503.htm
6 Masclee AA et al. “Gallbladder sensitivity to cholecystokinin in coeliac disease. Correlation of gallbladder contraction with plasma cholecystokinin-like immunoreactivity during infusion of cerulein.” Scand J Gastroenterol. 1991 Dec;26(12):1279-84. https://www.ncbi.nlm.nih.gov/pubmed/1763298
7 Fraquelli M et al “Gallbladder emptying and somatostatin and cholecystokinin plasma levels in celiac disease.” Am J Gastroenterol. 1999 Jul;94(7):1866-70.
8 Nousia-Arvanitakis S et al. “Subclinical exocrine pancreatic dysfunction resulting from decreased cholecystokinin secretion in the presence of intestinal villous atrophy.” J Pediatr Gastroenterol Nutr. 2006 Sep;43(3):307-12. https://www.ncbi.nlm.nih.gov/pubmed/16954951
9 Biecker E et al “Autoimmune hepatitis, cryoglobulinaemia and untreated coeliac disease: a case report.” Eur J Gastroenterol Hepatol. 2003 Apr;15(4):423-7. https://www.ncbi.nlm.nih.gov/pubmed/12655265
10 Parfenov AI et al “Asymptomatic celiac disease in patient with chronic acalculous cholecystitis” Eksp Klin Gastroenterol. 2011;(3):122-4.
11 Galán Bertrand L et al. “Acute lithiasic cholecystitis as an exceptional presentation of celiac disease” An Pediatr (Barc). 2006 Jul;65(1):87-8. Spanish
12 Rubio-Tapia A “Mucosal recovery and mortality in adults with celiac disease after treatment with a gluten-free diet.” Am J Gastroenterol. 2010 Jun;105(6):1412-20.
13 Benini F1, Mora A, Turini D, Bertolazzi S, Lanzarotto F, Ricci C, Villanacci V, Barbara G, Stanghellini V, Lanzini A. «Slow gallbladder emptying reverts to normal but small intestinal transit of a physiological meal remains slow in celiac patients during gluten-free diet.» Neurogastroenterol Motil. 2012 Feb;24(2) 100-7, e79-80. doi: 10.1111/j.1365-2982.2011.01822.x. Epub 2011 Nov 20.
Вложения
Источник
Поджелудочная железа (ПЖ), будучи одним из центральных пищеварительных органов, а также обладая рядом анатомических особенностей, легко вовлекается практически в любой патологический процесс в пищеварительной системе. При заболеваниях, сопровождающихся синдромом мальабсорбции, в одних случаях ее поражение является центральным звеном патогенеза (например, при муковисцидозе или синдроме Швахмана), а в других – она поражается вторично, на фоне тяжелого нарушения пищеварительных процессов и нутритивного статуса. На протяжении многих лет сотрудники кафедры детских болезней N2 Российского государственного медицинского университета (зав. кафедрой – академик РАМН, профессор В.А. Таболин) изучают проблемы, связанные с синдромом мальабсорбции у детей, в т.ч. такие заболевания, как целиакия и лактазная недостаточность.
Целиакия – наследственное заболевание, связанное с непереносимостью злакового белка глиадина, патогенез которого до конца не установлен. Глиадин содержится практически во всех злаках, кроме риса, кукурузы, гречи. Известно, что в результате действия глиадина на слизистую оболочку чувствительных к нему лиц развивается атрофический процесс с последующим нарушением кишечного всасывания белков, жиров, углеводов, минералов и витаминов, развитием тяжелых водно–электролитных расстройств и гипотрофии. Заболевание проявляется диареей с полифекалией, увеличением живота, гипотрофией, задержкой психомоторного развития. В типичном случае целиакия манифестирует на первом году жизни через 1–2 месяца после введения в питание ребенка глиадин–содержащих продуктов, например, манной каши. Чаще манифестация наблюдается в более отдаленные сроки, нередко уже на втором году жизни. Распространенность целиакии различна в разных регионах мира. Наиболее высокой она считается в Ирландии, где достигает значений 1:300. Во многих европейских странах частота целиакии составляет в среднем 1:1000. Несвоевременная диагностика и позднее начало лечения могут привести к гибели больного. Центральным звеном лечения больных с целиакией является исключение из питания глиадин–содержащих продуктов – аглиадиновая диета. Строгое ее соблюдение в комплексе с сопутствующей терапией позволяет добиться стойкой ремиссии, обеспечивающей достаточно высокое качество жизни больных.
Лактазная недостаточность (ЛН) является наиболее распространенной причиной мальабсорбции. Дефицит лактазы в кишечнике может быть первичным, генетически обусловленным, или вторичным, развившимся на фоне какого–либо заболевания желудочно–кишечного тракта. Нерасщепленная лактоза, находясь в просвете кишечника, повышает осмотическое давление, что приводит к поступлению жидкости в просвет кишки по градиенту давления. Вторичные нарушения микробиоценоза усугубляют кишечные расстройства. Водно–электролитные расстройства утяжеляют состояние больного. Основной подход к лечению этих пациентов – исключение лактозы из питания, что позволяет лицам с ЛН вести обычный образ жизни.
В обоих случаях, как при целиакии, так и при лактазной недостаточности, существующими диагностическими методами можно выявить различной степени выраженности вовлечение ПЖ в патологический процесс. По нашим данным, при целиакии в активной стадии заболевания поражение ПЖ наблюдается у 88% больных, в стадии ремиссии – у 79%, а при ЛН – в 76%. Повышение в крови активности трипсина, говорящее о деструктивном процессе в ПЖ, скорее всего, обострении хронического панкреатита, наблюдается у 37% детей в активной стадии целиакии и у 12% больных в стадии ремиссии. При ЛН высокая трипсиногенемия нами отмечена только у 7% пациентов. Что касается повышенной экскреции триглицеридов с калом, указывающей на экзокринную недостаточность ПЖ, нами была выявлена обратная картина: низкая частота в активную стадию (18%) и более высокая – в стадии ремиссии (52%). При ЛН умеренная стеаторея за счет триглицеридов наблюдалась у 38% детей. Выявленная закономерность совпала с таковой при оценке частоты выявления признаков хронического панкреатита по данным ультразвукового исследования. Признаки хронического панкреатита не выявлялись в активной стадии целиакии, но встречались у 58% больных с целиакией в стадии ремиссии и у 32% больных детей с ЛН. Можно предположить постепенное формирование хронического панкреатита по мере течения процесса даже на фоне стойкой ремиссии целиакии с развитием экзокринной панкреатической недостаточности. Полученные первичные данные указывают на значительно большую тяжесть поражения ПЖ при целиакии, по сравнению с ЛН и, видимо, на различные механизмы ее повреждения. Дальнейшие работы в этом направлении позволили воссоздать возможные пути повреждения ПЖ при целиакии и ЛН.
Целиакия характеризуется развитием атрофии слизистой оболочки тонкой кишки, которая является причиной мальабсорбции. Данная атрофия носит гиперрегенераторный характер, что проявляется значительным углублением крипт и повышенной митотической активностью в них. Вместе с увеличением числа собственно энтероцитов, в криптах увеличивается также число некоторых энтероэндокринных клеток. Нашими исследованиями (табл. 1) было показано достоверное повышение числа соматостатин–продуцирующих D–клеток в слизистой оболочке тонкой кишки у детей в активную стадию целиакии и нормализацию их числа в стадию ремиссии (иммуноморфологическое исследование ПАП–методом). Гиперплазия D–клеток сопровождается стимуляцией их активности, увеличением продукции соматостатина [1]. Уровень соматостатина повышается локально в слизистой оболочке, обеспечивая паракринную регуляцию, но не изменяется в системном кровотоке. Указанная особенность изменения уровня соматостатина нашла подтверждение и по данным зарубежных авторов. Мы предполагаем, что гиперсекреция соматостатина является закономерным регуляторным ответом на гиперрегенерацию слизистой оболочки тонкой кишки и призвана сдерживать ее в определенных пределах. Вместе с тем нельзя исключить, что соматостатин в какой–то мере усугубляет и без того нарушенные процессы всасывания. Помимо воздействия на процессы регенерации и всасывания, одной из точек приложения соматостатина являются другие энтероэндокринные клетки, в т.ч. I–клетки, продуцирующие холецистокинин, и S–клетки, продуцирующие секретин. Нормальные результаты секретинового и холецистокининового тестов (по данным литературы [2]) говорят о том, что снижение функции ПЖ в активную стадию целиакии связано именно с нарушением паракринной регуляции, но не с непосредственным влиянием соматостатина на ацинарные клетки ПЖ.
Другой механизм повреждения ПЖ при целиакии связан с нарушением ее трофики и, видимо, имеет более долговременные последствия. Важными трофическими факторами для ткани поджелудочной железы являются такие регуляторные пептиды желудочно–кишечного тракта, как гастрин и холецистокинин. Нами было показано, что уровень гастрина в крови, как мы предполагаем, также под влиянием гиперпродукции соматостатина, снижается в активную стадию целиакии (радиоиммунный метод, таблица 2). Количество гастрин–продуцирующих G–клеток при этом не изменяется ни в желудке, ни в двенадцатиперстной кишке, что указывает на функциональный характер выявленных нарушений. Тем не менее в сочетании со снижением продукции холецистокинина, которое обсуждалось выше, могут развиваться трофические нарушения, способствующие как снижению функции органа, так и создающие условия для развития хронического панкреатита в дальнейшем. Наконец, не следует преуменьшать значение общих нутритивных нарушений, развивающихся на фоне мальабсорбции. Тяжелая гипотрофия, независимо от причины, характеризуется нарушением функций всех органов, в т.ч. пищеварительных желез, что резко снижает толерантность пациентов с гипотрофией к пище.
Указанные трофические нарушения, снижение стабильности клеточных мембран, безусловно способствуют развитию цитолиза достаточно чувствительных к различным неблагоприятным факторам ацинарных клеток ПЖ. Деструкция проявляется панкреатической гиперферментемией (гипертрипсиногенемией, гиперлипаземией) и является отражением, по существу неявно (без четких клинических проявлений), острого панкреатита или обострения хронического панкреатита у больного с целиакией. В патогенезе указанных нарушений нельзя также исключить аутоиммунный механизм, т.к. известно о появлении в крови при целиакии аутоантител к различным органам, в т.ч. к островковым клеткам ПЖ, хотя аутоагрессия в отношении ацинарных клеток пока остается недоказанной [3]. Наконец, при целиакии в активную стадию заболевания повышается уровень вазоактивного интестинального пептида (ВИП), что может привести к нарушению микроциркуляции в ПЖ. Ишемия ткани ПЖ, сохраняющаяся длительное время, может быть причиной вялотекущего панкреатита с его хронизацией в дальнейшем в стадии ремиссии. И хотя в стадии ремиссии целиакии происходит восстановление кишечного всасывания и нутритивного статуса, нормализуется число соматостатин–продуцирующих клеток, а уровень гастрина даже повышается, ущерб, нанесенный ПЖ в активную стадию, остается не всегда поправимым, что проявляется высокой частотой хронического панкреатита с экзокринной панкреатической недостаточностью на фоне благополучия по основному заболеванию.
В обобщенном виде предполагаемые механизмы повреждения ПЖ при целиакии представлены на рисунке.
Таким образом, манифестация целиакии, развитие атрофии слизистой оболочки тонкой кишки приводит, с одной стороны, к мальабсорбции, а с другой – к вторичному повреждению ПЖ и нарушению ее экзокринной функции. Вторичное нарушение переваривания способствует неблагополучию в тонкой кишке, усугубляет мальабсорбцию и ухудшение нутритивного статуса пациента. Следовательно, поражение тонкой кишки при целиакии и поражение ПЖ являются не просто связанными процессами, но тесно взимодействующими и поддерживающими друг друга. Такой подход диктует необходимость коррекции состояния ПЖ при целиакии, в т.ч. определяет необходимость заместительной терапии высокоактивными препаратами панкреатических ферментов.
Исходя из этого, в план обследования больного с целиакией должны входить ультразвуковое исследование органа, оценка экзокринной ее функции (оптимальным методом является определение эластазы 1 в кале, но могут быть использованы и такие косвенные методы, как липидограмма кала), а также определение активности панкреатических ферментов в крови (трипсина, липазы или эластазы 1 в крови). В состав комплексной терапии целиакии должны входить препараты, улучшающие микроциркуляцию в ПЖ (в т.ч. антиагреганты, даларгин), и препараты панкреатических ферментов (например, Креон), назначение которых имеет патогенетическую основу. Эффективность применения высокоактивных панкреатических препаратов подтверждается как нашими наблюдениями, так и данными зарубежных авторов [4]. В большинстве случаев использование препарата Креон 10000, содержащего 10000 единиц Ph.Eur. липазы, 8000 единиц Ph.Eur. амилазы и 600 единиц Ph.Eur. протеаз, является оптимальным, однако в наиболее тяжелых случаях может быть использована и более мощная форма препарата с активностью 25000 единиц Ph.Eur липазы. Изменения ПЖ при лактазной недостаточности носят более легкий и транзиторный характер, однако возможность развития хронического панкреатита у этой группы детей также должна учитываться врачами при составлении плана обследования и лечения.
Несмотря на многочисленные исследования вопросы патогенеза целиакии остаются изученными в недостаточной степени до настоящего момента. Изучение отдельных сторон этого многогранного заболевания пока еще не позволяет представить целостную патогенетическую картину, однако дальнейшие работы в данном направлении, несомненно, позволят разработать наиболее эффективные методы лечения этого тяжелого заболевания.
Литература
1. Arilla E., Hernander M., Polanco T. Vodification of somatostatin. Content and binding in jejunum from celiac children.// J.Pediatr.Gastroentero.Nutr.– 1987.– Vol.6.– N2.– P.228–233.
2. Carroccio A., Iacono G., Montalto G., Cavataio F., Di Marco C., Balsamo V., Notarbartolo A. Exocrine pancreatic function in children with coeliac disease before and after a gluten free diet.// Gut.– 1991.– Vol.32.– N.7.– P.796–799.
3. Volta U., De Franceschi L., Molinaro N., Tetta C., Bianchi F.B. Organ–specific autoantibodies in coeliac disease: do they represent an epiphenomenon or the expression of associated autoimmune disorders ?// Ital.J.Gastroenterol.Hepatol.– 1997.– Vol.29.– N1.– P.18–21.
4. Carroccio A. Pancreatic enzyme therapy in childhood celiac disease.// Dig.Dis.Sci.– 1995.– Vol.40.– 2555–2560.
Источник