Активация протеолитических ферментов поджелудочной железы
В
поджелудочной железе синтезируются
проферменты ряда протеаз: трипсиноген,
химотрипсиноген, проэластаза,
прокарбоксипептидазы А и В. В кишечнике
они путём частичного протеолиза
превращаются в активные ферменты
трипсин, химотрипсин, эластазу и
карбок-сипептидазы А и В.
Активация
трипсиногена происходит
под действием фермента эпителия
кишечника энтеропептидазы.
464
Этот
фермент отщепляет с N-конца молекулы
трипсиногена гексапептид Вал-(Асп)4-Лиз.
Изменение конформации оставшейся части
полипептидной цепи приводит к формированию
активного центра, и образуется активный
трипсин. Последовательность Вал-(Асп)4-Лиз
присуща большинству известных
трипсиноге-нов разных организмов — от
рыб до человека.
Образовавшийся
трипсин активирует
химотрипсиноген, из
которого получается несколько активных
ферментов (рис. 9-3). Химотрипсиноген
состоит из одной полипептидной цепи,
содержащей 245 аминокислотных остатков
и пяти дисульфидных мостиков. Под
действием трипсина расщепляется
пептидная связь между 15-й и 16-й
аминокислотами, в результате чего
образуется активный π-химотрипсин.
Затем под действием π-химотрипсина
отщепляется дипептид сер(14)-арг(15), что
приводит к образованию δ-химотрипсина.
Отщепление дипептида тре(147)-арг(148)
завершает образование стабильной формы
активного фермента — α-химотрипсина,
который состоит из трёх полипептидных
цепей, соединённых дисульфидными
мостиками.
Остальные
проферменты панкреатических протеаз
(проэластаза и прокарбоксипептидазы
А и В) также активируются трипсином
путём частичного протеолиза. В результате
образуются активные ферменты — эластаза
и карбокси-пептидазы А и В.
2. Специфичность действия протеаз
Трипсин
преимущественно гидролизует пептидные
связи, образованные карбоксильными
группами аргинина и лизина. Химотрипсины
наиболее активны в отношении пептидных
связей, образованных карбоксильными
группами ароматических аминокислот
(Фен, Тир, Три).
Карбоксипептидазы
А и В — цинксодержащие ферменты, отщепляют
С-концевые остатки аминокислот. Причём
карбоксипептидаза А
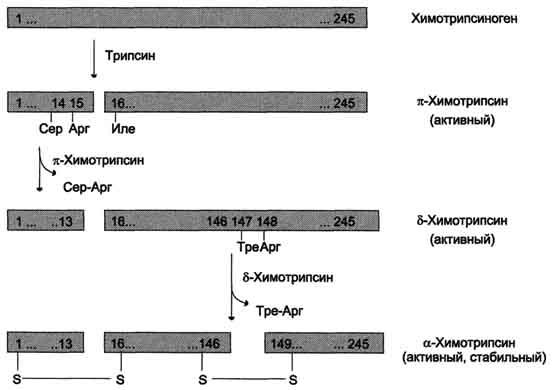
Рис.
9-3. Активация химотрипсиногена. Молекула
химотрипсиногена состоит из 245
аминокислотных остатков и имеет пять
дисульфидных мостиков. На схеме показаны
участки фермента, подвергающиеся
протеолизу. а-Химотрипсин — активная
стабильная форма фермента — состоит из
трёх полипептидных цепей, ковалентно
связанных между собой двумя дисульфидными
мостиками и нековалентно — за счёт
водородных связей и гидрофобных
взаимодействий.
465
отщепляет
преимущественно аминокислоты, содержащие
ароматические или гидрофобные радикалы,
а карбоксипептидаза В — остатки аргинина
и лизина.
Последний
этап переваривания — гидролиз небольших
пептидов, происходит под действием
ферментов аминопептидаз и дипептидаз,
которые синтезируются клетками тонкого
кишечника в активной форме.
Аминопептидазы последовательно
отщепляют N-концевые аминокислоты
пептидной цепи. Наиболее известна
лейцинаминопептидаза — Zn2+-
или Мn2+-содержащий
фермент, несмотря на название, обладающий
широкой специфичностью по отношению
к N-концевым аминокислотам.Дипептидазы расщепляют
дипептиды на аминокислоты, но не
действуют на трипептиды.
В
результате последовательного действия
всех пищеварительных протеаз большинство
пищевых белков расщепляется до свободных
аминокислот.
В.
Защита клеток от действия протеаз
Клетки
поджелудочной железы защищены от
действия пищеварительных ферментов
тем, что:
эти
ферменты образуются
в виде неактивных предшественников в
клетках поджелудочной железы и
активируются только после секреции в
просвет кишечника. Таким образом, место
синтеза и место действия этих ферментов
пространственно разделены.в
клетках поджелудочной железы
присутствует белок-ингибитор
трипсина, образующий
с активной формой фермента (в случае
преждевременной активации) прочный
комплекс.
В
полости желудка и кишечника протеазы
не контактируют с белками клеток,
поскольку слизистая оболочка покрыта
слоем слизи, а каждая клетка содержит
на наружной поверхности плазматической
мембраны полисахариды, которые не
расщепляются протеазами и тем самым
защищают клетку от их действия.
Разрушение
клеточных белков протеазами происходит
при язвенной болезни желудка или
двенадцатиперстной кишки. Однако
начальные механизмы возникновения
язвы ещё мало изучены.
Г.
Транспорт аминокислот в клетки
Аминокислоты,
образовавшиеся при переваривании
белков, быстро всасываются в кишечнике.
Транспорт их осуществляется двумя
путями: через воротную систему печени,
ведущую прямо в печень, и по лимфатическим
сосудам, сообщающимся с кровью через
грудной лимфатический проток. Максимальная
концентрация аминокислот в крови
достигается через 30-50 мин после приёма
белковой пищи (углеводы и жиры замедляют
всасывание аминокислот). Всасывание
L-аминокислот (но не D-изомеров) — активный
процесс, требующий затраты энергии.
Аминокислоты переносятся через кишечную
стенку от слизистой её поверхности в
кровь (рис. 9-4). Перенос через щёточную
кайму осуществляется целым рядом
переносчиков, многие из которых действуют
при участии Nа+-зависимых
механизмов симпорта, подобно переносу
глюкозы (см. раздел 7).
Различная
скорость проникновения аминокислот
через мембраны клеток указывает на
наличие транспортных систем, обеспечивающих
перенос аминокислот как через внешнюю
плазматическую мембрану, так и через
внутриклеточные мембраны. В настоящее
время известно по крайней мере пять
специфических транспортных систем,
каждая из которых функционирует
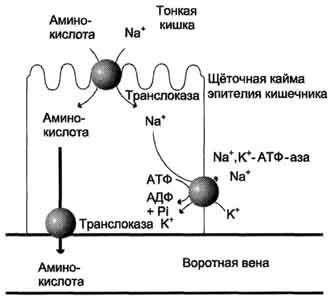
Рис.
9-4. Механизм всасывания аминокислот в
кишечнике. L-аминокислота
поступает в энтероцит путём симпорта
с ионом Na+.
Далее специфическая транслоказа
переносит аминокислоту через мембрану
в кровь. Обмен ионов натрия между
клетками осуществляется путём
первично-активного транспорта с помощью
Nа+,К+-АТФ-азы.
466
для
переноса определённой группы близких
по строению аминокислот:
нейтральных,
с короткой боковой цепью (аланин, серии,
треонин);нейтральных,
с длинной или разветвлённой боковой
цепью (валин, лейцин, изолейцин);с
катионными радикалами (лизин, аргинин);с
анионными радикалами (глутаминовая и
аспарагиновая кислоты);иминокислот
(пролин, оксипролин).
Причём
к числу Nа+-зависимых
относятся переносчики аминокислот,
входящих в первую и пятую группы, а
также переносчик метионина. Независимые
от Na+ переносчики
специфичны для некоторых нейтральных
аминокислот (фенилаланин, лейцин) и
аминокислот с катионными радикалами
(лизин).
Аминокислоты
конкурируют друг с другом за специфические
участки связывания. Например, всасывание
лейцина (если концентрация его достаточно
высока) уменьшает всасывание изолейцина
и валина.
Одна
из специфических транспортных систем
для некоторых нейтральных аминокислот
функционирует в кишечнике, почках и,
по-видимому, мозге. Она получила название
γ-глутамильного цикла (рис. 9-5).
В
этой системе участвуют 6 ферментов,
один из которых находится в клеточной
мембране, а остальные — в цитозоле.
Ключевую роль в транспорте аминокислоты
играет мембранно-связан-ный фермент
γ-глутамилтрансфераза. Этот
фермент является гликопротеином и
катализирует перенос γ-глутамильной
группы от глутатиона (иногда другого
γ-глутамильного пептида) на транспортируемую
аминокислоту и последующий перенос
комплекса в клетку. Глутатион представляет
собой трипептид — γ-глутамилцистеинилглицин,
который находится во всех тканях
животных. Реакция протекает следующим
образом (см. схему А на с. 468).
Аминокислота,
связанная с γ-глутамильным остатком,
оказывается внутри клетки. В следующей
реакции происходит отщепление
γ-глутамильного
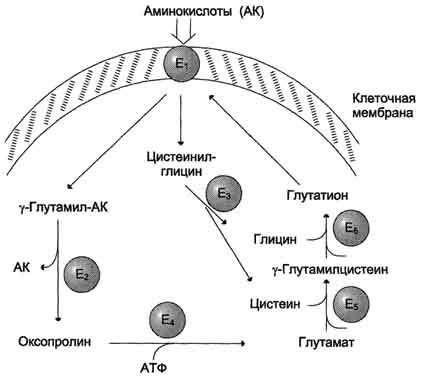
Рис.
9-5. γ-Глутамильный
цикл. Система
состоит из одного мембранного и пяти
цитоплазматических ферментов. Перенос
аминокислоты внутрь клетки осуществляется
в комплексе с глутамильным остатком
глутатиона под действием
γ-глутамилтрансферазы. Затем аминокислота
освобождается, а γ-глутамильный остаток
в несколько стадий превращается в
глутатион, который способен присоединять
следующую молекулу аминокислоты. Е1 —
γ-глутамилтрансфераза; Е2 —
у-глутамилциклотрансфераза; Е3 —
пептидаза; Е4 —
оксопролиназа; Е5 —
γ-глутамилцистеинсинтетаза; Е6 —
глутатионсинтетаза.
467
остатка
под действием фермента
γ-глутамилциклотрансферазы (см. схему
Б).
Дипептид
цистеинилглицин расщепляется под
действием пептидазы на 2 аминокислоты
— цис-теин и глицин. В результате этих
3 реакций происходит перенос одной
молекулы аминокислоты в клетку (или
внутриклеточную структуру). Следующие
3 реакции обеспечивают регенерацию
глутатиона, благодаря чему цикл
повторяется многократно. Для транспорта
в клетку одной молекулы аминокислоты
с участием γ-глутамильного цикла
затрачиваются 3 молекулы АТФ.
Д.
Нарушение переваривания белков и
транспорта аминокислот
Небольшую
долю продуктов переваривания белка
составляют негидролизованные короткие
пептиды. У некоторых людей возникает
иммунная реакция на приём белка, что,
очевидно, связано со способностью к
всасыванию
таких
пептидов. Продукты полностью переваренного
белка (аминокислоты) лишены антигенных
свойств и иммунных реакций не вызывают.
У
новорождённых проницаемость слизистой
оболочки кишечника выше, чем у взрослых,
поэтому в кровь могут поступать антитела
молозива (секрет молочных желёз,
выделяющийся в первые дни после родов,
обогащённый антителами и антитоксинами).
Это усугубляется наличием в молозиве
белка — ингибитора трипсина. Протеолитические
ферменты в пищеварительных секретах
новорождённых обладают низкой
активностью. Всё это способствует
всасыванию в кишечнике небольшого
количества нативных белков, достаточного
для обеспечения иммунной реакции.
Очевидно, подобное усиление всасывающей
способности кишечника является причиной
наблюдаемой иногда непереносимости
белков пищи (например, молока и яиц) у
взрослых людей.
Гниение
Известно,
что микроорганизмы кишечника
для своего роста также нуждаются в
доставке с пищей определенных аминокислот.
Микрофлора кишечника располагает
набором ферментных систем, отличных
от соответствующихферментов животных тканей и
катализирующих самые разнообразные
превращения пищевых аминокислот.
В кишечнике создаются оптимальные
условия для образования ядовитых
продуктов
распада аминокислот: фенола,индола, крезола, скатола, сероводорода,
метилмер-каптана, а также нетоксичных
для организма соединений: спиртов, аминов, жирных
кислот,кетокислот, оксикислот и
др.
Все
эти превращения аминокислот,
вызванные деятельностью микроорганизмовкишечника,
получили общее название «гниение белков в
кишечнике». Так, в процессе
распада серосодержащих
аминокислот (цистин, цистеин, метионин)
в кишечнике образуются сероводород H2S
и метил-меркаптан CH3SH.
Диаминокислоты – орнитин и лизин –
подвергаются процессудекарбоксилирования с
образованием аминов –
путресцина и кадаверина.
Из
ароматических аминокислот: фенилаланин, тирозин и триптофан –
при аналогичном
бактериальном декарбоксилировании образуются
соответствующие амины: фенилэтиламин,
параоксифенилэтиламин (или тира-мин)
и индолилэтиламин (триптамин).
Кроме того, микробные ферментыкишечника
вызывают постепенное разрушение боковых
цепей циклическихаминокислот,
в частности тирозина и триптофана,
с образованием ядовитых продуктов
обмена – соответственно крезола и фенола, скатола и индола.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
Гастриксин близок к пепсину по молекулярной массе (31 500). Оптимум pH у него около 3,5. Гастриксин гидролизует пептидные связи, образуемые дикарбоновыми аминокислотами. Соотношение пепсин/ гастриксин в желудочном соке 4:1. При язвенной болезни соотношение меняется в пользу гастриксина [19].
Присутствие в желудке двух протеиназ, из которых пепсин действует в сильнокислой среде, а гастриксин в среднекислой, позволяет организму легче приспосабливаться к особенностям питания. Например, растительно-молочное питание частично нейтрализует кислую среду желудочного сока, и pH благоприятствует переваривающему действию не пепсина, а гастриксина. Последний расщепляет связи в пищевом белке [19].
Пепсин и гастриксин гидролизуют белки до смеси полипептидов (называемых также альбумозами и пептонами). Глубина переваривания белков в желудке зависит от длительности нахождения в нем пищи. Обычно это небольшой период, поэтому основная масса белков расщепляется в кишечнике [19].
Протеолитические ферменты кишечника. В кишечник протеолитические ферменты поступают из поджелудочной железы в виде проферментов: трипсиногена, химотрипсиногена, прокарбоксипептидаз А и В, проэластазы. Активирование этих ферментов происходит путем частичного протеолиза их полипептидной цепи, т.е. того фрагмента, который маскирует активный центр протеиназ. Ключевым процессом активирования всех проферментов является образование трипсина (рис. 1.3) [19].
Трипсиноген, поступающий из поджелудочной железы, активируется с помощью энтерокиназы, или энтеропептидазы, которая вырабатывается слизистой кишечника. Энтеропептидаза также выделяется в виде предшественника киназогена, который активируется протеазой желчи. Активированная энтеропептидаза быстро превращает трипсиноген в трипсин, трипсин осуществляет медленный аутокатализ и быстро активирует все остальные неактивные предшественники протеаз панкреатического сока [19].
Механизм активирования трипсиногена заключается в гидролизе одной пептидной связи, в результате чего освобождается N-концевой гексапептид, называемый ингибитором трипсина. Далее трипсин, разрывая пептидные связи в остальных проферментах, вызывает образование активных ферментов. При этом образуются три разновидности химотрипсина, карбоксипептидазы А и В, эластаза [19].

Рис. 1.3. Активация протеолитических проферментов кишечника
Кишечные протеиназы гидролизуют пептидные связи пищевых белков и полипептидов, образовавшихся после действия желудочных ферментов, до свободных аминокислот. Трипсин, химотрипсины, эла- стаза, будучи эндопептидазами, способствуют разрыву внутренних пептидных связей, дробя белки и полипептиды на более мелкие фрагменты
[19].
Трипсин гидролизует пептидные связи, образованные главным образом карбоксильными группами лизина и аргинина, менее активен он в отношении пептидных связей, образованных изолейцином.
Химотрипсины наиболее активны в отношении пептидных связей, в образовании которых принимает участие тирозин, фенилаланин, триптофан. По специфичности действия химотрипсин похож на пепсин.
Эластаза гидролизует те пептидные связи в полипептидах, где находится пролин.
Карбоксипептидаза А относится к цинксодержащим ферментам. Она отщепляет от полипептидов С-концевые ароматические и алифатические аминокислоты, а карбоксипептидаза В — только С-концевые остатки лизина и аргинина [19].
Ферменты, гидролизующие пептиды, имеются также и в слизистой кишечника, и хотя они могут секретироваться в просвет, но функционируют преимущественно внутриклеточно. Поэтому гидролиз небольших пептидов происходит после их поступления в клетки. Среди этих ферментов лейцинаминопептидаза, которая активируется цинком или марганцем, а также цистеином, и высвобождает N-концевые аминокислоты, а также дипептидазы, гидролизующие дипептиды на две аминокислоты. Дипептидазы активируются ионами кобальта, марганца и цистеином.
Разнообразие протеолитических ферментов приводит к полному расщеплению белков до свободных аминокислот даже в том случае, если белки предварительно не подвергались действию пепсина в желудке. Поэтому больные после операции частичного или полного удаления желудка сохраняют способность усваивать белки пищи [19].
Источник
Они активируются
энтерокиназой. Она переводит трипсиноген
в трипсин, а трипсин – переводит
химотрипсиноген в химотрипсин.
23.Охарактеризуйте механизмы отделения сока под¬желу¬дочной железы (3 фазы).
1 фаза:
Включает 2
механизма:
1)
условнорефлекторный
2)
безусловнорефлекторный
=Происходит
усиление секреции поджелудочной железы,
а также выделение желчи в полость
12-перстной кишки за счёт сокращения
желчного пузыря и расслабления сфинктера
Одди.
2 фаза:
Нервный
механизм:
Гуморальный
механизм: связан с выделением в стенках
желудка гормона гастрина, который с
током крови поступает к желудку,
поджелудочной железе, желчному пузырю,
усиливая их активность.
3 фаза:
Кишечная
фаза – основная фаза активации кишечного
пищеварения. Кислое содержимое желудка,
продукты гидролиза жира поступают в
12-перстную кишку и стимулируют выделение
гормонов 12-перстной кишки: секретин,
холецистокинин, панкреозимин.
24.В чем обнаруживаются отличия действия гормонов двенад¬цати¬перстной кишки на поджелудочную железу?
Они имеют
особенное действие на поджелудочную
железу. Под действием секретина выделяется
сок поджелудочной железы, богатой
бикарбонатами, но с малым содержанием
ферментов. Под действием
холецистокинина/панкреозимина сок с
большим содержанием ферментов. Оба
гормона вызывают усиленное сокращение
желчного пузыря и расслабление сфинктера
Одди. При этом действие
холецистокинина/панкреозимина более
выражено. На желудок: угнетают секрецию
и моторику желудка.
25.Что такое полостное, пристеночное, мембранное пищеварение, какова их функциональная роль?
Полостное
пищеварение – в полости кишки под
влиянием ферментов, кишечного сока
поджелудочной железы крупные молекулярные
комплексы распадаются до олигомеров.
Полостное пищеварение обеспечивает
гидролиз крупных молекул и надмолекулярных
агрегаций, в результате чего образуются
в основном олигомеры. Пристеночное
пищеварение – на микроворсинках есть
тонкие мукополисахаридные выросты –
гликокаликс. На этих ворсинках фиксируются
ферменты кишечного сока. Благодаря
этому они становятся более активными.
Покрыты слоем слизи. Олигомеры поступают
в слой слизи и подвергаются действию
ферментов на микроворсинках. В результате
происходит дробление олигомеров до
комплексов, которые могут войти в зону
между ворсинками. Мембранное пищеварение
– ферменты энтероцитов дробят комплексы
до мономеров, которые далее всасываются
через мембрану энтероцитов.
26.Объясните механизм всасывания электролитов, воды, кальция, углеводов и аминокислот в тонком кишечнике?
Всасывание
электролитов и воды:
Через
апикальную мембрану Na попадает в
энтероцит по диффузионному градиенту.
А через базальную мембрану выводится
с помощью специальных насосов, используя
энергию АТФ. Cl поступает в энтероциты
по электрическому градиенту, который
создаётся ионами Na. NaCl формирует внутри
энтероцита локальный осмотический
градиент, по которому в клетку поступает
вода.
Всасывание
ионов Ca:
Происходит
с участием гормона паращитовидной
железы – паратгормона и тирокальцитомина
– гормона щитовидной железы. Работа
кальциевых насосов контролируется
гормонами: паратгормон активирует
гормоны и всасывание Ca в кровь;
тирокальцитомин угнетает деятельность
насосов.
Всасывание
глюкозы и аминокислот:
Глюкоза и
аминокислоты на апикальной мембране
связываются со специальными переносчиками.
Внутри клетки комплекс распадается,
переносчик возвращается в мембрану.
Глюкоза и аминокислоты накапливаются
в клетке и по концентрационному градиенту
пассивно поступают в кровь.
27.Охарактеризуйте
функции желчи по обеспечению пищеварения
в двенад¬цати-перстной кишке.
— Угнетает
действие пепсинов желудочного сока
— Иммульгирует
жиры, активирует липазу панкреотического
сока, что обеспечивает всасывание жирных
кислот в кишечнике
— Повышает
перистальтику в кишечнике
— Оказывает
бактериостатическое действие на кишечную
флору
— Создаёт
условия для фиксации ферментов на
кишечной стенке, обеспечивая пристеночное
и мембранное пищеварение и всасывание
в кишечнике
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник

