Аллоксановый диабет поджелудочной железы
1
Михайличенко В.Ю. 1 Столяров С.С. 1 Старых А.А. 1
1 Медицинская академия имени С.И. Георгиевского Федерального государственного автономного образовательного учреждения высшего образования «Крымский федеральный университет имени В. И. Вернадского» Министерства образования и науки Российской Федерации
При аллоксановом диабете наблюдаются изменения в организме животных, характерные для сахарного диабета 1 типа. Трансплантация культур клеток поджелудочной железы кролика позволяет эффективно корригировать уровень гликемии при сахарном диабете у экспериментальных животных, а также приводит к эндокринной коррекции нарушений, вызванных аллоксановым диабетом. За счет повышения концентрации инсулина и С-пептида уменьшается уровень гликемии, снижается содержание контринсулярных гормонов, а также стабилизируются биохимические показатели крови (глюкоза, триглицериды, липопротеиды). При гистологическом исследовании через 1 месяц после начала эксперимента в поджелудочной железе животных при экспериментальном СД отмечалось резкое снижение числа островков Лангерганса, а сохранившиеся островки имели неправильную форму, небольшие размеры, состояли преимущественно из альфа-клеток. В поджелудочной железе через 14 дней после трансплантации наблюдается гипертрофия островков Лангерганса, их удельный объем составил 0,3458±0,025, что 2,67 раза меньше, чем в норме, и в 5,77 раза больше, чем у животных без лечения. Однако размер островков был больше, чем в норме, на 1,88 раза (среднее число клеток в островке составило 77,25±1,42), что говорит о том, что уже к 14 дню после введения трансплантата вновь образованные островки достигают размеров, сравнимых с размерами нормальных островков.
аллоксановый диабет
гормоны
лечение
1. Гончарова О.В. Значение «школ сахарного диабета» в профилактике сахарного диабета и его осложнений у детей и взрослых / О.В. Гончарова, Н.В. Зимина, Р.И. Девишев // Русский медицинский журнал. – 2012. – № 20. – С.1001-1007.
2. Дедов И.И. Современные возможности применения стволовых клеток при сахарном диабете / И.И. Дедов, И.А. Лисуков, Д.Н. Лаптев // Сахарный диабет. – 2014. – № 2. – С.20-28.
3. Закирьянов А.Р.Возможные пути реализации регенерационной стратегии при лечении сахарного диабета i типа методами клеточной трансплантации / А.Р. Закирьянов, Н.А. Онищенко // Гены и клетки. – 2007. – № 2. – С.23-33.
4. Трансплантация культуры клеток поджелудочной железы при аллоксановом диабете (сообщение 1) / О.И. Миминошвили, В.Ю. Михайличенко, А.Г. Попандопуло и др. // Вестник неотложной и восстановительной медицины. – 2003. – Т.4. – № 3. – С.530-533.
5. С-kit-позитивные клетки островков поджелудочной железы крысы как клетки-предшественницы эндокриноцитов при аллоксановом диабете / А.С. Плюшкина, М.С. Калигин, Д.И. Андреева и др.// Гены и клетки. – 2012. – № 3. – С.138-141.
Несмотря на значительное развитие современной диабетологии, проблема профилактики, ранней диагностики, контроля за течением сахарного диабета (СД) у детей и взрослых стала острейшей медико-социальной проблемой, которая в большинстве стран мира обозначена в числе приоритетных направлений развития здравоохранения. Приводя к тяжелым осложнениям и ранней потере трудоспособности, СД характеризуется высокой смертностью, в том числе в молодом возрасте [1]. Клеточная терапия позволяет в полном объеме обеспечить доставку в организм необходимых пептидов и факторов межклеточного взаимодействия, которые способствуют репаративной регенерации ткани поджелудочной железы, приводя таким образом к компенсации инсулиновой недостаточности [2,4]. Современные методы лечения СД не позволяют добиться нормального уровня глюкозы в крови без эпизодов гипо- и гипергликемии и полностью предотвратить развитие осложнений СД. Замещение β-клеток (пересадка поджелудочной железы или β-клеток) сопровождается осложнениями, требует пожизненной иммуносупрессивной терапии, при этом далеко не всегда достигается инсулинонезависимость, а также имеется существенный дефицит доноров. Одним из инновационных методов лечения является применение стволовых клеток (СК), которые лишены этих недостатков. Аллогенные трансплантации СК осложнены иммунным отторжением трансплантата, а использование эмбриональных СК — этическими аспектами, сложностью отбора клеточных линий и риском возникновения тератом [3]. На сегодняшний день одним из наиболее перспективных маркёров клеток-предшественниц эндокриноцитов поджелудочной железы является рецептор фактора стволовых клеток C-kit или CD117, который участвует в дифференцировке этих клеток в эндокриноциты в пренатальном развитии и сохраняется у взрослого человека в клетках островков поджелудочной железы. Однако до сих пор остаётся неизученным участие C-kit+-клеток-предшественниц в восстановлении популяции клеток островков Лангерганса при сахарном диабете I типа [5]. Новый взгляд на проблему регенерацию ткани ПЖ, которая до недавнего времени считалась органом, который абсолютно не восстанавливает эндокринную часть, и пути стимуляции репаративной регенерации открывают новые возможные пути лечения и профилактики развития СД.
Цель — исследовать патофизиологические изменения в организме крыс при аллоксановом диабете и эффективность их коррекции трансплантацией культуры клеток поджелудочной железы.
Материал и методы. Экспериментальное исследование выполнено на 60 крысах самцах массой 200-250 г. Животные были разделены на 3 группы по 20 крыс в каждой: 1 — контрольная группа; 2 — животные с аллоксановым диабетом; 3 — животные с аллоксановым диабетом, которым выполняли трансплантацию культур клеток поджелудочной железы кролика. Сахарный диабет вызывали путем подкожного введения раствора аллоксанатетрагидрата из расчета 20 мг на 100 г массы тела, предварительно 2 суток голодавшим животным. Раствор аллоксана готовили путем разведения кристаллического субстрата AlloxanTetrahydrate фирмы Fluka-Sigma (Германия) в стерильной дистиллированной воде. После растворения кристаллов вещества, стерильность раствора осуществляли путем пропускания его через мембрану Millex-GV с фильтром 0,22 mm фирмы MILLIPORE (Франция) и помещали в стерильные закатанные флаконы.
Материалом для приготовления культуры клеток поджелудочной железы служила поджелудочная железа (ПЖ) 3 месячного кролика породы Шиншилла. В стерильных условиях экспериментального операционного блока под внутримышечным наркозом Ketamine+Xylazine в пропорции 40+7,5 мг/кг выполняли верхнесрединную лапаротомию, мобилизовали поджелудочную железу кролика, пунктировали ее главный проток, в который вводили 0,25 % раствор трипсина. После чего ПЖ немедленно извлекали из организма животного и помещали в стерильный раствор среды S 199 с антибиотиком и передавали для дальнейшей обработки в лабораторию клеточного и тканевого культивирования ИНВХ АМН Украины. В лаборатории предварительно трипсинизированную поджелудочную железу механически делят на фрагменты размером 1мм3 и подвергают тепловой трипсинизации при температуре 370С — 5 минут в 0,25% растворе трипсина (Институт полиомиелита и вирусных энцефалитов, г. Москва). Действие трипсина останавливают добавлением 5 % сыворотки крупного рогатого скота «Биолот» (г.Санкт-Петербург). Полученную ферментативно-дезагрегированную клеточную суспензию центрифугируют при 800 об/мин, в течение 6 минут. Супернатант сливают, а в клеточный осадок добавляют питательную среду Игла (Институт полиомиелита и вирусных энцефалитов, г.Москва). Жизнеспособность клеток определяют в камере Горяева, предварительно окрашивая трипановым синим. Концентрация клеток в 1 мл суспензии составляет при этом 2,5 млн/мл. Трансплантацию культуры эндокринных клеток ПЖ производили крысам в переднюю брюшную стенку, толстой иглой в верхний квадрат живота из расчета 12000-15000 клеток на 1 крысу.
Содержание глюкозы, холестерина и триглицеридов определяли при помощи программируемого фотометра EppendorfEpac 6140, используя соответствующие наборы реактивов производства «Диакон ДС» (Россия), «Diasys» (Германия), «LaChema» (Чехия). Соотношение фракций липопротеидов определяли электрофотометрическим методом с применением системы для электрофореза «Helena» (Франция), в качестве носителя использовались пленки из ацетата целлюлозы. Концентрацию глюкозы определяли глюкозоксидазным методом. Содержание холестерина исследовали ферментативным методом с холестеролоксидазой и пероксидазой. Определение концентрации триглицеридов проводилось ферментативным методом с глицерокиназой и глицерол-3-фосфатоксидазой.
Определение содержания инсулина, кортикостерона, С-пептида, тироксина и трийодтиронина проводили радиоиммунологическим методом с использованием стандартных коммерческих наборов реактивов фирмы «Immunotech» (Чехия). Уровень инсулина и С-пептида определяли через 4-6 часов после трансплантации клеток, а также через 1,7 сутки, 1 и 3 месяц.
В опыт брали животных со средней тяжестью сахарного диабета (условно выделяли 3 степени тяжести течения сахарного диабета: легкая — концентрация глюкоза крови была в пределах 10 ммоль/л, средняя — 10-15 ммоль/л, тяжелая — 15 и более).
Гистологическое исследование органов (ПЖ, сердца, почек, сосудов) проводили на 6, 10, 14 и 30 сутки после трансплантации эндокриноцитов ПЖ. Органы фиксировались в 10 % нейтральном формалине и затем заливались парафином. Гистологические срезы окрашивались гематоксилином и эозином, по Вергоффу, альциановым синим при рН 1,0 и 2,6, выполняли ШИК-реакцию.
Исследование окрашенных препаратов и морфометрическое исследование проводили с помощью исследовательского микроскопа OlympusAX70 (Япония) и соединенной с ним компьютерной системы с программой анализа изображения AnalySIS 3.1 (Германия).
Статистическую обработку полученных данных выполняли на компьютере PentiumIII с помощью программ «MicrosoftExcel 10.0», «Statistica 6.0» (USA).
Результаты исследований. После введения диабетогенной дозы аллоксанатетрагидрата наблюдалось несколько фаз изменений содержания глюкозы крови: первая фаза — гипергликемическая, достигающая максимума в течение первых 2-4 часов; вторая — гипогликемическая, которая в основном проявлялась на протяжении 15-24 часов, и наконец третья фаза — фаза стойкой гипергликемии (свыше 24 часов).
Первые признаки диабета проявлялись в виде резкого увеличения суточного потребления воды (более 120 мл), полифагией, полиурией, гипергликемией, резкой потери в весе, выпадении волосяного покрова. В разные сроки эксперимента развивались трофические язвы голени, гангрена с самоампутацией хвоста. Около 15 % животных погибло в результате гипергликемической или гипогликемической комы в разные сроки развития аллоксанового диабета.
Известно, что инсулиновая недостаточность при аллоксановом диабете приводит к усиленному распаду тканевых белков, повышенному поступлению в кровь аминокислот, увеличению общего азота крови. Характерным нарушением липидного обмена является повышение содержания в сыворотке липопротеидов низкой плотности (ЛПНП) до 41,7 % (в норме до 19,9 %), триглицеридов до 1,03 ммоль/л (в норме до 0,47 ммоль/л), при р<0,05, а также снижение содержания липопротеидов высокой плотности (ЛПВП) с 38,1 % (норма) до 12,8 %. Снижение уровня глюкозы отмечали через 4-6 часов после трансплантации, которое сопровождалось повышением уровня инсулина крови до 12,3 мкМЕмл и уровня С-пептида до 0,5 нгмл. В дальнейшем, через 1 сутки уровень инсулина повышался до 12,7 мкМЕмл, а С-пептид — до 1,48 нгмл. Одновременно наблюдалось снижение уровня кортикостерона с 609 до 456 нмольл, повышение содержания общего трийодтиронина с 1,08 до 2,15 нмольл, общего тироксина с 20,1 до 36,4 нмольл. В биохимических анализах отмечалось снижение уровня глюкозы до 4,12 ммольл. Также снижалась концентрация триглицеридов до 0,48 ммольл и повышалось содержание ЛПВП до 34,3 %, хотя уровень ЛПНП оставался практически неизменен.
Отмечался достоверный эндокринокорригирующий эффект после трансплантации культур клеток ПЖ (табл.1), который проявлялся в нормализации концентрации в крови инсулина, С-пептида, кортикостерона, тироксина и трийодтиронина.
При гистологическом исследовании через 1 месяц после начала эксперимента в поджелудочной железе животных при экспериментальном СД отмечалось резкое снижение числа островков Лангерганса, а сохранившиеся островки имели неправильную форму, небольшие размеры, состояли преимущественно из альфа-клеток. В сердце определяется выраженная гипертрофия миокарда, очаговые дистрофические изменения кардиомиоцитов, стенка сосудов утолщена, разволокнена, просвет их расширен, вокруг сосудов отмечаются очаги плазморрагии. В почках определяются тонкие нежные прослойки соединительной ткани между петлями извитых канальцев, в которых наблюдаются дистрофические изменения. В сосудах наблюдаются такие же изменения, как и в сосудах сердца.
Таблица 1
Динамика биохимических показателей крови крыс в разные сроки опыта (М±m)
Показатели | Норма | 1 месяц аллоксанового диабета | 1-е сутки после трансплантации | 7-е сутки после трансплантации | 1 месяц после трансплантации | 3 месяца после трансплантации |
Глюкоза ммольл | 4,31±0,13 | 13,79±0,25 | 4,12±0,26 | 3,89±0,18 | 3,92±0,11 | 4,19±0,1 |
Инсулин мкМЕл | 3,53±0,21 | 1,9±0,1 | 12,7±0,7 | 3,7±0,07 | 3,45±0,08 | 3,01±0,03 |
C-пептид нгмл | 0,73±0,02 | 0,15±0,01 | 1,48±0,03 | 1,59±0,08 | 0,83±0,12 | 1,06±0,03 |
Кортико-стерон нмольл | 354±24 | 609±21 | 456±6 | 414±15 | 321±9 | 357±18 |
Тироксин нмольл | 39,5±1,9 | 20,1±0,8 | 36,4±0,6 | 63±1,5 | 56±0,7 | 51±1 |
Трийод-тирониннмольл | 2,42±0,15 | 1,08±0,09 | 2,15±0,06 | 2,44±0,14 | 2,64±0,06 | 1,88±0,03 |
Таблица 2
Среднее количество клеток в островках Лангерганса и их удельный объем
Животные без лечения | Пересадка культуры клеток ПЖЖ | Животные без лечения | Пересадка культуры клеток ПЖЖ | |
6-й день | 5,68±0,14 | 20,18±3,78* | 0,0634±0,0051 | 0,1287±0,0078* |
10-й день | 5,74±0,12 | 41,21±2,44* | 0,0652±0,0061 | 0,1835±0,0102* |
14-й день | 5,54±0,21 | 77,25±1,42* | 0,0599±0,0034 | 0,3458±0,0122* |
30-й день | 5,55±0,15 | 85,25±1,12* | 0,0541±0,0075 | 0,3745±0,0145* |
3 месяца | 5,12±0,22 | 84,14±1,19* | 0,0557±0,0054 | 0,3798±0,0123* |
6 месяцев | 5,01±0,24 | 84,79±1,04* | 0,0412±0,0102 | 0,3576±0,0178* |
12 месяцев | -** | 83,97±1,45 | -** | 0,3443±0,0158 |
Примечания: среднее количество клеток в островках в контрольной группе составило 41,01±0,24, перед лечением у диабетических животных -5,67±0,13;
* — разница между изучаемым и предыдущим показателем достоверна (р<0,05);
** — ни одно животное без лечения не прожило более 9 месяцев.
Через неделю после трансплантации культуры клеток ПЖ в поджелудочной железе экспериментальных животных наблюдали регенерацию островков Лангерганса возле протоков поджелудочной железы (табл. 2). В составе островковой ткани определялись все типы клеток. По данным литературы источником регенерации эндокринных клеток являются клетки стенки мелких протоков поджелудочной железы, которые начинают пролиферировать под воздействием факторов роста, выделяемых клетками пересаженной культуры, и дифференцироваться в эндокринные клетки. Количество вновь образованных островков было меньше по сравнению с нормой. В поджелудочной железе через 14 дней после трансплантации наблюдается гипертрофия островков Лангерганса, их удельный объем составил 0,3458±0,025, что в 2,67 раза меньше, чем в норме, и в 5,77 раза больше, чем у животных без лечения. Однако размер островков был больше, чем в норме, на 1,88 раза (среднее число клеток в островке составило 77,25±1,42), что говорит о том, что уже к 14 дню после введения трансплантата вновь образованные островки достигают размеров, сравнимых с размерами нормальных островков.
Заключение
При аллоксановом диабете наблюдаются изменения в организме животных, характерные для сахарного диабета 1 типа. Трансплантация культур эндокриноцитов поджелудочной железы кролика позволяет эффективно корригировать уровень гликемии при сахарном диабете у экспериментальных животных, а также приводит к эндокринной коррекции нарушений, вызванных аллоксановым диабетом. За счет повышения концентрации инсулина и С-пептида уменьшается уровень гликемии, снижается содержание контринсулярных гормонов, а также стабилизируются биохимические показатели крови (глюкоза, триглицериды, липопротеиды). При гистологическом исследовании отмечалась пролиферация и регенерация сохранившихся островков Лангерганса через 2 недели после введения культуры клеток поджелудочной железы. Таким образом, продемонстрировано влияние аллоксанового диабета на углеводный, белковый и жировой виды обмена и возможность их коррекции стимуляцией регенерации собственной эндокринной части поджелудочной железы путем трансплантации ксеногенной культуры клеток.
Рецензенты:
Кубышкин А.В., д.м.н., профессор, зав. кафедрой общей и клинической патофизиологии Медицинской академии имени С.И. Георгиевского ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского» Министерства образования и науки Российской Федерации, г. Симферополь;
Ильченко Ф.Н., д.м.н., профессор, заведующий кафедрой хирургии № 2 Медицинской академии имени С.И. Георгиевского ФГАОУ ВО «Крымский федеральный университет имени В.И. Вернадского» Министерства образования и науки Российской Федерации, г. Симферополь.
Библиографическая ссылка
Михайличенко В.Ю., Столяров С.С., Старых А.А. ПАТОФИЗИОЛОГИЧЕСКИЕ АСПЕКТЫ РАЗВИТИЯ АЛЛОКСАНОВОГО САХАРНОГО ДИАБЕТА У КРЫС В ЭКСПЕРИМЕНТЕ // Современные проблемы науки и образования. – 2015. – № 5.;
URL: https://science-education.ru/ru/article/view?id=21551 (дата обращения: 08.08.2019).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Гати Моханнад Абдулраззак Гати
1
Федорин Д.Н.
1
Полякова-Семенова Н.Д.
1
Вашанов Г.А.
1
Епринцев А.Т.
1
1 ФГБОУ ВПО «Воронежский государственный университет»
С помощью экзогенного аллоксана была создана модель экспериментального диабета у крыс. Для экспериментальных животных выявлено изменение концентрации глюкозы и гликогена в крови, массы тела и внутренних органов. Показаны выраженные признаки токсического гепатита в паренхиме печени животных в виде нарушения балочной структуры долек, некроза гепатоцитов, наличия инфильтратов из скоплений гематогенных клеток. Кроме того, выявлены патоморфологические изменения в островковой части поджелудочной железы, носящие выраженный деструктивный характер. Установлено, что аллоксановый диабет индуцирует активность ферментов, осуществляющих функционирование цикла трикарбоновых кислот в печени, почках и поджелудочной железе. Увеличение активности маркерного фермента ЦТК и митохондриальных форм МДГ и АГ убедительно свидетельствует об интенсификации катаболизма, обусловливающего повышение энергетического потенциала, необходимого для осуществления адаптивной реакции. Показано, что индукция активности СДГ, АГ и МДГ осуществляется по механизму синтеза de novo, о чем свидетельствуют полученные данные об уровнях экспрессии генов sdha, mdh_mtx и aco.
диабет
гистология
регуляция
изофермент
сукцинатдегидрогеназа
малатдегидрогеназа
аконитатгидратаза
экспрессия генов
1. Волкова О.В. Основы гистологии с гистологической техникой / О.В. Волкова, Ю.К. Елецкий. – М.: Медицина, 1971. – C. 272.
2. Епринцев А.Т. Глиоксилатный цикл: универсальный механизм адаптации? / А.Т. Епринцев, В.Н. Попов, М.Ю. Шевченко. – М.: ИКЦ «Академкнига», 2007. – 228 с.
3. Епринцев А.Т. Полимеразная цепная реакция как универсальный метод диагностики и идентификации генов / А.Т. Епринцев, Е.А. Москалёв, В.Н. Попов // Системный анализ и управление в биомедицинских системах. – 2001. – № 1. – C. 9–14.
4. Епринцев А.Т. Экспрессия и регуляция ферментов глиоксилатного цикла / А.Т. Епринцев, В.Н. Попов, М.Ю. Шевченко. – Воронеж: Центрально-Черноземное книжное изд-во, 2005. – 224 с.
5. Жураковская О.Я. Изменение структуры вентромедиального ядра гипоталамуса крыс разного возраста при эксперементальном сахарном диабете // Морфология. – 2013. – Т. 143, № 1. – С. 16–22.
6. Лавдовский М.Д. Основания к изучению микроскопической анатомии человека и животных. – СПб., 1887. – 1105 c.
7. Лакин Г.Ф. Биометрия. – М.: Высшая школа, 1990. – 352 с.
8. Лили Р. Патогистологическая техника и практическая гистохимия. – М.: Мир, 1969. – С. 102–108, 157–167.
9. Chomczynski P. Single-Step Method of RNA Isolation by Acid Guanidinium Thiocyanate-Phenol-Chloroform Extraction / P. Chomczynski, N. Sacchi // Anal. Biochem. – 1987. – Vol. 162. – P. 156–159.
10. Popov V.N. Glioxilate cycle enzymes are present in liver peroxisomes of alloxan-treated rats // FEBS Lett. 1998. – Vol. 440. – P. 55–58.
Адаптация животного организма к аллоксановому экспериментальному диабету представляет сложный многоэтапный процесс, главным звеном которого является трансформация клеточного метаболизма. Индукция ферментов глиоксилатного цикла и цикла трикарбоновых кислот в тканях животных обеспечивает изменение основных путей метаболизма, обусловленных ресинтезом гликогена в печени крыс при патологиях, связанных с условиями пищевой депривации и экспериментального диабета [2, 10]. Кроме того, что глюконеогенез выступает как важнейший процесс при адаптивной реакции организма к экстремальным условиям, важную роль играет энергетический обмен, связанный, главным образом с функционированием цикла Кребса. Следовательно, адаптация клеточного метаболизма обеспечивается соотношением интенсивности катаболизма и анаболизма глюкозы в клетках печени и других органов животного организма. Несмотря на значительное количество исследований об интенсивности ферментативной активности, обусловливающей скорость энергетического и синтетического процессов, остаются невыясненными многие факторы регуляции, такие как концентрация метаболитов, воздействие гормонов и другие [4].
В литературе широко представлены работы об особенностях клинико-биохимических показателей при сахарном диабете. Данные морфологических исследований немногочисленны и зачастую разноплановы. В последнее время большое внимание исследователей направлено на изучение состояния нейроэндокринных центров и выяснение их участия в регуляции функций панкреатических островков [5].
Особый интерес вызывает молекулярный уровень регуляции ферментов ЦТК и глиоксилатного цикла, связанный с экспрессионной регуляцией ферментов. Ранее было показано наличие двух изоформ аконитатгидратазы, малатдегидрогеназы. Однако исследований по генетической детерминации изоферментного полиморфизма этих и других ферментных систем в животных организмах в условиях экспериментального диабета нами не обнаружено. В связи с этим целью данной работы являлось комплексное исследование физиолого-биохимических механизмов адаптации крыс при аллоксановом диабете.
Материалы и методы исследования
В качестве объектов исследования служили самцы лабораторных крыс (Rattus rattus L.) массой 200–250 гр., выращенные в виварии при стандартном рационе. Индукцию диабета у исследуемых животных вызывали введением внутрибрюшинно 5 % раствора аллоксана из расчета 100 мг на кг веса животного в 0,9 % растворе NaCI. Контрольные животные выращивались при обычном пищевом режиме, без введения аллоксана.
Для получения ткани печени, почек и поджелудочной железы опытных животных подвергали краниоцервикальной дислокации под эфирным наркозом.
Определение глюкозы производили стандартным глюкозооксидазным методом с помощью глюкометра «Сателлит плюс» (Россия).
Определение активности ферментов проводили при 25 °С с помощью спектрофотометрических методов [4].
Для выделения суммарной клеточной РНК использовался метод фенол-хлороформной экстракции с использованием в качестве осадителя LiCl [9].
Полимеразную цепную реакцию генспецифичными праймерами проводили с помощью набора реактивов AmpliSence (Хеликон, Россия) на приборе Bio-Rad DNA Engine Thermal Cycler Chromo 4 (Bio-Rad, США), используя в качестве красителя SYBR Green. Параметры амплификации: предварительная денатурация 95 °С – 5 мин, затем цикл: 95 °С – 20 с, 58 °С – 30 с, 72 °С – 40 с (детекция), финальная элонгация – 72 °С – 10 мин.
Фиксацию материала осуществляли по методике, предложенной Волковой [1]. Образцы уплотняли для последующей работы на микротоме. Предварительно образцы обезвоживали путем погружения на 24 часа в растворы спиртов разных концентраций. Заливку проводили инкубацией образцов в смесь ксилол-парафин и затем в жидкий парафин на 1–2 ч при 52–56 °С. Срезы приготавливали при помощи микротома 4/MedGV (Micros, Германия) [6]. Окраску препарата проводили с применением гематоксилин-эозина по ранее разработанной методике [8].
Опыты проводили в 3–4-кратной повторности, аналитические определения для каждой пробы осуществляли в трех повторностях [7].
Результаты исследования и их обсуждение
Введение аллоксана подопытным животным способствовало увеличению концентрации глюкозы в крови до 15,8 ммоль/л через 10 дней после инъекции. Проведение данных анализов в динамике в течение 21 дня позволило выявить определенные закономерности. Максимальное значение этого показателя в крови опытных крыс достигало 17,31 ммоль/л. Следовательно, при экспериментальном сахарном диабете происходила мобилизация эндогенных сахаров, которые в печени крысы представлял гликоген.
Анализ полученных данных позволяет выявить определенные тенденции в изменении исследуемых показателей. Так, масса тела контрольных животных увеличивалась в течение всего эксперимента. Ее колебания составляли от 197 г в первый день до 217 г на 21 день. Следовательно, крысы контрольной группы увеличивали свою массу в течение всего опыта на 11,3 %. Противоположная картина обнаружена для данного показателя в экспериментальной группе животных. Динамика изменения массы печени и почек не являлась одинаковой для этих органов. Масса печени, составлявшая 6,49 г в начале опыта у контрольных животных, достигала величины 6,7 г. У экспериментальных животных после введения экзогенного аллоксана масса этого органа уменьшилась с 6,35 до 4,83 г через 21 день экспозиции, что означало 24 %-е снижение массы печени.
Анализ полученных результатов по изменению массы тела и внутренних органов крыс позволяет предположить, что выявленные эффекты связаны с действием экспериментального диабета.
Анализ данных гистологических исследований образцов печени крыс экспериментальной группы свидетельствовал о том, что применение аллоксана вызывало индукцию сахарного диабета, проявляющегося в изменении морфологических особенностей тканей исследуемого органа. В целом при экспериментальном аллоксановом диабете в паренхиме печени исследуемых животных прослеживались выраженные признаки токсического гепатита в виде нарушения балочной структуры долек, некроза гепатоцитов, жировой и белковой дистрофии, наличия инфильтратов из скоплений гематогенных клеток.
Морфологические изменения в ткани поджелудочной железы крыс после введения аллоксана характеризовались наиболее выраженными дегенеративными изменениями в центральных отделах островков Лангерганса (рис. 1). Количество β-клеток в островках резко снижено, в большинстве из них отмечалась вакуолизация цитоплазмы, уменьшение размеров ядер, конденсация хроматина, в некоторых клетках – кариопикноз. Выявлено наличие лимфоцитарного инфильтрата по периферии части островков, отека междольковой соединительной ткани, полнокровие капилляров; в сосудах прослеживались стазы.
а 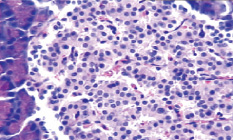 б
б 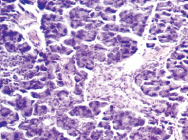
Рис. 1. Островковый аппарат поджелудочной железы крысы интактной группы (А) и после введения аллоксана (Б). Окраска гематоксилином-эозином; об. х20
Таким образом, цитотоксическое воздействие аллоксана и инсулиновая недостаточность вызывали патоморфологические изменения в островковой части поджелудочной железы, носящие выраженный деструктивный характер, причем токсическому воздействию в наибольшей степени подвергались β-клетки и компоненты микроциркуляторного русла.
Результаты исследования показали, что в печени крыс с аллоксановым диабетом наблюдается активация маркерного фермента ЦТК – сукцинатдегидрогеназы (СДГ), активность которого увеличилась у опытных животных в 1,77 раза. Увеличение активности сукцинатдегидрогеназы в печени крыс свидетельствует об интенсификации функционирования цикла Кребса в условиях аллоксанового диабета, что, по-видимому, необходимо для энергизации клеточного дыхания и усиления поставок энергетических эквивалентов АТФ, НАДН для адаптации клеточного метаболизма в гепатоцитах.
Активность цитоплазматической формы малатдегидрогеназы (МДГ) в образцах опытных животных составляет 9,38 Е/мг белка, а в контрольных – 4,36 Е/мг белка. Однако иная картина наблюдалась при анализе изменения активности митохондриальной формы малатдегидрогеназы. У крыс в условиях аллоксанового диабета обнаружено резкое увеличение скорости функционирования МДГ в 3,96 раза относительно контрольного варианта.
В наших исследованиях было показано, что активность цитоплазматической аконитатгидратазы (АГ) в опытных образцах по сравнению с контролем уменьшилась в 3,8 раза. Что касается митохондриальной формы, то здесь наблюдается увеличение активности в 3 раза относительно контрольного варианта. В гепатоцитах доминируют реакции синтетического или конструктивного характера, в частности, глюконеогенез, одним из этапов которого является ГЦ. Именно в протекании данного пути принимает участие аконитатгидратаза.
Уровень активности сукцинатдегидрогеназы в исследуемом органе нормальных крыс составлял 0,4 Е/мг белка. У экспериментальных животных поджелудочная железа имела невысокий уровень активности СДГ равный 0,14 Е/мг белка, то есть экспериментальный диабет подавлял функционирование маркерного фермента.
Изменение активности малатдегидрогеназы в разных фракциях клеток поджелудочной железы в контроле и опыте имело определенные тенденции. Уровень активности изучаемого фермента в клетках поджелудочной железы крыс, подвергшихся воздействию аллоксанового диабета, был выше по сравнению с опытными животными.
Уровень активности аконитатгидратазной ферментной системы определяет направление реакций так называемого аконитазного равновесия. Величина аконитазной активности в поджелудочной железе в опытных вариантах возрастала в 2–2,5 раза и составляла значение 0,25 Е/мг белка для цитоплазматической формы и 2,5 Е/мг белка для митохондриального фермента. Следовательно, повышение интенсивности функционирования аконитатгидратазного ферментного комплекса наблюдается как в цитоплазматической фракции, так и в митохондриальной.
Результаты исследования ПЦР-РВ приведены на рис. 2, из которого видно, что в печени крыс при пищевой депривации концентрация транскрипта исследуемого генов МДГ выше такового показателя у контрольных в более чем в 2 раза, что свидетельствует об интенсификации их экспрессии.
Расчетные значения относительной концентрации кДНК гена митохондриальной аконитатгидратазы и сукцинатдегидрогеназы в разных образцах отличаются между собой. Из полученных данных видно, что в печени крыс с аллоксановым диабетом концентрация их транскриптов выше такового показателя у контрольных почти в 3 раза.
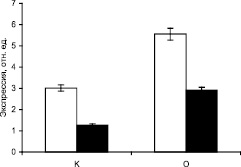
Рис. 2. Экспрессия генов малатдегидрогеназы в печени крыс в норме и при аллоксановом диабете. К – контрольные животные, О – животные с аллоксановым диабетом
Данные по экспрессии генов СДГ, МДГ, АГ свидетельствуют, что при диабете активация ферментов происходит на уровне транскрипции соответствующих генов. В условиях аллоксанового диабета наблюдается изменение транскрипционной активности ДНК клеток печени, следовательно, увеличивается скорость экспрессия исследуемых генов.
Заключение
Использование в нашем исследовании экзогенного аллоксана, вводимого подкожно крысам, позволило создать модель экспериментального диабета у животных. Индукция диабета наблюдалась в течение трехнедельного эксперимента. У опытных животных было выявлено изменение массы тела и внутренних органов, характерное для данного заболевания. Проведенные гистологические исследования тканей печени и поджелудочной железы также свидетельствуют о патологических изменениях у экспериментальных крыс, при этом наибольшее токсическое действие наблюдалось печени исследуемых животных.
Использование методов молекулярной биологии позволило установить, что индукция активности СДГ, АГ и МДГ осуществляется благодаря синтезу de novo. Это вытекает из полученных данных, свидетельствующих о резком повышении уровня экспрессии генов sdha, mdh_mtx и aco, кодирующих эти энзимы.
Таким образом, показано, что адаптация крыс к условиям аллоксанового диабета осуществляется на нескольких уровнях. Патоморфологические изменения в островковой части поджелудочной железы и нарушение балочной структуры долек гепатоцитов сопряжены с трансформацией основных путей клеточного метаболизма, обеспечиваемой изменением функционирования ключевых ферментов цикла Кребса и глиоксилатного пути (СДГ, МДГ и АГ).
Рецензенты:
Свистова И.Д., д.б.н., профессор кафедры биологии растений и животных, ФГБОУ ВПО «Воронежский государственный педагогический университет», г. Воронеж;
Алабовский В.В., д.м.н., профессор, зав. кафедрой биохимии, ФГБОУ ВПО «Воронежская государственная медицинская академия имени Н.Н. Бурденко», г. Воронеж;
Хисматуллина З.Р., д.б.н., профессор, доцент, заведующая кафедрой морфологии и физиологии человека и животных биологического факультета, ГОУ ВПО «Башкирский государственный университет», г. Уфа.
Работа поступила в редакцию 16.12.2013.
Библиографическая ссылка
Гати Моханнад Абдулраззак Гати, Федорин Д.Н., Полякова-Семенова Н.Д., Вашанов Г.А., Епринцев А.Т. ФИЗИОЛОГО-БИОХИМИЧЕСКИЕ АСПЕКТЫ АДАПТАЦИИ КРЫС К УСЛОВИЯМ АЛЛОКСАНОВОГО ДИАБЕТА // Фундаментальные исследования. – 2013. – № 11-3. – С. 465-469;
URL: https://fundamental-research.ru/ru/article/view?id=33144 (дата обращения: 03.11.2019).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник