Что активирует ферменты поджелудочной железы

Пищеварительные ферменты сока железы играют главную роль в переваривании пищи. От правильной работы и нормальной экзокринной функции ПЖ зависит работа пищеварительного тракта. Жиры, белки и углеводы в их первоначальном виде, в котором они поступают в организм, не могут сразу всасываться и принимать участие в дальнейших биохимических реакциях. В процессе пищеварения происходит расщепление компонентов пищи на их составляющие, которые в дальнейшем принимают участие в основном процессе метаболизма. Это происходит благодаря содержимому панкреатического сока. Таким образом, поддерживается деятельность всех органов и систем, сбалансированное существование организма.
Какие ферменты вырабатывает поджелудочная железа?
Выявлено, что в поджелудочной железе вырабатывается пищеварительный сок, содержащий больше 20 ферментов. Количество фермента секрета ПЖ и его активность зависят от качества и объема употребляемой пищи. Стимулировать его выделение могут желчные кислоты. Все синтезируемые энзимы объединяются в 3 группы:
- липаза — воздействует на жиры, расщепляя их на жирные кислоты, всасывающиеся в кишечнике;
- протеаза — разрывает связи в молекулах белка до образования составляющих их аминокислот;
- амилаза — расщепляет полисахариды (крахмал, гликоген) до глюкозы, которая всасывается в кровь.

Промежуточным продуктом расщепления углеводов пищи являются олигосахариды (части крупной молекулы) – они образуются под воздействием амилазы. Дальнейшее превращение происходит благодаря другим энзимам из ее группы: мальтазы, лактазы, инвертазы.
Эти ферменты разрывают связи в молекулах олигосахаридов до образования глюкозы – главного источника энергии, которая уже поступает в кровь.
Каждый энзим из группы амилазы выполняет свои функции: например, лактаза предназначена для расщепления молочного сахара — лактозы.
Липаза воздействует на жиры, которые в своем первоначальном виде не попадают в сосуды. Она превращает их в глицерин и жирные кислоты. В группу ферментов, воздействующих на липиды, входит также холестераза.
Протеазы по своему воздействию являются гидролазами: они расщепляют пептидные связи в белковых молекулах. Их гидролитические функции одинаковы у экзопротеаз, вырабатываемых самой ПЖ (карбоксипептидаза) и расщепляющих внешние пептидные связи в белках и у эндопротеаз:
- пепсин;
- химозин;
- гастриксин;
- трипсин;
- химотрипсин;
- эластаза.
Их функции:
- Трипсин превращает белок в пептиды.
- Карбоксипептидаза расщепляет пептиды до аминокислот.
- Эластаза воздействует на протеины и эластин.

Все ферменты, содержащиеся в панкреатическом соке, являются неактивными. Лишь в тонкой кишке, куда они попадают через главный проток железы, происходит их активация под воздействием энтерокиназы (фермента тонкой кишки). Этот энзим, в свою очередь, активируется только в присутствии желчи в просвете кишечника: трипсиноген превращается в трипсин. Он играет основную роль для дальнейшего процесса пищеварения: при его участии активируются другие ферменты.
Все энзимы начинают вырабатываться железой, как только пищевой комок достигает двенадцатиперстной кишки. Этот процесс занимает 12 часов. Качественный и количественный состав энзимов зависит от употребляемой еды. В сутки выделяется больше литра панкреатического сока.
Симптомы недостатка и переизбытка выработки ферментов
Для нормального переваривания пищи необходимо наличие в вырабатываемом поджелудочном соке достаточного количества энзимов. Выявлено несколько патологий, связанных с недостаточным синтезом ферментов. По механизму развития они относятся к пищевой непереносимости.
Ферментная недостаточность может возникать при рождении или быть приобретенной. Первый вариант развивается как результат генных поломок, во втором случае развитие патологии происходит на фоне изменений в паренхиме поджелудочной железы.

Причины, приводящие к приобретенному недостатку выработки ферментов, могут быть различными, иногда не зависящие изначально от состояния железы, а связаны с внешним воздействием или изменениями во внутренних органах. На первом месте находится любая патология ПЖ, но фактором нарушений могут стать:
- любые тяжело протекающие болезни органов и систем человека;
- неблагоприятная экологическая обстановка;
- гиповитаминоз и недостаток микроэлементов, а также белковая недостаточность в питании;
- лекарственные интоксикации;
- инфекционные заболевания;
- нарушение кишечной микрофлоры.
Все разнообразные причины, вызывающие иногда тяжелые изменения ферментативной активности, имеют общие клинические проявления. Степень их выраженности зависит от тяжести основного заболевания или интенсивности воздействующего фактора:
- сниженный аппетит;
- понос;
- метеоризм (вздутие живота) различной степени, отрыжки воздухом;
- тошнота и рвота, в тяжелых случаях — многократная, не приносящая облегчения;
- резкое похудение — иногда на фоне нормального питания;
- у детей — задержка физического развития.
Такая симптоматика свойственна и врожденной, и приобретенной ферментной недостаточности. В случае генной патологии это может проявляться с первых дней рождения и распознаваться общими симптомами: вялостью, плаксивостью малыша, беспокойством, срыгиваниями после еды, частым зловонным жидким стулом до 8 и более раз в сутки. Характерен вид стула: пенистый, обильный, с резким кислым запахом. Обычно это свидетельствует о нарушении углеводного обмена и ферментов, с ним связанными.
Состояние и клинические проявления напоминают кишечную инфекцию, поэтому для уточнения диагноза проводится ряд диагностических анализов. В результате обследования выявляют, недостаток какого конкретно фермента испытывает организм.
Сегодня изучено несколько патологий, связанных с малым количеством синтезируемых энзимов ПЖ:
- Лактазная недостаточность.
- Целиакия — нарушение расщепления глютена.
- Фенилкетонурия — дефицит аминокислоты.
Недостаточная продукция лактазы
Недостаточность продуцирования лактазы — энзима, расщепляющего молочный сахар (лактозу), проявляется с первых дней жизни ребенка. Железа не может секретировать лактазу. Полное отсутствие этого энзима или резкое снижение его выделения в полость тонкого кишечника может блокировать процесс расщепления лактозы. Она не всасывается в первоначальном виде и не усваивается организмом. Это проявляется повышенным аппетитом. Но ребенок остается голодным из-за отсутствия насыщаемости: лактоза не переваривается, не расщепляется в кишечнике и не всасывается.

При осмотре выявляется выраженное вздутие живота, болезненность при пальпации, частые отрыжки воздухом, срыгивания молоком после кормления. Частый зеленый стул с неприятным запахом может продолжаться через каждые 2–3 часа. Выражена постоянная плаксивость, капризность, плохой сон.
Целиакия
Проявляется у ребенка, когда начинается прикорм кашами. Развитие патологии связано с невозможностью ПЖ выработать протеолитический энзим, расщепляющий белок глиадин. Он содержится во всех злаках, за исключением риса, кукурузы, гречки. Желудок и кишечник не переваривают белок.
Поздняя диагностика и отсутствие своевременной терапии могут вызвать гибель пациента. Под воздействием глиадина у таких людей происходит атрофия клеток слизистой кишечника с нарушением всасывания белков, углеводов, жиров, витаминов, минералов. Развиваются тяжелые водно-электролитные расстройства и гипотрофия. Это сопровождается полифекалией, метеоризмом, задержкой психомоторного развития.
Фенилкетонурия
Фенилкетонурия — проявление недостаточности энзима ПЖ, расщепляющего фенилаланин (одной из аминокислот белка) и превращающего его в тирозин. Последний препятствует отложению жиров, снижает аппетит, улучшает функции других эндокринного аппарата — гипофиза, щитовидной железы, надпочечников. Накапливающиеся в организме продукты нарушения гидролиза фенилаланина токсически действуют на клетки нервной системы. С первых дней жизни появляется неукротимая рвота, возникающая сразу после кормления. Это напоминает пилороспазм или стеноз луковицы ДПК. Специфическим является повышенная потливость с мышиным запахом пота и мочи, беспокоят также:
- постоянная слабость;
- сонливость;
- раздражительность;
- судорожные припадки;
- уменьшение размеров головы;
- кожные изменения.

В дальнейшем состояние ухудшается: происходит отставание в физическом и психическом развитии — ребенок поздно начинает сидеть, ходить, разговаривать (у 60% детей с такой патологией к 3–4-летнему возрасту развивается идиотия — полное отсутствие мышления и речи).
Основным и единственным на данный момент методом лечения этих врожденных нарушений ПЖ является диета. Иногда (при лактазной недостаточности) назначается прием лактазы внутрь.
Переизбыток ферментов
Избыток выработки энзимов происходит при панкреатите. Клинические проявления аналогичны симптомам недостаточной панкреатической секреции: боли в животе, частый жидкий стул, тошнота, многократная рвота без облегчения состояния, метеоризм. Выраженность каждого признака зависит от масштабов поражения паренхимы ПЖ. В тяжелых случаях нарушается не только внешнесекреторная функция железы, но и инкреторная: воспалительный процесс затрагивает островки Лангерганса — структуры, синтезирующие гормоны. Если погибают бета-клетки, продуцирующие инсулин, происходит подавление процессов углеводного обмена с развитием сахарного диабета.
Методы диагностики патологий
Для диагностики функционального состояния ПЖ применяют биохимические и инструментальные методы исследования.
Помимо этого, определяют функции печени — билирубин, трансаминазы, общий белок и его фракции, глюкозу крови.

В моче выявляют наличие аминокислот.
Для выявления фенилкетонурии – врожденной патологии ПЖ – применяется определение фенилаланина в крови. Эти анализы проводятся в родильных домах у всех новорожденных на 4–5 день жизни. По рекомендации ВОЗ, патология включена в список наследственных заболеваний, рекомендованных для ранней диагностики.
Целиакия выявляется методами серологической диагностики с определением антител и антигенов при глютеновой непереносимости.
Лактазная недостаточность подтверждается результатами исследований крови и анализом лактозной кривой: проводится стимуляция лактозой — пациенту дается лактоза в маленькой дозировке, затем исследуется кровь. А также определяется уровень лактозы в моче, куда она поступает в незначительных количествах.
Инструментальные методы исследования применяются для дифдиагностики и исключения органического поражения тканей ПЖ или наличия конкрементов, кист, воспалительных процессов. Проводятся:
- УЗИ;
- КТ;
- МРТ.
Какие анализы необходимо сдать для определения ферментов?
Изучаются анализы крови и мочи на активность основных ферментов:
- амилазы;
- трипсина;
- липазы.
Копрограмма при наличии непереваренных мышечных волокон, жиров, частиц крахмала указывает на недостаточное ферментное содержимое.
Основной показатель при изучении анализа кала — эластаза. Ее снижение может помочь вылечить болезнь и заставить нормально функционировать пищеварительные органы.
Медикаментозное лечение патологий
При хроническом панкреатите, когда процесс обусловлен недостаточным поступлением энзимов (в отличие от острого, с развитием панкреонекроза), основным методом лечения является ферментозамещающая терапия. Назначается энзимный препарат, который нормализует работу внутренних органов. Одновременно необходима диета, которую нужно соблюдать длительное время, иногда — пожизненно, это зависит от степени энзимной недостаточности.

Коррекция экзокринной недостаточности проводится по уровню липазы — незаменимому энзиму, который вырабатывается в полном объеме самой ПЖ. Поэтому активность лекарства, которое выбирается для заместительной терапии, рассчитывается в липазных единицах — ЛЕ. В аннотации к любому из них указаны эти данные — количество липазы в ЛЕ. Список ферментов для коррекции пищеварения обширный. Доза, кратность и длительность приема назначается и контролируется врачом и зависит от степени недостаточности.
Сегодня наиболее эффективным является Креон – двухоболочечный препарат. В его производстве используются инновационные технологии: в одной капсуле содержится большое количество кишечнорастворимых микросфер, содержащих фермент. Это улучшает всасывание энзима: он не подвержен разрушению соляной кислотой в желудке, поскольку она не действует на капсулу. Выход фермента из микросфер и переваривание им пищи происходит в просвете ДПК. Его применение удобно тремя существующими дозировками: 10000, 25000 и 40000 МЕ липазы.
Лекарство можно назначать ребенку и взрослому пациенту с тяжелым течением панкреатита, когда необходимы высокие дозы препарата.
Параллельно назначается симптоматическое лечение, которое заключается в приеме спазмолитиков, обезболивающих, препаратов, снижающих секрецию желудком соляной кислоты, процессы газообразования в кишечнике. Терапия может проводиться в амбулаторных условиях дома, но под контролем специалиста.
Список литературы
- Полтырев С.С., Курцин И.Т. Физиология пищеварения. М. Высшая школа. 1980 г.
- Коровина И. А. Экзокринная недостаточность поджелудочной железы: проблемы и решения. М.: Анахарсис, 2001 г. стр. 48.
- Коротько Г.Ф. Секреция поджелудочной железы. М.: «ТриадаХ» 2002 г. стр. 223.
- Русаков В.И. Основы частной хирургии. Издательство Ростовского Университета 1977 г.
- Хрипкова А.Г. Возрастная физиология. М. Просвещение 1978 г.
Источник
В
поджелудочной железе синтезируются
проферменты ряда протеаз: трипсиноген,
химотрипсиноген, проэластаза,
прокарбоксипептидазы А и В. В кишечнике
они путём частичного протеолиза
превращаются в активные ферменты
трипсин, химотрипсин, эластазу и
карбок-сипептидазы А и В.
Активация
трипсиногена происходит
под действием фермента эпителия
кишечника энтеропептидазы.
464
Этот
фермент отщепляет с N-конца молекулы
трипсиногена гексапептид Вал-(Асп)4-Лиз.
Изменение конформации оставшейся части
полипептидной цепи приводит к формированию
активного центра, и образуется активный
трипсин. Последовательность Вал-(Асп)4-Лиз
присуща большинству известных
трипсиноге-нов разных организмов — от
рыб до человека.
Образовавшийся
трипсин активирует
химотрипсиноген, из
которого получается несколько активных
ферментов (рис. 9-3). Химотрипсиноген
состоит из одной полипептидной цепи,
содержащей 245 аминокислотных остатков
и пяти дисульфидных мостиков. Под
действием трипсина расщепляется
пептидная связь между 15-й и 16-й
аминокислотами, в результате чего
образуется активный π-химотрипсин.
Затем под действием π-химотрипсина
отщепляется дипептид сер(14)-арг(15), что
приводит к образованию δ-химотрипсина.
Отщепление дипептида тре(147)-арг(148)
завершает образование стабильной формы
активного фермента — α-химотрипсина,
который состоит из трёх полипептидных
цепей, соединённых дисульфидными
мостиками.
Остальные
проферменты панкреатических протеаз
(проэластаза и прокарбоксипептидазы
А и В) также активируются трипсином
путём частичного протеолиза. В результате
образуются активные ферменты — эластаза
и карбокси-пептидазы А и В.
2. Специфичность действия протеаз
Трипсин
преимущественно гидролизует пептидные
связи, образованные карбоксильными
группами аргинина и лизина. Химотрипсины
наиболее активны в отношении пептидных
связей, образованных карбоксильными
группами ароматических аминокислот
(Фен, Тир, Три).
Карбоксипептидазы
А и В — цинксодержащие ферменты, отщепляют
С-концевые остатки аминокислот. Причём
карбоксипептидаза А
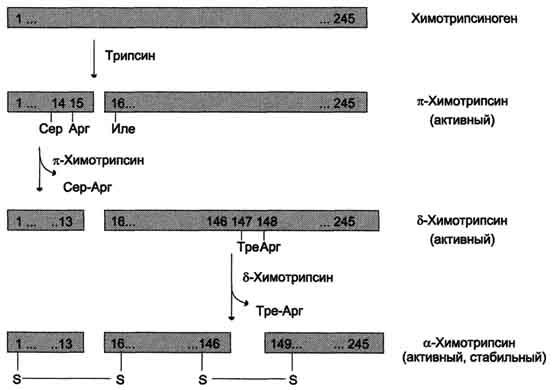
Рис.
9-3. Активация химотрипсиногена. Молекула
химотрипсиногена состоит из 245
аминокислотных остатков и имеет пять
дисульфидных мостиков. На схеме показаны
участки фермента, подвергающиеся
протеолизу. а-Химотрипсин — активная
стабильная форма фермента — состоит из
трёх полипептидных цепей, ковалентно
связанных между собой двумя дисульфидными
мостиками и нековалентно — за счёт
водородных связей и гидрофобных
взаимодействий.
465
отщепляет
преимущественно аминокислоты, содержащие
ароматические или гидрофобные радикалы,
а карбоксипептидаза В — остатки аргинина
и лизина.
Последний
этап переваривания — гидролиз небольших
пептидов, происходит под действием
ферментов аминопептидаз и дипептидаз,
которые синтезируются клетками тонкого
кишечника в активной форме.
Аминопептидазы последовательно
отщепляют N-концевые аминокислоты
пептидной цепи. Наиболее известна
лейцинаминопептидаза — Zn2+-
или Мn2+-содержащий
фермент, несмотря на название, обладающий
широкой специфичностью по отношению
к N-концевым аминокислотам.Дипептидазы расщепляют
дипептиды на аминокислоты, но не
действуют на трипептиды.
В
результате последовательного действия
всех пищеварительных протеаз большинство
пищевых белков расщепляется до свободных
аминокислот.
В.
Защита клеток от действия протеаз
Клетки
поджелудочной железы защищены от
действия пищеварительных ферментов
тем, что:
эти
ферменты образуются
в виде неактивных предшественников в
клетках поджелудочной железы и
активируются только после секреции в
просвет кишечника. Таким образом, место
синтеза и место действия этих ферментов
пространственно разделены.в
клетках поджелудочной железы
присутствует белок-ингибитор
трипсина, образующий
с активной формой фермента (в случае
преждевременной активации) прочный
комплекс.
В
полости желудка и кишечника протеазы
не контактируют с белками клеток,
поскольку слизистая оболочка покрыта
слоем слизи, а каждая клетка содержит
на наружной поверхности плазматической
мембраны полисахариды, которые не
расщепляются протеазами и тем самым
защищают клетку от их действия.
Разрушение
клеточных белков протеазами происходит
при язвенной болезни желудка или
двенадцатиперстной кишки. Однако
начальные механизмы возникновения
язвы ещё мало изучены.
Г.
Транспорт аминокислот в клетки
Аминокислоты,
образовавшиеся при переваривании
белков, быстро всасываются в кишечнике.
Транспорт их осуществляется двумя
путями: через воротную систему печени,
ведущую прямо в печень, и по лимфатическим
сосудам, сообщающимся с кровью через
грудной лимфатический проток. Максимальная
концентрация аминокислот в крови
достигается через 30-50 мин после приёма
белковой пищи (углеводы и жиры замедляют
всасывание аминокислот). Всасывание
L-аминокислот (но не D-изомеров) — активный
процесс, требующий затраты энергии.
Аминокислоты переносятся через кишечную
стенку от слизистой её поверхности в
кровь (рис. 9-4). Перенос через щёточную
кайму осуществляется целым рядом
переносчиков, многие из которых действуют
при участии Nа+-зависимых
механизмов симпорта, подобно переносу
глюкозы (см. раздел 7).
Различная
скорость проникновения аминокислот
через мембраны клеток указывает на
наличие транспортных систем, обеспечивающих
перенос аминокислот как через внешнюю
плазматическую мембрану, так и через
внутриклеточные мембраны. В настоящее
время известно по крайней мере пять
специфических транспортных систем,
каждая из которых функционирует
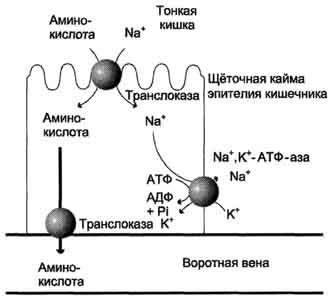
Рис.
9-4. Механизм всасывания аминокислот в
кишечнике. L-аминокислота
поступает в энтероцит путём симпорта
с ионом Na+.
Далее специфическая транслоказа
переносит аминокислоту через мембрану
в кровь. Обмен ионов натрия между
клетками осуществляется путём
первично-активного транспорта с помощью
Nа+,К+-АТФ-азы.
466
для
переноса определённой группы близких
по строению аминокислот:
нейтральных,
с короткой боковой цепью (аланин, серии,
треонин);нейтральных,
с длинной или разветвлённой боковой
цепью (валин, лейцин, изолейцин);с
катионными радикалами (лизин, аргинин);с
анионными радикалами (глутаминовая и
аспарагиновая кислоты);иминокислот
(пролин, оксипролин).
Причём
к числу Nа+-зависимых
относятся переносчики аминокислот,
входящих в первую и пятую группы, а
также переносчик метионина. Независимые
от Na+ переносчики
специфичны для некоторых нейтральных
аминокислот (фенилаланин, лейцин) и
аминокислот с катионными радикалами
(лизин).
Аминокислоты
конкурируют друг с другом за специфические
участки связывания. Например, всасывание
лейцина (если концентрация его достаточно
высока) уменьшает всасывание изолейцина
и валина.
Одна
из специфических транспортных систем
для некоторых нейтральных аминокислот
функционирует в кишечнике, почках и,
по-видимому, мозге. Она получила название
γ-глутамильного цикла (рис. 9-5).
В
этой системе участвуют 6 ферментов,
один из которых находится в клеточной
мембране, а остальные — в цитозоле.
Ключевую роль в транспорте аминокислоты
играет мембранно-связан-ный фермент
γ-глутамилтрансфераза. Этот
фермент является гликопротеином и
катализирует перенос γ-глутамильной
группы от глутатиона (иногда другого
γ-глутамильного пептида) на транспортируемую
аминокислоту и последующий перенос
комплекса в клетку. Глутатион представляет
собой трипептид — γ-глутамилцистеинилглицин,
который находится во всех тканях
животных. Реакция протекает следующим
образом (см. схему А на с. 468).
Аминокислота,
связанная с γ-глутамильным остатком,
оказывается внутри клетки. В следующей
реакции происходит отщепление
γ-глутамильного
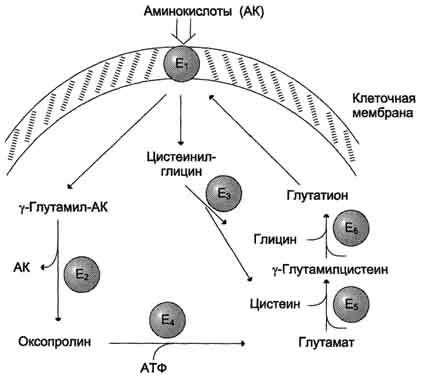
Рис.
9-5. γ-Глутамильный
цикл. Система
состоит из одного мембранного и пяти
цитоплазматических ферментов. Перенос
аминокислоты внутрь клетки осуществляется
в комплексе с глутамильным остатком
глутатиона под действием
γ-глутамилтрансферазы. Затем аминокислота
освобождается, а γ-глутамильный остаток
в несколько стадий превращается в
глутатион, который способен присоединять
следующую молекулу аминокислоты. Е1 —
γ-глутамилтрансфераза; Е2 —
у-глутамилциклотрансфераза; Е3 —
пептидаза; Е4 —
оксопролиназа; Е5 —
γ-глутамилцистеинсинтетаза; Е6 —
глутатионсинтетаза.
467
остатка
под действием фермента
γ-глутамилциклотрансферазы (см. схему
Б).
Дипептид
цистеинилглицин расщепляется под
действием пептидазы на 2 аминокислоты
— цис-теин и глицин. В результате этих
3 реакций происходит перенос одной
молекулы аминокислоты в клетку (или
внутриклеточную структуру). Следующие
3 реакции обеспечивают регенерацию
глутатиона, благодаря чему цикл
повторяется многократно. Для транспорта
в клетку одной молекулы аминокислоты
с участием γ-глутамильного цикла
затрачиваются 3 молекулы АТФ.
Д.
Нарушение переваривания белков и
транспорта аминокислот
Небольшую
долю продуктов переваривания белка
составляют негидролизованные короткие
пептиды. У некоторых людей возникает
иммунная реакция на приём белка, что,
очевидно, связано со способностью к
всасыванию
таких
пептидов. Продукты полностью переваренного
белка (аминокислоты) лишены антигенных
свойств и иммунных реакций не вызывают.
У
новорождённых проницаемость слизистой
оболочки кишечника выше, чем у взрослых,
поэтому в кровь могут поступать антитела
молозива (секрет молочных желёз,
выделяющийся в первые дни после родов,
обогащённый антителами и антитоксинами).
Это усугубляется наличием в молозиве
белка — ингибитора трипсина. Протеолитические
ферменты в пищеварительных секретах
новорождённых обладают низкой
активностью. Всё это способствует
всасыванию в кишечнике небольшого
количества нативных белков, достаточного
для обеспечения иммунной реакции.
Очевидно, подобное усиление всасывающей
способности кишечника является причиной
наблюдаемой иногда непереносимости
белков пищи (например, молока и яиц) у
взрослых людей.
Гниение
Известно,
что микроорганизмы кишечника
для своего роста также нуждаются в
доставке с пищей определенных аминокислот.
Микрофлора кишечника располагает
набором ферментных систем, отличных
от соответствующихферментов животных тканей и
катализирующих самые разнообразные
превращения пищевых аминокислот.
В кишечнике создаются оптимальные
условия для образования ядовитых
продуктов
распада аминокислот: фенола,индола, крезола, скатола, сероводорода,
метилмер-каптана, а также нетоксичных
для организма соединений: спиртов, аминов, жирных
кислот,кетокислот, оксикислот и
др.
Все
эти превращения аминокислот,
вызванные деятельностью микроорганизмовкишечника,
получили общее название «гниение белков в
кишечнике». Так, в процессе
распада серосодержащих
аминокислот (цистин, цистеин, метионин)
в кишечнике образуются сероводород H2S
и метил-меркаптан CH3SH.
Диаминокислоты – орнитин и лизин –
подвергаются процессудекарбоксилирования с
образованием аминов –
путресцина и кадаверина.
Из
ароматических аминокислот: фенилаланин, тирозин и триптофан –
при аналогичном
бактериальном декарбоксилировании образуются
соответствующие амины: фенилэтиламин,
параоксифенилэтиламин (или тира-мин)
и индолилэтиламин (триптамин).
Кроме того, микробные ферментыкишечника
вызывают постепенное разрушение боковых
цепей циклическихаминокислот,
в частности тирозина и триптофана,
с образованием ядовитых продуктов
обмена – соответственно крезола и фенола, скатола и индола.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник