Цитология опухоли поджелудочной железы
Цитологическое исследование печени. Цитологическое исследование поджелудочной железы.
Цитологическое исследование материала при различных заболеваниях печени, полученного методом пункции, может оказать существенную помощь в постановке диагноза. Первичными опухолями печени чаще всего являются гепатоцеллюлярный и холангиоцеллюлярный рак. Заключение о наличии первичного рака основано на обнаружении в пунктатах печени при гепатоцеллюлярном раке атипичных эпителиальных клеток, сходных по морфологии с печеночными, расположенных преимущественно разрозненно, иногда в виде тяжей, групп, розеток, встречаются железисто-подобные структуры.
Клетки мелкие, средних размеров, крупные и очень крупные, преимущественно округлой формы. Ядра тоже крупные, чаще округлые, расположены центрально или несколько эксцентрично, нежные в одних клетках, грубые — в других, иногда просматриваются иуклеолы. Много дву- и многоядерных клеток с признаками атипии. Цитоплазма у большинства клеток обильная, негомогенная, содержит желчный пигмент в виде мелких пылевидных частиц или более крупных темных гранул. При холангиоцеллюлярном раке атипичные эпителиальные клетки расположены разрозненно, часто в виде железисто-подобных структур. Клетки преимущественно средних размеров неправильно округлой и призматической формы. Ядра крупные, занимают большую часть клетки, округлые или слегка овальные, часто расположены эксцентрично. Встречаются двуядерные клетки. Цитоплазма базофильная.
В отличие от первичных опухолей метастатические поражения печени (метастазы практически из любого органа) встречаются значительно чаще. Выявление в клетках признаков их морфологической и функциональной дифференцировки, характерной для первичной опухоли, может помочь установить диагноз вторичного поражения печени и определить первичную локализацию.
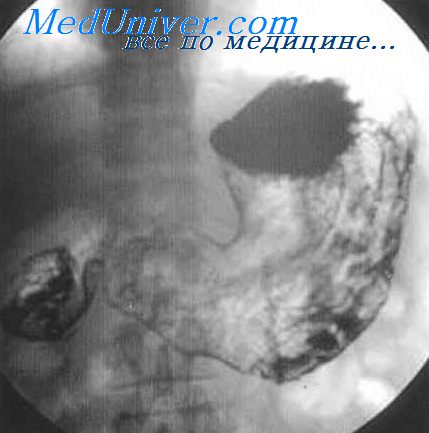
Цитологическая диагностика заболеваний поджелудочной железы представляет значительные трудности. Только в последнее время при эндоскопическом обследовании удается получить материал для цитологического анализа. В основном материал для исследования получают при пункции железы во время оперативного вмешательства. В этих случаях цитологически иногда удается разделить клетки по их характеристике и степени дифференцировки на клетки из опухолей протоков, экзокринной и эндокринной ее частей.
В кишечнике все опухоли классифицируют соответственно его отделам: новообразования тонкой кишки, червеобразного отростка, толстой кишки, анального канала и анального края. В последнее время в связи с широким применением эндоскопических методов стало возможным получение материала для цитологического исследования почти из всех выше перечисленных отде лов кишечника.
При исследовании цитологического материала, полученного из доброкачественных опухолей и при неопухолевмх процессах, в большинстве случаев не представляется возможным диагностировать их гистологические варианты. Правильнее говорить об изменении эпителия в виде пролиферации или выраженной пролиферации с клеточной атипией. Характеристика эпителия в этих случаях во многом зависит от места забора материала и стадии данного процесса.
Из эпителиальных злокачественных опухолей в тонком и толстом кишечнике преобладает аденокарцинома. По степени клеточной дифференцировки выделяют аденокарциному с высокой, умеренной и низкой степенью дифферениировки клеток.
При диагностике заболеваний женских половых органов исследуют мазки, отпечатки, соскобы влагалища, шейки матки, цервикального канала; аспи раты и смывы из полости матки. Для диагностики заболеваний (преимущественно опухолей) яичников производят пункцию тонкой иглой через задний свод влагалища или, реже, через стенку прямой кишки и исследуют нунктат. а также асцитическую жидкость.
— Также рекомендуем «Цитологическое исследование у гинекологических больных. Цитологическая картина рака молочной железы.»
Оглавление темы «Цитологическая картина опухолей.»:
1. Цитологическое исследование материала из легких. Цитология эпителия пищеварительного тракта.
2. Цитологическое исследование желудка. Гастрограммы.
3. Цитологическое исследование печени. Цитологическое исследование поджелудочной железы.
4. Цитологическое исследование у гинекологических больных. Цитологическая картина рака молочной железы.
5. Цитология новообразований мочевыделительной системы. Цитология заболеваний простаты.
6. Цитология опухолей яичка. Цитология при заболеваниях кожи.
7. Цитологическая картина рака щитовидной железы. Новообразования серозных оболочек.
8. Мезотелиома. Нейрогенная опухоль.
9. Синовиома. Рабдомиосаркома. Сосудистая саркома.
10. Хондрома. Хондросаркома. Остеогенная саркома.
Источник
Цитология
© коллектив авторов, 2014 УДк 616.379-006.66-076.5
Лядов в.К., Ледин Е.в., Скрыпникова м.А.
цитологическая диагностика аденокарциномы поджелудочной железы методом выделения по размеру циркулирующих опухолевых клеток из периферической крови: сообщение из практики
ФГБУ «Лечебно-реабилитационный центр» минздрава России, москва
Диагностика циркулирующих в кровотоке опухолевых клеток — одно из наиболее перспективных и активно развивающихся направлений в цитологии. Большинство предложенных для этой цели методик основано на использовании имму-ноцитохимических либо молекулярно-генетических способов характеристики клеток. В то же время все большее распространение получает метод выделения циркулирующих опухолевых клеток, основанный на их большем по сравнению с другими клетками крови размере, методика ISET. Мы приводим клиническое наблюдение использования указанной методики для верификации диагноза и начала лечения у больной с многократными неэффективными диагностическими пункциями поджелудочной железы.
Ключевые слова: цитология; поджелудочная железа; аденокарцинома; циркулирующие опухолевые клетки; периферическая кровь.
V.K. Liadov, E.V. Ledin, M.A. Skripnikova
THE CYTOLOGICAL DIAGNOSTIC OF ADENOCARCINOMA OF PANCREAS WITH TECHNIQUE OF SIZE SEPARATION OF TUMOR CELLS CIRCULATING IN PERIPHERAL BLOOD (CASE REPORT)
The diagnostic of tumor cells circulating in blood is one of most perspective and actively developing directions in cytology. The most of proposed techniques for this purpose are based on using immune cytochemical or molecular genetic modes to characterize cells. At the same time, growing spread receives technique of separation of circulating tumor cells based on their larger size in comparison with other blood cells (ISET). The article presents clinical monitoring of application of mentioned technique to verify diagnosis and onset of treatment in female patient with reiterated ineffective diagnostic punctures of pancreas.
Keywords: cytology; pancreas; adenocarcinoma; circulating tumor cell; peripheral blood
Введение. В последние годы все более широкое распространение в лабораторной диагностике получают разнообразные методы выделения циркулирующих опухолевых клеток (ЦОК) из крови пациентов с онкологическими заболеваниями [1, 6, 8, 10]. Наличие подобных клеток служит фактором неблагоприятного прогноза, позволяет контролировать течение заболевания в процессе лечения, обеспечивает изучение механизмов метастазирования, а также способствует установлению диагноза [4, 9].
В то же время большинство молекулярно-генетических либо иммунных методов выделения ЦОК обладает недостаточной чувствительностью либо специфичностью и позволяет лишь косвенно судить о наличии в крови элементов опухоли [12, 13]. С целью улучшения диагностики ЦОК в 2000 г. коллективом авторов под руководством проф. P. Paterlini-Bréchot (Париж, Франция) был предложен способ изоляции ЦОК, основанный на фильтрации периферической крови через мембрану с калиброванными порами диаметром 8 мкм, не пропускающую крупные опухолевые клетки (Isolation by Size of Epithelial Tumor Cells — ISET) [14]. Мы приводим наблюдение успешного применения указанной методики для диагностики протоковой аденокар-циномы поджелудочной железы у больной с многократны-
Для корреспонденции:
Лядов Владимир Константинович, канд. мед. наук, зав. отд. хирургической онкологии
Адрес: 125252, Москва, Новопесчаная ул., 25/2-8 E-mail: vlyadov@gmail.com
ми безуспешными попытками верификации диагноза с помощью пункционных методик.
Материалы и методы. Методика выделения ЦОК. Для анализа крови на ЦОК по методу ВЕТ производят забор 10 мл крови из периферической вены в пробирку с ЭДТА. Кровь хранится при температуре 4°С не более 1,5 ч до начала анализа. После забора и транспортировки проводят разведение крови в соотношении 1:10 (до 100 мл) патентованным буферным раствором, содержащим сапонин, параформальдегид, ЭДТА и бычий альбумин. Буферный раствор необходим для лизиса эритроцитов. Далее кровь отстаивают в течение 10 мин при комнатной температуре и фильтруют с помощью фильтрационного модуля. Фильтрацию осуществляют методом вакуумной аспирации крови через поликарбонатную мембрану с калиброванными порами диаметром 8 мкм. Каждые 10 мл разведенной крови, соответствующие 1 мл неразведенной крови, аспи-рируются через круглый участок мембраны диаметром 6 мм. На указанных участках остаются крупные клетки (опухолевые и мононуклеарные), что позволяет количественно оценить наличие ЦОК в 1 мл крови пациента. После аспирации крови мембрану извлекают, двукратно промывают фосфатно-буферным раствором и окрашивают по Грюнвальду-Гимзе либо гематоксилином и эозином.
Приводим клиническое наблюдение. Больная П., 53 года, обратилась в Лечебно-реабилитационный центр в августе 2013 г. с жалобами на постоянную боль малой интенсивности в эпигастральной области, общую слабость. При компьютерной томографии в области тела поджелудочной железы выявлено солидное образование с неровными бугристыми контурами размером 55×53 мм, вовлекающее чревный
КЛИНИЧЕСКАЯ ЛАБОРАТОРНАЯ ДИАГНОСТИКА, № 11, 2014
ствол, его ветви, верхнюю брыжеечную артерию, воротную вену. Уровень СА 19-9 115 ЕД/мл. Опухоль признана нере-зектабельной; дальнейшей тактикой определено морфологическое подтверждение диагноза и проведение паллиативной химиотерапии по схеме FOLFIRINOX (наиболее агрессивная схема, имеющая наибольшую эффективность).
Произведена чрескожная толстоигольная биопсия образования под контролем ультразвукового исследования. После пункции у больной развилась упорная лимфорея, потребовавшая дренирования брюшной полости на протяжении месяца. При этом полученный материал представлен фрагментами ткани поджелудочной железы с признаками активного хронического панкреатита; опухолевые клетки не обнаружены. В сентябре 2013 г произведена повторная чрескожная толстоигольная биопсия опухоли, вновь не приведшая к верификации диагноза. Противоопухолевая терапия вновь была отложена, предложена лапароскопическая инцизионная биопсия. От выполнения указанного оперативного вмешательства в Лечебно-реабилитационном центре пациентка отказалась и обратилась в один из ведущих онкологических стационаров города, куда была госпитализирована в середине октября 2013 г В этом учреждении провели цитологическое исследование появившейся к тому моменту асцитической жидкости — вновь без выявления опухолевых клеток (получен «реактивный экссудат»). В конце октября у пациентки в Лечебно-реабилитационном центре выполнен забор крови на ЦОК. При цитологическом исследовании крови обнаружены многочисленные комплексы клеток и единичные клетки злокачественной опухоли, вероятно аденокарциномы (см. рисунок на обложке). На момент морфологического подтверждения диагноза при компьютерной томографии отмечено увеличение образования поджелудочной железы до 8 см, появление в правой доле печени метастатического очага размером около 5 см и выраженного асцита. Общее состояние пациентки существенно ухудшилось: появились выраженный болевой синдром, плохо контролируемый, в том числе наркотическими анальгетиками, ухудшился функциональный статус. В связи с прогрессированием заболевания и значительным ухудшением состояния проведение полихимиотерапии признано невозможным, начато паллиативное лечение гемцита-бином в монорежиме.
Результаты и обсуждение. Научным обоснованием для практического применения методики КЕТ служит исследование G. ^зпа и соавт. [14]. При изучении клеток различных раковых опухолей (рак печени, молочной железы, шейки матки, предстательной железы) показано, что их средний размер в 3-6 раз превышает средний размер лейкоцитов; различие было статистически значимым для всех изученных клеточных линий. При многократном определении в 1 мл крови предварительно изолированных одиночных опухолевых клеток методами КЕТ и полимеразной цепной реакции (ПЦР) в реальном времени (ДТ-ПЦР) было доказано, что порог чувствительности технологии КЕТ составляет около 1 клетки на 1 мл крови, что, по данным авторов, превышает возможности ПЦР. Кроме того, в указанной работе была показана принципиальная возможность иммунного и молекулярно-генетического анализа изолированных с помощью методики КЕТ клеток.
В дальнейшем было проведено крупное цитопатологи-ческое исследование, посвященное цитологическим критериям злокачественности получаемых из крови изолированных клеток и клеточных комплексов и воспроизводимости результатов методики КЕТ [5]. Изучены образцы крови 808 пациентов: 569 больных с различными злокачественными опухолями, 38 больных с доброкачественными опухолями, 152 пациентов без новообразований и 49 здоровых добровольцев. Все образцы крови анализировали 10 экспертов-цитологов, не знакомых с клинико-патологическим диагнозом пациента.
Выделенные клетки/комплексы клеток считали злокачественными при наличии как минимум четырех из следующих
критериев: анизонуклеоз (степень >0,5); ядра, превышающие размер поры в 3 раза, т. е. более 24 мкм; неровные контуры ядра; наличие трехмерных клеточных комплексов; высокий ядерно-цитоплазматический индекс. В соответствии с этими критериями клетки с явными признаками злокачественности были выявлены у 49% пациентов с верифицированными злокачественными новообразованиями. У больных без опухолей и здоровых добровольцев злокачественных клеток найдено не было. Коэффициент согласия между 10 специалистами в отношении клеток с явными признаками злокачественности составил 93%, что свидетельствует о высокой воспроизводимости результатов.
Особенно актуальна разработка цитологической диагностики новообразований по циркулирующим клеткам крови для опухолей, при которых получение пункционного гисто-либо цитологического материала затруднено или невозможно. Подобная ситуация возможна при раке неуточненной первичной локализации, опухолях желчных протоков, периферическом раке легкого, а также при распространенном раке головки поджелудочной железы.
Протоковая аденокарцинома поджелудочной железы является одним из наиболее прогностически неблагоприятных онкологических заболеваний. Количество пациентов с инку-рабельными опухолями III—IV стадии в нашей стране достигает 80% и более [2]. Необходимым условием для проведения химиотерапии в этой группе пациентов является цито- или гистологическая верификация диагноза [3, 11]. В то же время чувствительность таких традиционных инвазивных методов диагностики, как тонкоигольная аспирационная биопсия под контролем ультразвукового исследования либо эндосоногра-фии, а также чрескожная толстоигольная биопсия, составляет около 90% [7].
Приведенное нами наблюдение демонстрирует трудности диагностики неоперабельного рака поджелудочной железы и необходимость дальнейшей разработки методов не-инвазивной цитологической диагностики этого заболевания. Безусловно, подтверждением эффективности методики ISET будет прямое сравнительное исследование результатов пунк-ционной биопсии и анализа крови на ЦОК с обязательным иммуноцитохимическим подтверждением злокачественной природы выявленных клеток.
Однако данные литературы и первый собственный успешный опыт позволяют надеяться на то, что цитопатоло-гическая трактовка клеток, полученных при помощи технологии ISET, может занять определенную нишу в диагностике злокачественных заболеваний, подобно цитологическому исследованию биоптатов при опухолях щитовидной и молочной железы, шейки матки, желчных протоков и ряде других заболеваний.
Заключение. Метод выделения ЦОК из периферической крови по размеру является перспективным вариантом цитологической верификации злокачественных новообразований и требует дальнейшего изучения в проспективных контролируемых исследованиях.
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
ЛИТЕРАТУРА
1. Бжадуг О.Б. Иммунологическая характеристика и клиническое значение опухолевых клеток, циркулирующих в периферической крови больных распространенным раком молочной железы: ав-тореф. дисс. … канд. мед. наук. M.; 2010.
2. Чиссов В.И., Старинский В.В., Петрова Г.В., ред. Злокачественные новообразования в России в 2010 году (заболеваемость и смертность). М.: ФГБУ «МНИОИ им. П.А. Герцена» Минз-дравсоцразвития России; 2012. 260 с.
3. Чиссов В.И., Дарьялова С.Л., ред. Онкология. Клинические рекомендации. 2-е изд. М.: ГЭОТАР-Медиа; 2009. 928 с.
4. Dotan E., Cohen S.J., Alpaugh K.R., Meropol N.J. Circulating tumor cells: evolving evidence and future challenges. Oncologist. 2009; 14(11): 1070-82.
5. Hofman V.J., Ilie M.I., Bonnetaud C., Selva E., Long E., Molina T. et al. Cytopathologic detection of circulating tumor cells using the iso-
lation by size of epithelial tumor cell method: promises and pitfalls. Am. J. Clin. Pathol. 2011; 135(1): 146-56.
6. Hong B., Zu Y. Detecting circulating tumor cells: current challenges and new trends. Theranostics. 2013; 3(6): 377-94.
7. Ihse I., Axelson J., Dawiskiba S., Hansson L. Pancreatic biopsy: why? When? How? World J. Surg. 1999; 23(9): 896-900.
8. Khoja L., Backen A., Sloane R., Menasce L., Ryder D., Krebs M. et al. A pilot study to explore circulating tumour cells in pancreatic cancer as a novel biomarker. Br. J. Cancer. 2012; 106(3): 508-16.
9. Nadal R., Lorente J.A., Rosell R., Serrano M.J. Relevance of molecular characterization of circulating tumor cells in breast cancer in the era of targeted therapies. Expert Rev. Mol. Diagn. 2013; 13(3): 295-307.
10. Nagrath S., Sequist L.V., Maheswaran S., Bell D.W., Irimia D., Ulkus L. et al. Isolation of rare circulating tumour cells in cancer patients by microchip technology. Nature. 2007; 450(7173): 1235-9.
11. NCCN Guidelines. Pancreatic adenocarcinoma. vol. 1. 2013. NCCN.org.
12. Paterlini-Brechot P. Organ-specific markers in circulating tumor cell screening: an early indicator of metastasis-capable malignancy. Future Oncol. 2011; 7(7): 849-71.
13. Tjensvoll K., Nordgärd O., Smaaland R. Circulating tumor cells in pancreatic cancer patients: Methods of detection and clinical implications. Int. J. Cancer. 2014; 134(1): 1-8.
14. Vona G., Sabile A., Louha M., Sitruk V., Romana S., Schütze K. et al. Isolation by size of epithelial tumor cells: a new method for the immunomorphological and molecular characterization of circulatingtumor cells. Am. J. Pathol. 2000; 156(1): 57-63.
REFERENCES
1. Bzhadug O.B. Immunologic characterization and clinical value of tumor cells circulating in peripheral blood of patients with dissemninated breast cancer. Diss. Moscow; 2010. (in Russian)
2. Chissov V.I., Starinskiy V.V., Petrova G.V., eds. Malignant neoplasms in Russia in 2010 (incidence and mortality). Moscow; 2012. (in Russian)
3. Chissov V.I., Daryalova S.L., eds. Oncology. Clinical guidelines. 2nd ed. Moscow: GEOTAR-Media; 2009. (in Russian)
4. Dotan E., Cohen S.J., Alpaugh K.R., Meropol N.J. Circulating tumor cells: evolving evidence and future challenges. Oncologist. 2009; 14(11): 1070-82.
5. Hofman V.J., Ilie M.I., Bonnetaud C., Selva E., Long E., Molina T. et al. Cytopathologic detection of circulating tumor cells using the isolation by size of epithelial tumor cell method: promises and pitfalls. Am J. Clin Pathol. 2011; 135(1): 146-56.
6. Hong B., Zu Y. Detecting circulating tumor cells: current challenges and new trends. Theranostics. 2013; 3(6): 377-94.
7. Ihse I., Axelson J., Dawiskiba S., Hansson L. Pancreatic biopsy: why? When? How? World J. Surg. 1999; 23(9): 896-900.
8. Khoja L., Backen A., Sloane R., Menasce L., Ryder D., Krebs M. et al. A pilot study to explore circulating tumour cells in pancreatic cancer as a novel biomarker. Br. J. Cancer. 2012; 106(3): 508-16.
9. Nadal R., Lorente J.A., Rosell R., Serrano M.J. Relevance of molecular characterization of circulating tumor cells in breast cancer in the era of targeted therapies. Expert Rev. Mol. Diagn. 2013; 13(3): 295-307.
10. Nagrath S., Sequist L.V., Maheswaran S., Bell D.W., Irimia D., Ulkus L. et al. Isolation of rare circulating tumour cells in cancer patients by microchip technology. Nature. 2007; 450(7173): 1235-9.
11. NCCN Guidelines. Pancreatic adenocarcinoma. vol. 1. 2013. NCCN. org.
12. Paterlini-Brechot P. Organ-specific markers in circulating tumor cell screening: an early indicator of metastasis-capable malignancy. Future Oncol. 2011; 7(7): 849-71.
13. Tjensvoll K., Nordgärd O., Smaaland R. Circulating tumor cells in pancreatic cancer patients: Methods of detection and clinical implications. Int. J. Cancer. 2014; 134(1): 1-8.
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
14. Vona G., Sabile A., Louha M., Sitruk V., Romana S., Schütze K. et al. Isolation by size of epithelial tumor cells: a new method for the immunomorphological and molecular characterization of circulatingtumor cells. Am. J. Pathol. 2000; 156(1): 57-63.
Поступила 16.01.14 Received 16.01.14
К ст. А. Йесте
Микрозонды антигенов для изучения аутоиммунных болезней.
Ряд аутоантигенов (белки, пептиды или липиды) в форме пятен на химически обработанных стеклянных слайдах гибридизируются с образцами пациентов (сыворотка, плазма, спинномозговая жидкость, синовиальная жидкость). Взаимодействия антиген—антитело обнаруживают с помощью антител, меченных флюоресцентным красителем. Биоинформационный анализ флюоресцентных сигналов позволяет идентифицировать сигнатуры аутоантител, пригодные для диагностики болезни, определения ее стадии и мониторинга реакции на лечение.
К ст. К. В. Лядова и соавт.
Комплекс злокачественных клеток, выделенный при помощи метода КЕТ из периферической крови пациентки.
Окраска по Грюнвальду-Гимзе. Ув. 40.
Источник