Ферменты поджелудочной железы активация
В
поджелудочной железе синтезируются
проферменты ряда протеаз: трипсиноген,
химотрипсиноген, проэластаза,
прокарбоксипептидазы А и В. В кишечнике
они путём частичного протеолиза
превращаются в активные ферменты
трипсин, химотрипсин, эластазу и
карбок-сипептидазы А и В.
Активация
трипсиногена происходит
под действием фермента эпителия
кишечника энтеропептидазы.
464
Этот
фермент отщепляет с N-конца молекулы
трипсиногена гексапептид Вал-(Асп)4-Лиз.
Изменение конформации оставшейся части
полипептидной цепи приводит к формированию
активного центра, и образуется активный
трипсин. Последовательность Вал-(Асп)4-Лиз
присуща большинству известных
трипсиноге-нов разных организмов — от
рыб до человека.
Образовавшийся
трипсин активирует
химотрипсиноген, из
которого получается несколько активных
ферментов (рис. 9-3). Химотрипсиноген
состоит из одной полипептидной цепи,
содержащей 245 аминокислотных остатков
и пяти дисульфидных мостиков. Под
действием трипсина расщепляется
пептидная связь между 15-й и 16-й
аминокислотами, в результате чего
образуется активный π-химотрипсин.
Затем под действием π-химотрипсина
отщепляется дипептид сер(14)-арг(15), что
приводит к образованию δ-химотрипсина.
Отщепление дипептида тре(147)-арг(148)
завершает образование стабильной формы
активного фермента — α-химотрипсина,
который состоит из трёх полипептидных
цепей, соединённых дисульфидными
мостиками.
Остальные
проферменты панкреатических протеаз
(проэластаза и прокарбоксипептидазы
А и В) также активируются трипсином
путём частичного протеолиза. В результате
образуются активные ферменты — эластаза
и карбокси-пептидазы А и В.
2. Специфичность действия протеаз
Трипсин
преимущественно гидролизует пептидные
связи, образованные карбоксильными
группами аргинина и лизина. Химотрипсины
наиболее активны в отношении пептидных
связей, образованных карбоксильными
группами ароматических аминокислот
(Фен, Тир, Три).
Карбоксипептидазы
А и В — цинксодержащие ферменты, отщепляют
С-концевые остатки аминокислот. Причём
карбоксипептидаза А
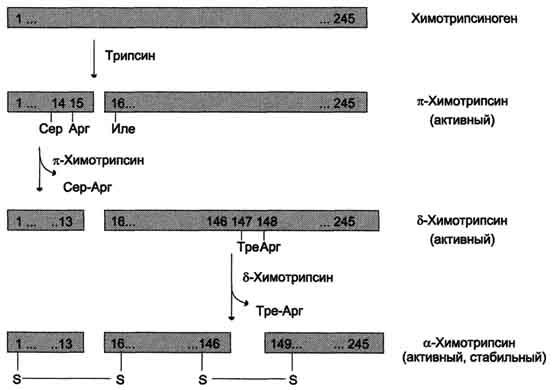
Рис.
9-3. Активация химотрипсиногена. Молекула
химотрипсиногена состоит из 245
аминокислотных остатков и имеет пять
дисульфидных мостиков. На схеме показаны
участки фермента, подвергающиеся
протеолизу. а-Химотрипсин — активная
стабильная форма фермента — состоит из
трёх полипептидных цепей, ковалентно
связанных между собой двумя дисульфидными
мостиками и нековалентно — за счёт
водородных связей и гидрофобных
взаимодействий.
465
отщепляет
преимущественно аминокислоты, содержащие
ароматические или гидрофобные радикалы,
а карбоксипептидаза В — остатки аргинина
и лизина.
Последний
этап переваривания — гидролиз небольших
пептидов, происходит под действием
ферментов аминопептидаз и дипептидаз,
которые синтезируются клетками тонкого
кишечника в активной форме.
Аминопептидазы последовательно
отщепляют N-концевые аминокислоты
пептидной цепи. Наиболее известна
лейцинаминопептидаза — Zn2+-
или Мn2+-содержащий
фермент, несмотря на название, обладающий
широкой специфичностью по отношению
к N-концевым аминокислотам.Дипептидазы расщепляют
дипептиды на аминокислоты, но не
действуют на трипептиды.
В
результате последовательного действия
всех пищеварительных протеаз большинство
пищевых белков расщепляется до свободных
аминокислот.
В.
Защита клеток от действия протеаз
Клетки
поджелудочной железы защищены от
действия пищеварительных ферментов
тем, что:
эти
ферменты образуются
в виде неактивных предшественников в
клетках поджелудочной железы и
активируются только после секреции в
просвет кишечника. Таким образом, место
синтеза и место действия этих ферментов
пространственно разделены.в
клетках поджелудочной железы
присутствует белок-ингибитор
трипсина, образующий
с активной формой фермента (в случае
преждевременной активации) прочный
комплекс.
В
полости желудка и кишечника протеазы
не контактируют с белками клеток,
поскольку слизистая оболочка покрыта
слоем слизи, а каждая клетка содержит
на наружной поверхности плазматической
мембраны полисахариды, которые не
расщепляются протеазами и тем самым
защищают клетку от их действия.
Разрушение
клеточных белков протеазами происходит
при язвенной болезни желудка или
двенадцатиперстной кишки. Однако
начальные механизмы возникновения
язвы ещё мало изучены.
Г.
Транспорт аминокислот в клетки
Аминокислоты,
образовавшиеся при переваривании
белков, быстро всасываются в кишечнике.
Транспорт их осуществляется двумя
путями: через воротную систему печени,
ведущую прямо в печень, и по лимфатическим
сосудам, сообщающимся с кровью через
грудной лимфатический проток. Максимальная
концентрация аминокислот в крови
достигается через 30-50 мин после приёма
белковой пищи (углеводы и жиры замедляют
всасывание аминокислот). Всасывание
L-аминокислот (но не D-изомеров) — активный
процесс, требующий затраты энергии.
Аминокислоты переносятся через кишечную
стенку от слизистой её поверхности в
кровь (рис. 9-4). Перенос через щёточную
кайму осуществляется целым рядом
переносчиков, многие из которых действуют
при участии Nа+-зависимых
механизмов симпорта, подобно переносу
глюкозы (см. раздел 7).
Различная
скорость проникновения аминокислот
через мембраны клеток указывает на
наличие транспортных систем, обеспечивающих
перенос аминокислот как через внешнюю
плазматическую мембрану, так и через
внутриклеточные мембраны. В настоящее
время известно по крайней мере пять
специфических транспортных систем,
каждая из которых функционирует
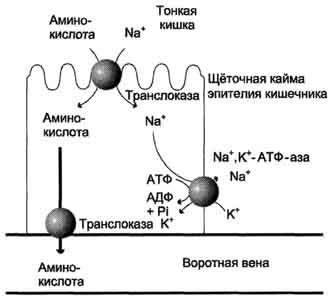
Рис.
9-4. Механизм всасывания аминокислот в
кишечнике. L-аминокислота
поступает в энтероцит путём симпорта
с ионом Na+.
Далее специфическая транслоказа
переносит аминокислоту через мембрану
в кровь. Обмен ионов натрия между
клетками осуществляется путём
первично-активного транспорта с помощью
Nа+,К+-АТФ-азы.
466
для
переноса определённой группы близких
по строению аминокислот:
нейтральных,
с короткой боковой цепью (аланин, серии,
треонин);нейтральных,
с длинной или разветвлённой боковой
цепью (валин, лейцин, изолейцин);с
катионными радикалами (лизин, аргинин);с
анионными радикалами (глутаминовая и
аспарагиновая кислоты);иминокислот
(пролин, оксипролин).
Причём
к числу Nа+-зависимых
относятся переносчики аминокислот,
входящих в первую и пятую группы, а
также переносчик метионина. Независимые
от Na+ переносчики
специфичны для некоторых нейтральных
аминокислот (фенилаланин, лейцин) и
аминокислот с катионными радикалами
(лизин).
Аминокислоты
конкурируют друг с другом за специфические
участки связывания. Например, всасывание
лейцина (если концентрация его достаточно
высока) уменьшает всасывание изолейцина
и валина.
Одна
из специфических транспортных систем
для некоторых нейтральных аминокислот
функционирует в кишечнике, почках и,
по-видимому, мозге. Она получила название
γ-глутамильного цикла (рис. 9-5).
В
этой системе участвуют 6 ферментов,
один из которых находится в клеточной
мембране, а остальные — в цитозоле.
Ключевую роль в транспорте аминокислоты
играет мембранно-связан-ный фермент
γ-глутамилтрансфераза. Этот
фермент является гликопротеином и
катализирует перенос γ-глутамильной
группы от глутатиона (иногда другого
γ-глутамильного пептида) на транспортируемую
аминокислоту и последующий перенос
комплекса в клетку. Глутатион представляет
собой трипептид — γ-глутамилцистеинилглицин,
который находится во всех тканях
животных. Реакция протекает следующим
образом (см. схему А на с. 468).
Аминокислота,
связанная с γ-глутамильным остатком,
оказывается внутри клетки. В следующей
реакции происходит отщепление
γ-глутамильного
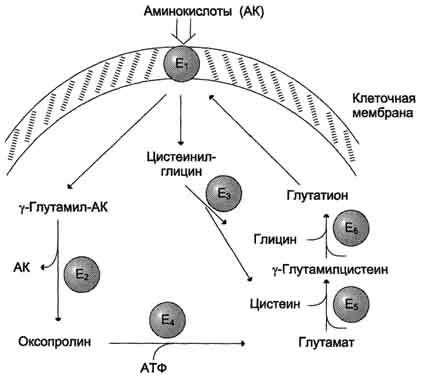
Рис.
9-5. γ-Глутамильный
цикл. Система
состоит из одного мембранного и пяти
цитоплазматических ферментов. Перенос
аминокислоты внутрь клетки осуществляется
в комплексе с глутамильным остатком
глутатиона под действием
γ-глутамилтрансферазы. Затем аминокислота
освобождается, а γ-глутамильный остаток
в несколько стадий превращается в
глутатион, который способен присоединять
следующую молекулу аминокислоты. Е1 —
γ-глутамилтрансфераза; Е2 —
у-глутамилциклотрансфераза; Е3 —
пептидаза; Е4 —
оксопролиназа; Е5 —
γ-глутамилцистеинсинтетаза; Е6 —
глутатионсинтетаза.
467
остатка
под действием фермента
γ-глутамилциклотрансферазы (см. схему
Б).
Дипептид
цистеинилглицин расщепляется под
действием пептидазы на 2 аминокислоты
— цис-теин и глицин. В результате этих
3 реакций происходит перенос одной
молекулы аминокислоты в клетку (или
внутриклеточную структуру). Следующие
3 реакции обеспечивают регенерацию
глутатиона, благодаря чему цикл
повторяется многократно. Для транспорта
в клетку одной молекулы аминокислоты
с участием γ-глутамильного цикла
затрачиваются 3 молекулы АТФ.
Д.
Нарушение переваривания белков и
транспорта аминокислот
Небольшую
долю продуктов переваривания белка
составляют негидролизованные короткие
пептиды. У некоторых людей возникает
иммунная реакция на приём белка, что,
очевидно, связано со способностью к
всасыванию
таких
пептидов. Продукты полностью переваренного
белка (аминокислоты) лишены антигенных
свойств и иммунных реакций не вызывают.
У
новорождённых проницаемость слизистой
оболочки кишечника выше, чем у взрослых,
поэтому в кровь могут поступать антитела
молозива (секрет молочных желёз,
выделяющийся в первые дни после родов,
обогащённый антителами и антитоксинами).
Это усугубляется наличием в молозиве
белка — ингибитора трипсина. Протеолитические
ферменты в пищеварительных секретах
новорождённых обладают низкой
активностью. Всё это способствует
всасыванию в кишечнике небольшого
количества нативных белков, достаточного
для обеспечения иммунной реакции.
Очевидно, подобное усиление всасывающей
способности кишечника является причиной
наблюдаемой иногда непереносимости
белков пищи (например, молока и яиц) у
взрослых людей.
Гниение
Известно,
что микроорганизмы кишечника
для своего роста также нуждаются в
доставке с пищей определенных аминокислот.
Микрофлора кишечника располагает
набором ферментных систем, отличных
от соответствующихферментов животных тканей и
катализирующих самые разнообразные
превращения пищевых аминокислот.
В кишечнике создаются оптимальные
условия для образования ядовитых
продуктов
распада аминокислот: фенола,индола, крезола, скатола, сероводорода,
метилмер-каптана, а также нетоксичных
для организма соединений: спиртов, аминов, жирных
кислот,кетокислот, оксикислот и
др.
Все
эти превращения аминокислот,
вызванные деятельностью микроорганизмовкишечника,
получили общее название «гниение белков в
кишечнике». Так, в процессе
распада серосодержащих
аминокислот (цистин, цистеин, метионин)
в кишечнике образуются сероводород H2S
и метил-меркаптан CH3SH.
Диаминокислоты – орнитин и лизин –
подвергаются процессудекарбоксилирования с
образованием аминов –
путресцина и кадаверина.
Из
ароматических аминокислот: фенилаланин, тирозин и триптофан –
при аналогичном
бактериальном декарбоксилировании образуются
соответствующие амины: фенилэтиламин,
параоксифенилэтиламин (или тира-мин)
и индолилэтиламин (триптамин).
Кроме того, микробные ферментыкишечника
вызывают постепенное разрушение боковых
цепей циклическихаминокислот,
в частности тирозина и триптофана,
с образованием ядовитых продуктов
обмена – соответственно крезола и фенола, скатола и индола.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
Первым
открытым (и на званным гормоном) явился
секретин — стимулятор обильного
сокоотделения и секреции гидрокарбонатов.
Высвобождение этого гормона в кровь
S-клетками двенадцатиперстной кишки
происходит при действии на ее слизистую
оболочку перешедшего в кишку кислого
желудочного содержимого. Секретин
стимулирует секрецию в большей мере
через соответствующие мембранные
рецепторы и вторичные мессенджеры
АЦ — цАМФ центроацинозные и протоковые
клетки, в меньшей мере — ацинозные
клетки, поэтому выделяется секрет с
высокой концентрацией гидрокарбонатов
и низкой ферментативной активностью.
Вторым
гормоном, усиливающим секрецию
поджелудочной железы, является
холецистокинин (ХЦК). Высвобождение
гормона в кровь из ССК-клеток слизистой
оболочки двенадцатиперстной и тощей
кишки происходит под влиянием пищевого
химуса (особенно продуктов начального
гидролиза пищевых белков и жиров,
углеводов, некоторых аминокислот).
Стимулируют высвобождение ХЦК
присутствие ионов Са2+ и снижение рН в
двенадцатиперстной кишке.
Вопрос№43
Роль энтерокиназы в процессах пищеварения.
Работы И.П. Павлова.
Энтерокиназа
активирует трипсиноген , отщепляя от
него гексапептид при рН 6,8—8,0. Процесс
ускоряется в присутствии ионов Са2+.Далее
трипсиноген превращается в трипсин
аутокаталитически под действием
трипсина.химотрипсиноген,прокарбоксипептидазы
А и В, проэластаза тоже активируются
трипсином. за счет того, что трипсин,
химотрипсин, эластаза расщепляют
пептидные связи белков, образуя
низкомолекулярные пептиды и аминокислоты
энтерокиназа косвенно участвует в
пищеварении.
И.
П. Павлов показал, что раздражение
блуждающего нерва вызывает выделение
большого количества сока поджелудочной
железы, богатого ферментами. Холинергические
волокна блуждающих нервов с помощью АХ
действуют на М-холинорецепторы
панкреацитов. Затем высвобождающиеся
ион Са2+ и комплекс ГЦ — цГМФ в роли
вторичных мессенджеров стимулируют
секрецию панкреоцитами ферментов и
гидрокарбонатов. Холинергические
нейроны, кроме того, потенцируют
секреторные эффекты секретина и ХЦК.
Хирургическая ваготомия существенно
снижает секрецию поджелудочной железы.
Вопрос№44
Механизмы нервной регуляции функций
поджелудочной железы.
ПарасимпатикаХолинергические
волокна блуждающих нервов с помощью АХ
действуют на М-холинорецепторы
панкреацитов. Затем высвобождающиеся
ион Са2+ и комплекс ГЦ — цГМФ в роли
вторичных мессенджеров стимулируют
секрецию панкреоцитами ферментов и
гидрокарбонатов. Холинергические
нейроны, кроме того, потенцируют
секреторные эффекты секретина и ХЦК.
Хирургическая ваготомия существенно
снижает секрецию поджелудочной железы.
Симпатические
волокна
через β-адренорецепторы, тормозят
секрецию, усиливают синтез органических
веществ в поджелудочной. Адренергические
эффекты снижения секреции обеспечиваются
также уменьшением кровоснабжения
поджелудочной железы путем сужения
кровеносных сосудов через их
α-адренорецепторы
Пептидергическая
иннервация.
Окончания этих нейронов выделяют ряд
нейропептидов, одни из которых стимулируют,
другие — тормозят секрецию поджелудочной
железы.
Вопрос№45
Гуморальная регуляция секреции
поджелудочной железы.
Первым
открытым (и названным гормоном) явился
секретин
—
стимулятор обильного сокоотделения
и секреции гидрокарбонатов ацинозными
клетками.вырабатывается S-клетками ДПК
при действии на ее слизистую оболочку
перешедшего в кишку кислого желудочного
содержимого и выделяется в кровь.
холецистокинин
(ХЦК)-усиливает
секрецию гормонов поджелудочной.
Высвобождение гормона в кровь из
ССК-клеток слизистой оболочки
двенадцатиперстной и тощей кишки
происходит под влиянием пищевого химуса
(особенно продуктов начального гидролиза
пищевых белков и жиров, углеводов,
некоторых аминокислот). Стимулируют
высвобождение ХЦК присутствие ионов
Са2+ и снижение рН в двенадцатиперстной
кишке.
ХЦК
действует преимущественно на ацинусы
поджелудочной железы, поэтому выделяющийся
в ответ на стимуляцию этим гормоном
сок богат ферментами.
Секреция
поджелудочной железы усиливается также
гастрином, серотонином, инсулином,
бомбезином, солями желчных кислот.
Тормозят выделение поджелудочного сока
глюкагон, соматостатин, вазопрессин,
вещество Р, АКТГ, энкефалин, кальцитонин,
ЖИП, ПП, УУ. ВИП может возбуждать и
тормозить секрецию поджелудочной
железы.
Вопрос№46
Фазы секреции сока поджелудочной
железы.Влияние пищевых режимов на
секрецию.
мозговая,
фаза секреции поджелудочной железы
обусловлена видом, запахом пищи и
другими раздражителями, связанными с
приемом пищи (условнорефлекторные
раздражения), а также воздействиями
на рецепторы слизистой оболочки рта,
жеванием и глотанием (безусловно-рефлекторные
раздражения). Нервные импульсы,
возникающие в рецепторах, достигают
продолговатого мозга и затем по волокнам
блуждающего нерва поступают к железе
и вызывают ее секрецию.желудочная,
секреция во время нее стимулируется
и поддерживается путем ваговагального
рефлекса с механо- и хеморецепторов
желудка и с помощью гастрина.кишечная,
фаза секреции поджелудочной железы.
В эту фазу секреция стимулируется
ваговагальным дуоденопанкреатическим
рефлексом, но ведущее значение имеет
высвобождение в кровь секретина и ХЦК.
Высвобождение их происходит при действии
на слизистую оболочку двенадцатиперстной
кишки кислого ее содержимого. Чем больше
свободных ионов Н+, тем больше
высвобождается секретина и тем выше
объем сока поджелудочной железы и
секреция гидрокарбонатов. Гидрокарбонаты
связывают ионы Н+, что приводит к
повышению рН среды и уменьшает
высвобождение секретина и соответственно
объем сока и секрецию гидрокарбонатов.
Секреция ферментов в кишечную фазу
стимулируется ХЦК и рефлекторно за
счет ваговагального рефлекса.
Влияние
пищевых режимов на секрецию поджелудочной
железы.
Прием пищи вызывает увеличение выделения
всех ферментов в составе сока, но для
разных видов пищи это увеличение
выражено в разной мере. В случае
приема пищи с большим содержанием
углеводов в наибольшей мере увеличивается
секреция амилазы, белков — трипсина и
химотрипсина, прием жирной пищи
вызывает секрецию сока с более высокой
липолитической активностью. Спектр
ферментов сока поджелудочной железы
срочно адаптируется к виду принимаемой
пищи во все три фазы секреции и особенно
в кишечную фазу.
Вопрос№47Основные
пищеварительные функции печени.
Синтез
билирубина и желчных кислот, секреция
и продукция желчи.
При выключении желчи из пищеварения
нарушается процесс переваривания и
всасывания жиров и других веществ
липидной природы. Желчь усиливает
гидролиз и всасывание белков и
углеводов.
Синтез
ферментов и гормонов, которые активно
участвуют в преобразовании еды в
12-перстной кишке и других отделах тонкого
кишечника.
Вопрос№48
Непищеварительные функции печени.
обеспечение
энергетических потребностей в глюкозе
и конвертация разных источников энергии
(аминокислоты, свободные жирные кислоты,
глицерин, молочная кислота и т.д.) в
глюкозу (глюконеогенезОбезвреживание
ксенобиотиков (чужеродных веществ), в
частности ядов, токсинов, аллергенов,
посредствам превращения их в менее
токсичные, легко удаляемые и безвредные
соединения.Обезвреживание
и последующее удаление из организма
избытка гормонов, витаминов, медиаторов,
а также промежуточных и конечных
токсичных продуктов обмена веществ.депогликогена
и контроль углеводного обмена.Пополнение
и сохранение некоторых витаминов (в
печени особенно велики запасы
водорастворимого витамина В12 и
жирорастворимых витаминов А и D), а также
депокатионов некоторых микроэлементов
– металлов, в частности катионов меди,
кобальта и железа. Кроме того, печень
принимает участие в метаболизме фолиевой
кислоты и витаминов А, В, С, D, E, К, РР.Участие
в процессе кроветворения (только у
плода). В том числе синтез множества
белков плазмы крови – альфа- и
бетаглобулинов, альбуминов, транспортных
белков для разных витаминов и гормонов,
белков противосвёртывающей и свертывающей
систем крови и множества других. Печень
– один из важнейших органов гемопоэза
в пренатальном развитии.Синтез
эфиров холестерина и его самого,
фосфолипидов и липидов, липопротеидов,
контроль липидного обмена.Депо
крови
Вопрос
№49Состав и физико-химические свойства
желчи.
Состав
желчи.
различные эндогенные и экзогенные
вещества: белки, аминокислоты, витамины
и другие вещества. желчные кислоты и
их соли(основной компонент желчи) в виде
соединений с гликоколом и таурином.гликохолевых
кислот около 80 % и таурохолевых — около
20 %. билирубин — пигмент красно-желтого
цвета, придающий печеночной желчи
характерную окраску, биливердин
(зеленого цвета) — в желчи человека
содержится в следовых количествах
Желчь
состоит из трех фракций.
Две из них образуются ге-патоцитами,
третья — эпителиальными клетками
желчных протоков. От общего объема
желчи у человека на первые две фракции
приходится 75 %, на долю третьей — 25%.
Образование первой фракции связано, а
второй — не связано напрямую с
образованием желчных кислот.
Образование третьей фракции желчи
определяется способностью эпителиальных
клеток протоков секретировать жидкость
с достаточно высоким содержанием
гидрокарбонатов и хлора, осуществлять
реабсорбцию воды и электролитов из
канальцевой желчи.
Физико-химические
св-ва:
небольшая ферментативная активность;
рН печеночной желчи 7,3—8,0. При прохождении
по желчевыводящим путям и нахождении
в желчном пузыре жидкая и прозрачная
золотисто-желтого цвета печеночная
желчь (относительная плотность
1,008—1,015) концентрируется (всасываются
вода и минеральные соли), к ней добавляется
муцин желчных путей и пузыря, и желчь
становится темной, тягучей, увеличивается
ее относительная плотность (1,026—1,048) и
снижается рН (6,0—7,0) за счет образования
солей желчных кислот и всасывания
гидрокарбонатов. Желчь эмульгирует
жиры, увеличивая поверхность, на которой
осуществляется их гидролиз липазой;
растворяет продукты гидролиза липидов,
способствует их всасыванию и ресинтезу
триглицеридов в энтероцитах; повышает
активность ферментов поджелудочной
железы и кишечных ферментов, особенно
липазы.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник



