Где активируются пептидазы поджелудочной железы
В
поджелудочной железе синтезируются
проферменты ряда протеаз: трипсиноген,
химотрипсиноген, проэластаза,
прокарбоксипептидазы А и В. В кишечнике
они путём частичного протеолиза
превращаются в активные ферменты
трипсин, химотрипсин, эластазу и
карбок-сипептидазы А и В.
Активация
трипсиногена происходит
под действием фермента эпителия
кишечника энтеропептидазы.
464
Этот
фермент отщепляет с N-конца молекулы
трипсиногена гексапептид Вал-(Асп)4-Лиз.
Изменение конформации оставшейся части
полипептидной цепи приводит к формированию
активного центра, и образуется активный
трипсин. Последовательность Вал-(Асп)4-Лиз
присуща большинству известных
трипсиноге-нов разных организмов — от
рыб до человека.
Образовавшийся
трипсин активирует
химотрипсиноген, из
которого получается несколько активных
ферментов (рис. 9-3). Химотрипсиноген
состоит из одной полипептидной цепи,
содержащей 245 аминокислотных остатков
и пяти дисульфидных мостиков. Под
действием трипсина расщепляется
пептидная связь между 15-й и 16-й
аминокислотами, в результате чего
образуется активный π-химотрипсин.
Затем под действием π-химотрипсина
отщепляется дипептид сер(14)-арг(15), что
приводит к образованию δ-химотрипсина.
Отщепление дипептида тре(147)-арг(148)
завершает образование стабильной формы
активного фермента — α-химотрипсина,
который состоит из трёх полипептидных
цепей, соединённых дисульфидными
мостиками.
Остальные
проферменты панкреатических протеаз
(проэластаза и прокарбоксипептидазы
А и В) также активируются трипсином
путём частичного протеолиза. В результате
образуются активные ферменты — эластаза
и карбокси-пептидазы А и В.
2. Специфичность действия протеаз
Трипсин
преимущественно гидролизует пептидные
связи, образованные карбоксильными
группами аргинина и лизина. Химотрипсины
наиболее активны в отношении пептидных
связей, образованных карбоксильными
группами ароматических аминокислот
(Фен, Тир, Три).
Карбоксипептидазы
А и В — цинксодержащие ферменты, отщепляют
С-концевые остатки аминокислот. Причём
карбоксипептидаза А
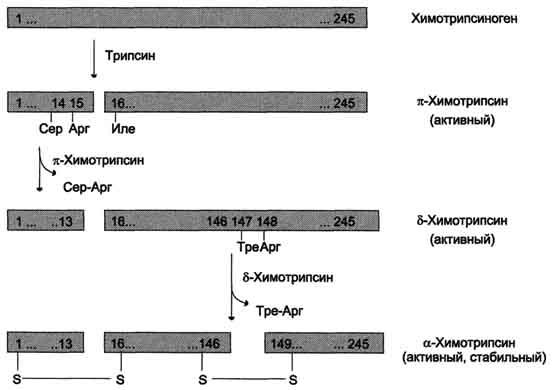
Рис.
9-3. Активация химотрипсиногена. Молекула
химотрипсиногена состоит из 245
аминокислотных остатков и имеет пять
дисульфидных мостиков. На схеме показаны
участки фермента, подвергающиеся
протеолизу. а-Химотрипсин — активная
стабильная форма фермента — состоит из
трёх полипептидных цепей, ковалентно
связанных между собой двумя дисульфидными
мостиками и нековалентно — за счёт
водородных связей и гидрофобных
взаимодействий.
465
отщепляет
преимущественно аминокислоты, содержащие
ароматические или гидрофобные радикалы,
а карбоксипептидаза В — остатки аргинина
и лизина.
Последний
этап переваривания — гидролиз небольших
пептидов, происходит под действием
ферментов аминопептидаз и дипептидаз,
которые синтезируются клетками тонкого
кишечника в активной форме.
Аминопептидазы последовательно
отщепляют N-концевые аминокислоты
пептидной цепи. Наиболее известна
лейцинаминопептидаза — Zn2+-
или Мn2+-содержащий
фермент, несмотря на название, обладающий
широкой специфичностью по отношению
к N-концевым аминокислотам.Дипептидазы расщепляют
дипептиды на аминокислоты, но не
действуют на трипептиды.
В
результате последовательного действия
всех пищеварительных протеаз большинство
пищевых белков расщепляется до свободных
аминокислот.
В.
Защита клеток от действия протеаз
Клетки
поджелудочной железы защищены от
действия пищеварительных ферментов
тем, что:
эти
ферменты образуются
в виде неактивных предшественников в
клетках поджелудочной железы и
активируются только после секреции в
просвет кишечника. Таким образом, место
синтеза и место действия этих ферментов
пространственно разделены.в
клетках поджелудочной железы
присутствует белок-ингибитор
трипсина, образующий
с активной формой фермента (в случае
преждевременной активации) прочный
комплекс.
В
полости желудка и кишечника протеазы
не контактируют с белками клеток,
поскольку слизистая оболочка покрыта
слоем слизи, а каждая клетка содержит
на наружной поверхности плазматической
мембраны полисахариды, которые не
расщепляются протеазами и тем самым
защищают клетку от их действия.
Разрушение
клеточных белков протеазами происходит
при язвенной болезни желудка или
двенадцатиперстной кишки. Однако
начальные механизмы возникновения
язвы ещё мало изучены.
Г.
Транспорт аминокислот в клетки
Аминокислоты,
образовавшиеся при переваривании
белков, быстро всасываются в кишечнике.
Транспорт их осуществляется двумя
путями: через воротную систему печени,
ведущую прямо в печень, и по лимфатическим
сосудам, сообщающимся с кровью через
грудной лимфатический проток. Максимальная
концентрация аминокислот в крови
достигается через 30-50 мин после приёма
белковой пищи (углеводы и жиры замедляют
всасывание аминокислот). Всасывание
L-аминокислот (но не D-изомеров) — активный
процесс, требующий затраты энергии.
Аминокислоты переносятся через кишечную
стенку от слизистой её поверхности в
кровь (рис. 9-4). Перенос через щёточную
кайму осуществляется целым рядом
переносчиков, многие из которых действуют
при участии Nа+-зависимых
механизмов симпорта, подобно переносу
глюкозы (см. раздел 7).
Различная
скорость проникновения аминокислот
через мембраны клеток указывает на
наличие транспортных систем, обеспечивающих
перенос аминокислот как через внешнюю
плазматическую мембрану, так и через
внутриклеточные мембраны. В настоящее
время известно по крайней мере пять
специфических транспортных систем,
каждая из которых функционирует
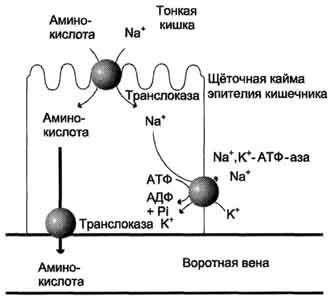
Рис.
9-4. Механизм всасывания аминокислот в
кишечнике. L-аминокислота
поступает в энтероцит путём симпорта
с ионом Na+.
Далее специфическая транслоказа
переносит аминокислоту через мембрану
в кровь. Обмен ионов натрия между
клетками осуществляется путём
первично-активного транспорта с помощью
Nа+,К+-АТФ-азы.
466
для
переноса определённой группы близких
по строению аминокислот:
нейтральных,
с короткой боковой цепью (аланин, серии,
треонин);нейтральных,
с длинной или разветвлённой боковой
цепью (валин, лейцин, изолейцин);с
катионными радикалами (лизин, аргинин);с
анионными радикалами (глутаминовая и
аспарагиновая кислоты);иминокислот
(пролин, оксипролин).
Причём
к числу Nа+-зависимых
относятся переносчики аминокислот,
входящих в первую и пятую группы, а
также переносчик метионина. Независимые
от Na+ переносчики
специфичны для некоторых нейтральных
аминокислот (фенилаланин, лейцин) и
аминокислот с катионными радикалами
(лизин).
Аминокислоты
конкурируют друг с другом за специфические
участки связывания. Например, всасывание
лейцина (если концентрация его достаточно
высока) уменьшает всасывание изолейцина
и валина.
Одна
из специфических транспортных систем
для некоторых нейтральных аминокислот
функционирует в кишечнике, почках и,
по-видимому, мозге. Она получила название
γ-глутамильного цикла (рис. 9-5).
В
этой системе участвуют 6 ферментов,
один из которых находится в клеточной
мембране, а остальные — в цитозоле.
Ключевую роль в транспорте аминокислоты
играет мембранно-связан-ный фермент
γ-глутамилтрансфераза. Этот
фермент является гликопротеином и
катализирует перенос γ-глутамильной
группы от глутатиона (иногда другого
γ-глутамильного пептида) на транспортируемую
аминокислоту и последующий перенос
комплекса в клетку. Глутатион представляет
собой трипептид — γ-глутамилцистеинилглицин,
который находится во всех тканях
животных. Реакция протекает следующим
образом (см. схему А на с. 468).
Аминокислота,
связанная с γ-глутамильным остатком,
оказывается внутри клетки. В следующей
реакции происходит отщепление
γ-глутамильного
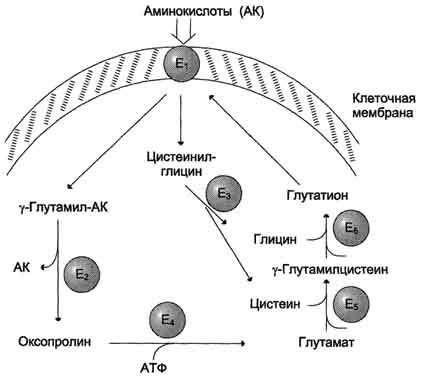
Рис.
9-5. γ-Глутамильный
цикл. Система
состоит из одного мембранного и пяти
цитоплазматических ферментов. Перенос
аминокислоты внутрь клетки осуществляется
в комплексе с глутамильным остатком
глутатиона под действием
γ-глутамилтрансферазы. Затем аминокислота
освобождается, а γ-глутамильный остаток
в несколько стадий превращается в
глутатион, который способен присоединять
следующую молекулу аминокислоты. Е1 —
γ-глутамилтрансфераза; Е2 —
у-глутамилциклотрансфераза; Е3 —
пептидаза; Е4 —
оксопролиназа; Е5 —
γ-глутамилцистеинсинтетаза; Е6 —
глутатионсинтетаза.
467
остатка
под действием фермента
γ-глутамилциклотрансферазы (см. схему
Б).
Дипептид
цистеинилглицин расщепляется под
действием пептидазы на 2 аминокислоты
— цис-теин и глицин. В результате этих
3 реакций происходит перенос одной
молекулы аминокислоты в клетку (или
внутриклеточную структуру). Следующие
3 реакции обеспечивают регенерацию
глутатиона, благодаря чему цикл
повторяется многократно. Для транспорта
в клетку одной молекулы аминокислоты
с участием γ-глутамильного цикла
затрачиваются 3 молекулы АТФ.
Д.
Нарушение переваривания белков и
транспорта аминокислот
Небольшую
долю продуктов переваривания белка
составляют негидролизованные короткие
пептиды. У некоторых людей возникает
иммунная реакция на приём белка, что,
очевидно, связано со способностью к
всасыванию
таких
пептидов. Продукты полностью переваренного
белка (аминокислоты) лишены антигенных
свойств и иммунных реакций не вызывают.
У
новорождённых проницаемость слизистой
оболочки кишечника выше, чем у взрослых,
поэтому в кровь могут поступать антитела
молозива (секрет молочных желёз,
выделяющийся в первые дни после родов,
обогащённый антителами и антитоксинами).
Это усугубляется наличием в молозиве
белка — ингибитора трипсина. Протеолитические
ферменты в пищеварительных секретах
новорождённых обладают низкой
активностью. Всё это способствует
всасыванию в кишечнике небольшого
количества нативных белков, достаточного
для обеспечения иммунной реакции.
Очевидно, подобное усиление всасывающей
способности кишечника является причиной
наблюдаемой иногда непереносимости
белков пищи (например, молока и яиц) у
взрослых людей.
Гниение
Известно,
что микроорганизмы кишечника
для своего роста также нуждаются в
доставке с пищей определенных аминокислот.
Микрофлора кишечника располагает
набором ферментных систем, отличных
от соответствующихферментов животных тканей и
катализирующих самые разнообразные
превращения пищевых аминокислот.
В кишечнике создаются оптимальные
условия для образования ядовитых
продуктов
распада аминокислот: фенола,индола, крезола, скатола, сероводорода,
метилмер-каптана, а также нетоксичных
для организма соединений: спиртов, аминов, жирных
кислот,кетокислот, оксикислот и
др.
Все
эти превращения аминокислот,
вызванные деятельностью микроорганизмовкишечника,
получили общее название «гниение белков в
кишечнике». Так, в процессе
распада серосодержащих
аминокислот (цистин, цистеин, метионин)
в кишечнике образуются сероводород H2S
и метил-меркаптан CH3SH.
Диаминокислоты – орнитин и лизин –
подвергаются процессудекарбоксилирования с
образованием аминов –
путресцина и кадаверина.
Из
ароматических аминокислот: фенилаланин, тирозин и триптофан –
при аналогичном
бактериальном декарбоксилировании образуются
соответствующие амины: фенилэтиламин,
параоксифенилэтиламин (или тира-мин)
и индолилэтиламин (триптамин).
Кроме того, микробные ферментыкишечника
вызывают постепенное разрушение боковых
цепей циклическихаминокислот,
в частности тирозина и триптофана,
с образованием ядовитых продуктов
обмена – соответственно крезола и фенола, скатола и индола.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
Каждые сутки в организм человека всасывается примерно 100 граммов аминокислот, которые поступают в кровь. Еще 400 граммов аминокислот поступает ежесуточно в кровь в результате распада собственных белков тела. Все эти 500 г аминокислот представляют собой метаболический пул аминокислот.
Припереваривании происходит гидролиз пищевых белков до свободных аминокислот. Процесс переваривания начинаетсяв желудке и продолжается в тонкойкишке под действием протеолитических ферментов, которые называются протеиназами или пептидазами. Существует много разных протеиназ. Они имеются не только в желудочно-кишечном тракте, но и в клетках.
Пути использования аминокислот изображены на рис. 1
Рисунок 1
Ферменты, участвующие в переваривании белков, обладают относительной субстратной специфичностью, которая обусловлена тем, что пептидазы быстрее гидролизуют пептидные связи между определенными аминокислотами, что позволяет за более короткое время расщепить белковую молекулу.
В зависимости от места расположения в пептиде гидролизуемой связи всепептидазы делятся на:эндопептидазы, которые действуют на пептидные связи, удаленные от концов пептидной цепи (пепсин, трипсин, химотрипсин, эластаза); экзопептидазы, которые действуют на пептидные связи, образованные N- и С-концевыми аминокислотами (аминопептидаза, карбоксипептидазы А и В).
Желудочные и панкреатические пептидазы вырабатываются в неактивной форме (проферменты), секретируются к месту действия, где активируются путем частичного протеолиза (отщепление пептида различной длины с N-конца молекулы профермента).
Место синтеза проферментов (слизистая оболочка желудка, поджелудочная железа) иместо их активации (полость желудка, тонкой кишки)пространственно разделены. Такоймеханизм образования активных ферментов необходим для защиты секреторных клеток желудка и поджелудочной железы от самопереваривания.
Пепсин
Это фермент желудочного сока. Синтезируется в клетках слизистой оболочки желудка в форме неактивного предшественника — пепсиногена. Превращение неактивного пепсиногена в активный пепсин происходит в полости желудка. При активации отщепляется пептид, закрывающий активный центр фермента. Активация пепсина происходит под действием двух факторов: а) соляной кислоты (HCl); б) уже образовавшегося активного пепсина — это называется аутокатализом.
Пепсин является карбоксильной протеиназой и катализирует гидролиз связей, образованных аминокислотами фенилаланином или тирозином, а также связь Лей-Глу. pH-оптимум пепсина равен 1.0-2.0 рН, что соответствует рН желудочного сока.
Реннин
В желудочном соке грудных детей переваривание белков осуществляет фермент РЕННИН, который расщепляет белок молока казеин. Реннин похож по строению на пепсин, но его рН-оптимум соответствует рН среды желудка грудного ребенка (рН=4.5). Реннин отличается от пепсина также механизмом и специфичностью действия.
Химотрипсин.
Синтезируется в поджелудочной железе в форме неактивного предшественника — химотрипсиногена. Активируется химотрипсин активным трипсином и путем аутокатализа. Разрушает связи, образованные карбоксильной группой тирозина, фенилаланина или триптофана, либо крупными гидрофобными радикалами лейцина, изолейцина и валина.
Трипсин
Синтезируется в поджелудочной железе в форме неактивного предшественника — трипсиногена. Активируется в полости кишечника ферментом энтеропептидазой при участии ионов кальция, а также способен к аутокатализу. Гидролизует связи, образованные аргинином и лизином.
Эластаза.
Синтезируется в поджелудочной железе в виде неактивного предшественника — проэластазы. Активируется в полости кишечника трипсином. Гидролизует пептидные связи, образованные глицином, аланином и серином.
Под действием этих протеиназ полипептидная цепь белка расщепляется на крупные фрагменты. Затем на эти крупные фрагменты действуют ЭКЗОПЕПТИДАЗЫ, каждая из которых отщепляет одну аминокислоту от концов полипептидной цепи.
Карбоксипептидазы.
Синтезируются в поджелудочной железе. Активируются трипсином в кишечнике. Являются металлопротеинами. Гидролизуют пептидные связи на С-конце молекулы белка. Бывают 2-х видов: карбоксипептидаза А и карбоксипептидаза В. Карбоксипептидаза А отщепляет аминокислоты с ароматическими (циклическими) радикалами, а карбоксипептидаза В отщепляет лизин и аргинин.
Аминопептидазы.
Синтезируются в слизистой оболочке кишечника. Гидролизуют пептидные связи на N-конце молекулы белка. Существуют 2 таких фермента: аланинаминопептидаза и лейцинаминопептидаза. Аланинаминопептидаза отщепляет только аланин, а лейцинаминопептидаза — любые N-концевые аминокислоты.
Источник
Ферменты поджелудочной железы считаются одним из самых важных факторов, которые влияют на функционирование всей системы пищеварения. Именно эти соединения отвечают за различные процессы. К примеру, вещества секрета поджелудочной железы расщепляют протеины, углеводистые компоненты, жиры, прочие вещества. Они стимулируют работу пищеварительного тракта, ускоряют обменные явления.
Функции ферментативных компонентов
Поджелудочный орган считается важным, одной из главных функций которого является продуцирование ферментов поджелудочной железы. В целом, этот внутренний орган синтезирует сок, а уже в его состав включены различные ферментативные компоненты, выработанные органом, вода, электролитные компоненты и пр. Именно их наличие считается главным условием запуска процесса переваривания пищевого кома. Панкреатические соки вместе с такими соединениями попадают в тонкий отдел кишечника. В 12-перстной кишке они расщепляют жиры, углеводистые компоненты сложного типа, протеины.
Важно знать, какие ферменты вырабатывает поджелудочная железа. Их условно разделяют на 3 группы:
- Липаза — расщепление жиров, которые не могут напрямую проникать в кровь.
- Амилаза — превращает крахмал в олигосахарид.
- Протеаза — расщепляет протеины и превращает их в пептиды.
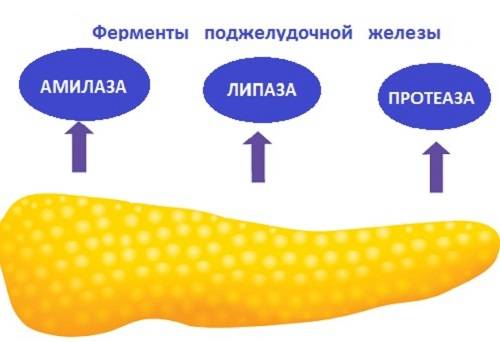
Кроме того, орган продуцирует и другие вещества пищеварительного типа, которые восстанавливаются в организме человека и влияют на то, чтобы в дальнейшем они преобразовывали олигосахариды в глюкозу. Когда последнее вещество поступает в кровь, то она превращается в основной источник энергии. Эластаза расщепляет разнообразные типы протеинов и эластин.
Все ферменты поджелудочной железы располагаются непосредственно в соке этого органа. В этой среде они все время остаются пассивными, чтобы не расщеплять ткани железы. Они активизируются только, когда накапливается определенное количество желчи. В тонком отделе кишечника вырабатываются такие вещества, как энтерокиназа, которое преобразует трипсиноген и делает его активным, и восстановить его не получится в дальнейшем. Выработка трипсиногена проводится железой в проферментативной форме. Именно в таком положении этот компонент и находится в тонком отделе кишечника. Трипсин входит в список основных активаторов прочих ферментов подобного типа. Активное вещество начинает процесс автокатализа, из-за чего действует уже как основное вещество.
Ферменты начинают вырабатываться сразу же, как только человек начинает питаться, и пищевой ком переходит в тонкий отдел кишечника. Процедура синтеза ферментов не останавливается в дальнейшем в течение 12 часов.
Виды ферментов
Первой группой являются липолитические ферменты поджелудочной железы. Они отвечают за то, чтобы жиры, которые поступают вместе с едой, расщеплялись на кислоты жирного типа и глицерол. Эту группу веществ называют просто липазой. Клетки поджелудочной железы вырабатывают пролипазу, т. е. липазу неактивного типа. Дальше такой компонент попадает в 12-перстную кишку и объединяется с протеином колипаза. Его основной функцией является как раз активизация липазы.
Липолитическая составляющая липазы не является активной, если отсутствуют в желчи достаточное количество солей желчных кислот. Активизируется липаза посредством трипсина. Фильтрация липолитических веществ проводится в клубочках почек. Затем в канальцах этих органов липаза обратно всасывается через ткани, так что в моче не удается обнаружить эти частицы. Распад осуществляется за 7–14 часов. Кстати, лучше знать, что существует не только липаза, которая вырабатывается в поджелудочной железе, но и есть еще аналоги в печени, кишечнике, легких. Также известна липаза лингвального типа. Содержание такого вещества в панкреатическом соке в 20 тыс. раз больше, чем в составе крови. Как только орган воспаляется, то липаза в большом количестве попадает непосредственно в систему циркулирования крови.
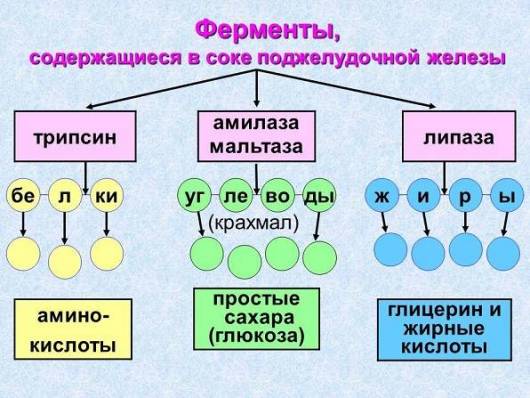
2 группа — амилолитические ферменты. Их обозначают как альфа, бета и гамма. В человеческой системе пищеварения задействована только альфа-амилаза. Эту группу называют еще «крахмал».
Для восстановления определенных процессов небольшое количество амилазы вырабатывается еще в слюнных железах. Из-за этого во время пережевывания присутствует легкий сладковатый привкус, особенно это касается продуктов, которые содержат крахмал, например, картошка либо рис. Именно благодаря амилазе эти продукты хорошо перерабатываются, а сам процесс пищеварения начинается еще при их пережевывании.
Амилаза разъединяет углеводы сложного типа на более простые составляющие. Наиболее количество таких ферментативных соединений находится как раз в соке, который переходит из железы в 12-перстную кишку. Крахмал имеет очень сложную структуру частиц, так что кишечник плохо всасывает это вещество.
3 группа — это протеолитические ферменты. Они тоже синтезируются в железе. Эти вещества ответственны за то, чтобы распадались связующие между аминокислотами, которые находятся в протеинах и пептидах. Это главный компонент сока, который отвечает за разъединение белков.
Выделяют 2 основные разновидности протеазы:
- Пептидаза. Они еще известны как экзопептидазы. Эти вещества в основном отвечают за осуществление гидролиза внешних связей пептидов.
- Протеиназа либо эндопептидаза. Они обычно расщепляют внутренние связи пептидов.
Симптомы дефицита ферментов поджелудочной железы
Ферменты для поджелудочной железы являются важным веществом, которые отвечают за процесс переваривания еды. Если их содержание в желудочном соке уменьшается, то это приводит к развитию панкреатита хронического типа. Поэтому требуется восстановить их.
Обычно причинами в этом случае являются следующие факторы:
- Чрезмерное употребление спиртных напитков.
- Неправильный режим питания, нерегулярность, нездоровые пищевые привычки.
- Заболевания инфекционной природы.
- Травмы органов и различные болезни, которые им сопутствуют.
- Бесконтрольное употребление препаратов, в том числе это касается и такой группы, как ингибиторы ферментов. Эти вещества замедляют процессы, связанные с ферментами. Однако это может касаться и других групп медикаментов.
Когда не вырабатываются в достаточной мере ферменты поджелудочной железы, препараты помогают с этим справиться, но назначает их только доктор. При дефиците таких соединений в поджелудочной железе нарушается весь процесс переваривания пищи. В итоге развиваются общие симптомы, которые характерны для воспалительных процессов в поджелудочной железе.

К ним относится следующее:
- Ощущается боль под ребрами с левой стороны. Болевой синдром может развиваться как после трапезы, так и независимо от этого.
- Ухудшается или пропадает совсем аппетит.
- Человек начинает быстро уставать, даже при незначительных нагрузках.
- Постоянно чувствуется тошнота. Она даже переходит в позывы ко рвоте. Обычно возникает такой симптом после употребление определенных продуктов питания.
- В области живота чувствуется тяжесть, метеоризм, вздутие.
В зависимости от степени тяжести болезни симптомы могут выражаться по-разному. Чем сильнее протекает недуг, тем ярче будут проявления заболевания. Кроме общих симптомов, характерных для патологий поджелудочной железы, существуют еще и специфические признаки, которые зависят непосредственно от сбоев в выработке того или иного ферментативного вещества в панкреатическом соке.
Характерные признаки:
- При дефиците липазы развивается такое состояние, как стеаторея, т. е. возрастает количество жиров в кале. Сами каловые массы приобретают желтоватый или оранжевый оттенок. По консистенции они становятся маслянистыми либо жидкими.
- При недостатке амилазы развиваются такие признаки: позывы к опорожнению кишечника появляются намного чаще, стул становится по консистенции водянистым, авитаминоз, похудение. Развивается непереносимость определенных продуктов, которые содержат большое количество углеводов. Нарушается процесс всасывания веществ в тонком отделе кишечника.
- При дефиците трипсина в кале можно обнаружить протеиновые волокна, которые не переварились. У человека развивается анемия.
Как только появляются подобные симптомы, необходимо обратиться в больницу, где доктор проведет анализ и назначит соответствующие таблетки.
Ферментные препараты
После того как все анализы подтверждены, назначаются специальные ферментные препараты для поджелудочной железы. Они стабилизируют синтез ферментов, которые участвуют в процессе переваривания еды. Выделяют 2 основные группы таких препаратов — ферментные и антиферментные. Первые средства необходимы для того, чтобы вводить в организм человека вещества ферментной природы, которые вырабатываются поджелудочной железой в недостаточном количестве. Что касается 2 группы, то подобное лекарство способно устранить последствия избытка синтеза ферментов в организме человека.
Когда поджелудочная железа не выполняет в полной мере свои функции, то назначаются ферментные медикаменты, чтобы восстановить работу. Примером являются следующие:
- Панкреатин. Это средство, которое получают из поджелудочной железы крупных домашних животных. Препарат включает трипсин и амилазу. Обычно назначается для того, чтобы понизить уровень кислотности желудочного сока. Кроме того, показаниями к применению является гипофункция печени, поджелудочной железы и других органов, которые участвуют в пищеварении.
- Фестал. Этот препарат содержит протеазу, амилазу, липазу и некоторые вещества желчи. Продукт улучшает процесс переваривания еды, избавляет от чувства тяжести и боли в животе.
- Ораза. Препарат содержит комплекс ферментов протеолитического амилолитического типа. Применяется, когда угнетена функция поджелудочной железы.
Кроме того, известны еще и различные растительные ферменты, которые применяются с той же целью: Сомилаза, Юниэнзим.
Когда в организме выделяется избыточное количество ферментов, то доктор подбирает антиферментные средства. К примеру, подойдут следующие:
- Пантрипин. Это средство угнетающе воздействует при чрезмерной активности ферментов протеолитического типа. В ходе такой терапии обязательно требуется контролировать уровень концентрации амилазы в моче и крови пациента.
- Апротинин. Этот препарат полипептидного типа. Тоже угнетающе воздействует, но только при чрезмерной активности плазмина, трипсина и некоторых других ферментативных соединений поджелудочной железы.
Заключение
Ферменты поджелудочного сока являются чрезвычайно важной составляющей всей пищеварительной системы. Их вырабатывает поджелудочная железа, но иногда в недостаточном количестве, и тогда необходимо восстановить их специальными препаратам.
Железа синтезирует различные группы таких компонентов, которые влияют на метаболические процессы во всем организме, ускоряют расщепление пищи на составляющие и пр. При их нехватке в организме человека предписывается специальная терапия, которая позволяет нормализовать уровень концентрации таких соединений. Чтобы они могли восстанавливаться, назначаются соответствующие медикаменты, которые подбирает только лечащий врач после проведения диагностики.
Источник


