Главный стимулятор клеток поджелудочной железы
Анатомо-физиологические особенности поджелудочной железы.
Поджелудочная железа.
Поджелудочная железа — орган как
внешней (экзокринной) так и внутренней (эндокринной) секреции. Основную
массу железы составляет экзокринная ткань, состоящая из ацинозных
клеток. Эти клетки образуют округлые структуры — ацинусы, в полость
которых выводятся пищеварительные ферменты. Между ацинусами разбросаны
островки Лангерганса, содержащие небольшое число крупных альфа-клеток,
многочисленные бета-клетки и дельта клетки.

Рис. 14.13 Схема микроскопического строения островков Лангерганса.
1 — островки Лангерганса; 2 — бета -клетки; 3 — альфа-клетки; 4 — ацинусы поджелудочной железы; 5 — эритроциты.
Альфа-клетки
секретируют глюкогон, бета-клетки — инсулин, дельта-клетки
вырабатывают соматостатин. Около 60% приходится на бета-клетки, 25% на
альфа-клетки и 15% на дельта клетки. Общий объем этих клеток не
превышает 3% объема всей поджелудочной железы.
Гормоны поджелудочной железы.
Инсулин. Молекула инсулина состоит из двух пептидных цепей. Аминокислотный
состав инсулина варьирует, лишь 40% аминокислотных остатков инсулина
неизменны. Инсулин — универсальный анаболический гормон, т.е. гормон.
действующий на ассимиляционные процессы синтеза из более простых
химических веществ в более сложные. Повышение количества инсулина в
крови ведет к увеличению потребления глюкозы клетками ткани.
Благодаря
повышению проницаемости мембраны клеток к глюкозе происходит отложение
глюкозы в печени и мышцах в форме гликогена что снижает количество
глюкозы в крови. Глюкоза может свободно диффундировать в клетки печени
и выходить из них когда ее содержание в крови снижается.
Повышенное
содержание глюкозы в крови — это наиболее сильный стимул для секреции
бета-клетками инсулина. Бета-клетки могут активироваться пептидными
гормонами желудочно-кишечного тракта, а также парасимпатической
нервной системой. Этим эффектам противодействует активность
симпатической нервной системы, угнетающей секрецию инсулина. В
состоянии покоя преобладает действие парасимпатической системы, что
способствует перевариванию пищи, а в состоянии стресса преобладает
влияние симпатической нервной системы.
Инсулин тормозит
(ингибирует) ферменты, расщепляющие гликоген, благодаря чему происходит
накопление гликогена. При питании углеводной пищей происходит быстрый
синтез гликогена и торможение его расщепления.

Рис. 14.14 Регуляция активности островковых клеток Лангерганса.
Секреция
инсулина стимулируется высокой концентрацией в крови глюкозы и
аминокислот и угнетается адреналином. Секреторная активность
альфа-клеток, вырабатывающих глюкагон, подавляется высокой
концентрацией глюкозы в крови и стимулируется ее падением; аминокислоты
оказывают противоположное действие. Секретируемый альфа-клетками
глюкагон, действуя паракринным путем, угнетает секрецию инсулина
бета-клетками. Секреция соматостатина дельта-клетками стимулируется
высоким уровнем глюкозы, аминокислот и жирных кислот, а также гормонами
желудочно-кишечного тракта. Паракринным путем соматостатин угнетает
секрецию инсулина бета-клетками.
В связи с этим концентрация сахара в крови быстро возвращается к исходному уровню.
Когда
организму требуется энергия в промежутках между приемами пищи, гликоген
опять превращается в глюкозу, и глюкоза свободно выходит из клеток
печени в кровь путем диффузии. Таким образом, поддерживается постоянный
уровень глюкозы в крови между приемами пищи. Повышение концентрации
инсулина делает мышечные клетки проницаемыми для глюкозы. Видимо,
связываясь с рецептором на поверхности мышечных клеток, инсулин
активирует механизм транспорта глюкозы через мембрану.
Влияние
инсулина ведет к тому, что печень может запасать ограниченное
количество гликогена. Излишки поступившей в печень глюкозы превращаются
в жир.
Инсулин обеспечивает активный транспорт в клетки многих
аминокислот. Повышение концентрации аминокислот в клетках после приема
пищи приводит к стимуляции синтеза белка на рибосомах. Это связано с
повышением скорости транскрипции РНК в ядре и тем самым увеличением
числа и-РНК.
Глюкагон по своим функциям является антагонистом
инсулина. Он усиливает расщепление гликогена в печени и повышает
уровень сахара в крови.
Соматостатин впервые был обнаружен в
гипоталамусе. Впоследствии он был найден во многих тканях, где он
является ингибитором. Действуя паракринным образом, он угнетает
секрецию инсулина и глюкагона. При высоких концентрациях глюкозы
секреция соматостатина возрастает. Таким образом, соматостатин тормозит
секрецию инсулина, предотвращая его перепроизводство при гипергликемии.
Кроме того, он угнетает перистальтику желудочно-кишечного тракта и
желчного пузыря, уменьшает секрецию пищеварительных соков, вследствие
чего замедляется всасывание пищи.
Значительное уменьшение глюкозы в
крови (гипогликемия) ведет к потере сознания, т.е. к гипогликемическому
шоку. При поражении поджелудочной железы при недостаточной секреции
инсулина возникает заболевание сахарный диабет, заключающийся в
повышении количества глюкозы в крови (гипергликемия). Резко
увеличивается ее количество при приеме углеводов, т.к. глюкоза не
полностью утилизируется тканями и не превращается в гликоген.
Гипергликемия также может приводить к потере сознания в результате
гипергликемического шока.
Роль поджелудочной железы в пищеварении.
Панкреатическая секреция.
Поджелудочная
железа вторая по величине пищеварительная железа. Она выделяет до 2 л.
пищеварительного сока в сутки. Масса этой железы — 70-110 г. длина —
около 17 см. В железе выделяют головку, тело и хвост. Гистологически
большая часть поджелудочной железы имеет типичное строение экзокринной
железы — мелкие протоки собирают секрет, вырабатываемый клетками
концевых отделов железы, и несут его в более крупные протоки. Проток
поджелудочной железы проходит через всю железу.
В поджелудочной железе имеются два вида
клеток. Одни вырабатывают сок, участвующий в пищеварении, другие —
гормоны, регулирующие углеводный обмен, — инсулин, глюкогон и
соматостатин.
Наиболее важные компоненты поджелудочного сока — это
бикарбонат, нейтрализующий кислое содержимое желудка, и пищеварительные
ферменты: пептидазы, расщепляющие белки, липаза, действующая на жиры,
амилаза, расщепляющая углеводы.
Пептидазы — ферменты, расщепляющие
пептидные связи между аминокислотами в белках. Они выделяются в форме
не активных предшественников, которые затем активизируются. В то же
время липаза и амилаза секретируются в активной форме. Среди пептидаз
выделяют эндопептидазы, расщепляющие пептидные связи между соседними
аминокислотными остатками, и эктопептидазы, действующие на концевые
пептидные связи. Пептидазы активируются энтерокиназой, выделяемой
слизистой двенадцатиперстной кишки. Энтерокиназа катализирует
превращение неактивного трипсиногена в активный трипсин. В
панкреатическом соке присутствует также активное вещество, которое
блокирует действие трипсина при его прохождении через поджелудочную
железу, препятствуя ее переваривающему действию.
Ферментный состав
сока зависит от характера питания. Под влиянием поджелудочной железы в
кишечнике происходит наиболее значительная по объему химическая
обработка всех компонентов пищи. Ферменты поджелудочной железы
обеспечивают в основном процессы полостного переваривания, расщепление
крупномолекулярных соединений.
Гормональная и рефлекторная регуляция панкреатической секреции.
Наиболее
эффективными стимуляторами экзокринной регуляции поджелудочной железы
являются гормоны секретин и холецистокинин. Секретин влияет на клетки,
выстилающие протоки поджелудочной железы и секретирующие, главным
образом, бикарбонат, некоторые ионы и воду. Холецистокинин стимулирует
клетки, образующие ферменты.
Нервная регуляция осуществляется
парасимпатической системой — блуждающим нервом, который подобно
холецистокинину вызывает выделение секрета, богатого ферментами.
Фазы панкреатической секреции.
Выделяют следующие фазы секреции поджелудочного сока: условнорефлекторную, желудочную и кишечную.
Во
время условно-рефлекторной фазы происходит выделение поджелудочного
сока, связанное с запахами пищи, ее вкусом, актом глотания, повышается
секреция бикарбоната до 10-15%, а ферментов -до 25% максимального
уровня. В состоянии покоя секреция бикарбоната и ферментов составляет
соответственно 2-3% и 10-15% максимального уровня.
Во время
желудочной и кишечной фазы секреция поджелудочного сока нарастает.
Наиболее важная кишечная фаза начинается с поступления химуса в
двенадцатиперстную кишку. Это стимулирует выделение секретина и
холицистокинина. Стимулом для выделения секреции секретина служит
повышение кислотности при попадании кислого содержимого желудка в
двенадцатиперстную кишку. Благодаря этому нейтрализуется кислая среда,
которая могла бы повредить слизистую тонкого кишечника.
Секрецию
холецистокинина эндокринными клетками слизистой тонкого кишечника
стимулируют продукты переваривания белков и жиров — пептиды,
аминокислоты и жирные кислоты.
Поджелудочная железа обладает
большими компенсаторными возможностями. Она образует в 10 раз больше
ферментов, чем требуется для переваривания, поэтому даже после удаления
90% железы активности оставшихся 10% достаточно для предотвращения
несварения пищи.
При патологии может происходить самопереваривание
поджелудочной железы собственными ферментами, что приводит к
панкреатиту. В далеко зашедшем развитии этого заболевания оно может
привести к смерти.
Панкреатический сок представляет собой продукт секреции ацинозных
клеток экзокринной поджелудочной железы, вливающийся в
двенадцатиперстную кишку через проток Вирсунга, а иногда и через
добавочный проток Санторини. Выделяемое количество в течение суток
равняется 1—1,5л. Имеет выраженно щелочную реакцию (рН —8,2—8,5),
благодаря высокому содержанию бикарбоната натрия. Из органических
веществ наиболее важными являются энзимы. До настоящего времени
идентифицировано 10 энзимов и их число продолжает возрастать.
Они
оказывают свое действие на все главные пищевые элементы, а именно: на
белки, жиры и глюциды. Энзиматическое протеазное оснащение
панкреатического сока обладает силой, необходимой для гидролизирования
белков вплоть до конечной стадии аминокислот. Так, трипсин, который
выделил в чистом виде Northrop (1934), является эндопептидазой, которая
расщепляет как большие бельковые молекулы, так и несложные пептиды.
Действует специфическим образом, разъединяя пептидные связи
карбоксильного радикала двух основных аминокислот, а именно — лизина и
аргинина. Этот процесс является более эффективным, если белки
предварительно подвергались действию пепсина. Трипсин действует и на
нуклеопротеины до момента выделения нуклеиновых кислот, когда это
действие перенимается и продолжается кишечным соком. Действует в
щелочной среде, при рН = 7—9, зависящим от степени ионизации
находящейся под его действием молекулы. Нейтральные соли и, в
особенности, хлориды обладают невыраженным активирующим действием,
вероятно, из-за того, что они способствуют дисперсии коллоидальных
мицелл и повышают их предрасположенность к пропитыванию энзимом.
Чистый
панкреатический сок не обладает протеолитическим действием.
Панкреатические гландулярные клетки вырабатывают зимогенный
предшественник — инактивный трипсиноген. При рН, равном 7—8, последний
превращается самопроизвольно в активный трипсин, путем
аутокаталитической реакции, которой способствует наличие Са++. В
кишечнике катализация осуществляется протеиназой (энтерокиназой).
Активация состоит в прерывании пептидной связи с отделением одного
гексапептида от молекулы трипсиногена. Как и пепсиноген, трипсиноген,
вероятно, представляет собой тормозящий трипсин комплеск, разложение
которого активируется энтерокиназой с последующим появлением активного
энзима. Ввиду того, что этот птоцесс возникает внезапно и протекает
бурно, достаточны следы активатора для того, чтобы вызвать эту реакцию,
которая затем продолжается в течение неограниченного времени,
независимо от количества добавляемого инактивного сока. Под влиянием
активатора образуется трипсин, который затем каталитическим образом
превращает свой собственный предшественник.
Химотрипсин представляет
собой эндопептидазу, которая вызывает гидролиз пептидных соединений в
карбоксильных группах тирозина и фенилаланина, при оптимальном рН,
равном 8. Химотрипсиноген является анактивным предшественником,
вырабатываемым панкреатическими гландулярными клетками, и который
активируется трипсином путем последовательного разрыва нескольких
пептидных связей. В отличие от трипсина, который свертывает кровь,
химотрипсин обладает свойством свертывать молоко. Он имеется в обильном
количестве в верхних отделах тонкого кишечника и гораздо меньше-в
подвздошной кишке. Химотрипсин не выделяется кишечными железами
(Бруннера или Либеркюна), а происходит из лейкоцитов пейровых бляшек.
Карбоксипептидаза
является панкреатической экзопептидазой, укорачивающей полипептиды на
одну аминокислоту, которую она отделяет от окончания со свободной
карбоксильной группой. Инактивный предшественник, вырабатываемый
панкреатическими гландулярными клетками, называемый
предкарбоксипептидазой, имеет молекулярный вес 96000. В присутствии
цинка, имеющего роль кофактора, трипсин превращает
предкарбоксипептидазу в активный энзим, молекулярный вес которого равен
34000. В панкреатическом соке находятся и другие протеолитические
энзимы, как: лейцинаминопептидаза, выделяющая лейцин из полипептидной
цепи, протаминаза, которая специфически отделяет аргинин от протаминов
и рибонуклеаза, катализирующая гидролиз рибонуклеиновой кислоты.
Защита
от самопереваривания поджелудочной железы реализуется путем секреции
протеаз в форме их инактивных предшественников. С другой стороны,
панкреатическая гландулярная ткань обладает свойством разрушать
собственные энзимы или нейтрализовать их при помощи антиэнзимов, каким
ялвяется, например, антитрипсин.
Панкреатическая амилаза,
абдоминальное аналогическое со слюнной амилазой вещество, представляет
собой эндоамилазу, расщепляющую альфа-глюкозидные связи 1 —4. Гораздо
более активная чем птиалин, она может подвергать гидролизу в течение 30
минут количество крахмала, превышающее в 20000 раз ее собственную
тяжесть. Она действует при оптимальном рН —6,9-7, растворяя крахмал и
превращая его в декстрин, а затем в сахар. Необходимым для активации
энзима является присутствие иона Сl (-). Предполагалось и существование
панкреатической мальтазы, которое, однако, не было доказано.
Панкреатическая
липаза представляет собой наиболее активную эстеразу пищеварительного
тракта, которая при помощи гидролиза отделяет жирные кислоты от
глицерина при рН, который колеблется между 7 и 5 Активаторами являются
ионы Са++ и Мg++, а также и хлориды, карбонаты и бикарбонаты Na и К.
Главная ее особенность состоит в том, что она активна в отношении не
растворимых в воде триглицеридов с длинной цепью. Липазная реакция
протекает поэтапно, отделяя последовательным образом три липидные
связи. В конечном результате гидролиза, осуществляется равновесие между
80% свободных жирных кислот, 10% остающихся связанными в соединениях
ди- и моноглицеридов и 10% — — оставшихся незатронутыми в
триглицеридах. Желчные соли косвенным образом вызывают активацию
энзима, благодаря их эмульгирующему действию, которое увеличивает
площадь соприкосновения между энзимом и субстратом.
Панкреатический
сок содержит также и холестеролэстеразу, которая катализирует
эстерификацию холестерина жирными кислотами, происходящими вследствие
липолиза, а также и лецитазу, разлагающую фосфоаминолипиды на жирные
кислоты и глицерофосфат холина, который в дальнейшем подвергается
гидролизу действием фосфатазы.
Нейро-гуморальная регуляция панкреатической секреции (схема).
Источник
Эндокринная
часть поджелудочной железы образована
лежащими между ацинусов панкреатическими
островками, или островками Лангерганса
— светлыми
образованиями размером 50— 500 мкм,
состоящими из разных типов эпителиальных
клеток (альфа-, бета-и дельта-клеток).
Островки составляют около 1,5% объема
железы; у человека их насчитывается
около 1 млн.
Островки
состоят из клеток – инсулоцитов, среди
которых на основании наличия в них
различных по физико-химическим и
морфологическим свойствам гранул
выделяют 5 основных видов:
—
бета-клетки, синтезирующие инсулин
(60—80
%);
—
альфа-клетки, продуцирующие глюкагон
(20
%);
—
дельта-клетки, образующие соматостатин;
—
D1-клетки, выделяющие ВИП;
 —
—
PP-клетки, вырабатывающие панкреатический
полипептид.
Кроме
того, методами иммуноцитохимии и
электронной микроскопии было показано
наличие в островках незначительного
количества клеток, содержащих гастрин,
тиролиберин и соматолиберин.
Островки
представляют собой компактные пронизанные
густой сетью фенестрированных капилляров
скопления упорядоченных в гроздья или
тяжи внутрисекреторных клеток. Клетки
слоями окружают капилляры островков,
находясь в тесном контакте с сосудами;
большинство эндокриноцитов контактируют
с сосудами либо посредством цитплазматических
отростков, либо примыкая к ним
непосредственно.
3.1. Инсулин: химическая природа, регуляция секреции, механизм действия, роль в обмене.
Инсулин
представляет собой простой полипептид
с молекулярной массой около 6000, состоящий
из двух линейных цепей: А — с 21 аминокислотой
и В — с 30 аминокислотами, соединенных
двумя бисульфидными мостиками. В цепи
А есть еще один «внешний» бисульфидный
мостик. Структура инсулина у различных
животных в основном совпадает. В настоящее
время принята точка зрения, согласно
которой вначале синтезируется одна
цепь аминокислот с последующим
свертыванием молекулы и образованием
бисульфидных связей. В этом процессе
участвует так называемый соединительный
пептид, или пептид С, состоящий из 33
аминокислот и соединяющий цепи А и В.
После свертывания образуется предшественник
инсулина, или проинсулин, с молекулярной
массой свыше 9000.
Биологическая
активность проинсулина составляет
примерно 10% активности инсулина.
Соединительный пептид С отщепляется
от инсулина в гранулах β-клеток перед
секрецией в кровь и поступает в нее в
количестве, эквимолекулярном инсулину.
Определение уровня пептида С является
более надежным индикатором секреции
β-клеток, чем определение собственно
инсулина, так как последний в отличие
от С-пептида частично задерживается в
печени, может подвергаться воздействию
циркулирующих противоинсулиновых
антител и подвергаться другим воздействиям,
искажающим истинную картину. Разъединение
цепей А и В приводит к полной инактивации
инсулина.

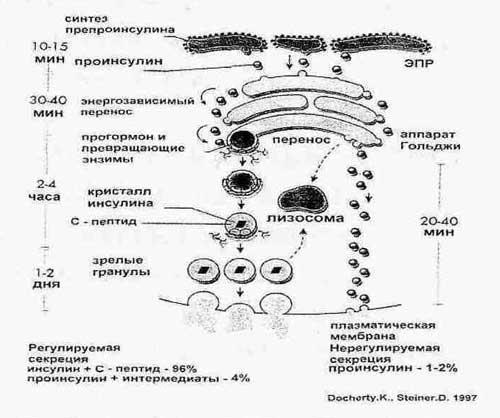

Регуляция
секреции инсулина происходит на основе
простой обратной связи, регулирующим
фактором в которой является уровень
гликемии: секреция инсулина повышается
при гипергликемии и понижается при
гипогликемии. При этом (3-клетки являются
одновременно хеморецепторами и
эффекторами. К основной регуляции
функции (3-клеток присоединяется
модулирующее влияние некоторых
гормональных факторов: СТГ, гормонов
надпочечников — стероидов и катехоламинов.
Вероятно, в интраинсулярной регуляции
участвуют глюкагон и соматостатин, а
также ионы кальция, связанные с
кальмодулином. Определенное влияние
на секрецию инсулина могут оказывать
и нервные факторы (блуждающий нерв).
Косвенное участие в регуляции секреции
инсулина принимают адреналин, глюкагон,
глюкокортиконцы и тиреоидные гормоны,
а соответственно, АКТГ и ТТГ, вызывающие
гипергликемию. Предполагается, что
существуют также интраинсулярные
регуляторные связи между α-, β- и
γ-клетками, в основе которых лежит
непосредственное (не связанное с
гипергликемией) стимулирующее действие
глюкагона на секрецию инсулина. К другим
эндогенным факторам, оказывающим
стимулирующее воздействие на секрецию
инсулина, относятся некоторые аминокислоты
(особенно лейцин и аргинин), ионы натрия,
холинергические вещества; высокая
внутриклеточная концентрация калия
блокирует секрецию инсулина.
Секреция
инсулина происходит постоянно, и около
50% инсулина, высвобождаемого из β-клеток,
никак не связано с приемом пищи или
иными влияниями. В течение суток
поджелудочная железа выделяет примерно
1/5 от запасов имеющегося в ней инсулина.
Главным
стимулятором секреции
инсулина является повышение концентрации
глюкозы в крови выше 5,5 ммоль/л, максимума
секреция достигает при 17-28 ммоль/л.
Особенностью этой стимуляции является
двухфазное усиление секреции инсулина:
первая
фаза длится
5-10 минут и концентрация гормона может
10-кратно возрастать, после чего его
количество понижается,вторая
фаза начинается
примерно через 15 минут от начала
гипергликемии и продолжается на
протяжении всего ее периода, приводя
к увеличению уровня гормона в 15-25 раз.
Чем
дольше в крови сохраняется высокая
концентрация глюкозы, тем большее число
β-клеток подключается к секреции
инсулина.
Стимуляция синтеза инсулина
происходит от момента проникновения
глюкозы в клетку до трансляции инсулиновой
мРНК. Она регулируется повышением
транскрипции гена инсулина, повышением
стабильности инсулиновой мРНК и
увеличением трансляции инсулиновой
мРНК.
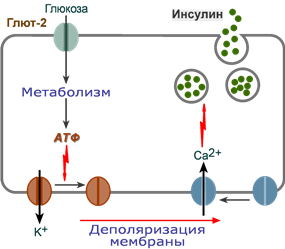
Стимуляция секреции инсулина
1.
После проникновения глюкозы в β-клетки
(через ГлюТ-1 и ГлюТ-2) она
фосфорилируется гексокиназой
IV (глюкокиназа,
обладает низким сродством к глюкозе),
2.
Далее глюкоза аэробно окисляется, при
этом скорость окисления глюкозы линейно
зависит от ее количества,
3.
В результате нарабатывается АТФ,
количество которого также прямо зависит
от концентрации глюкозы в крови,
4.
Накопление АТФ стимулирует закрытие
ионных K+-каналов,
что приводит к деполяризации мембраны,
5.
Деполяризация мембраны приводит к
открытию потенциал-зависимых Ca2+-каналов
и притоку ионов Ca2+ в
клетку,
6.
Поступающие ионы Ca2+ активируют
фосфолипазу C и запускают кальций-фосфолипидный
механизм проведения сигнала с образованием
ДАГ и инозитол-трифосфата,
7.
Появление инозитол-трифосфата в цитозоле
открывает Ca2+-каналы
в эндоплазматической сети, что ускоряет
накопление ионов Ca2+ в
цитозоле,
8.
Резкое увеличение концентрации в клетке
ионов Ca2+ приводит
к перемещению секреторных гранул к
плазматической мембране, их слиянию с
ней и экзоцитозу кристаллов зрелого
инсулина наружу,
9.
Далее происходит распад кристаллов,
отделение ионов Zn2+ и
выход молекул активного инсулина в
кровоток.
Описанный
ведущий механизм может корректироваться
в ту или иную сторону под действием ряда
других факторов, таких как аминокислоты,
жирные кислоты, гормоны ЖКТ
и других гормоны, нервная
регуляция.
Из
аминокислот на секрецию гормона наиболее
значительно влияют лизин и аргинин.
Но сами по себе они почти не стимулируют
секрецию, их эффект зависит от наличия
гипергликемии, т.е. аминокислоты только
потенциируют действие глюкозы.
Свободные
жирные кислоты также
являются факторами, стимулирующими
секрецию инсулина, но тоже только в
присутствии глюкозы. При гипогликемии
они оказывают обратный эффект, подавляя
экспрессию гена инсулина.
Логичной
является положительная чувствительность
секреции инсулина к действию гормонов
желудочно-кишечного тракта
– инкретинов (энтероглюкагона
и глюкозозависимого инсулинотропного
полипептида), холецистокинина, секретина, гастрина, желудочного
ингибирующего полипептида.
Клинически
важным и в какой-то мере опасным является
усиление секреции инсулина при длительном
воздействии соматотропного
гормона, АКТГ и глюкокортикоидов, эстрогенов, прогестинов.
При этом возрастает риск истощения
β-клеток, уменьшение синтеза инсулина
и возникновение инсулинзависимого
сахарного диабета. Такое может наблюдаться
при использовании указанных гормонов
в терапии или при патологиях, связанных
с их гиперфункцией.
Нервная
регуляция β-клеток поджелудочной железы
включает адренергическую и холинергическую регуляцию.
Любые стрессы (эмоциональные и/или
физические нагрузки, гипоксия,
переохлаждение, травмы, ожоги) повышают
активность симпатической нервной
системы и подавляют секрецию инсулина
за счет активации α2-адренорецепторов.
С другой стороны, стимуляция
β2-адренорецепторов
приводит к усилению секреции.
Также
выделение инсулина контролируется n.vagus,
в свою очередь находящегося под контролем
гипоталамуса, чувствительного к
концентрации глюкозы крови.
К
органам-мишеням инсулина можно отнести
все ткани, имеющие к нему рецепторы.
Рецепторы инсулина находятся практически
на всех клетках, кроме нервных, но в
разном количестве. Наибольшая их
концентрация наблюдается на мембране
гепатоцитов (100-200 тыс на клетку) и
адипоцитов (около 50 тыс на клетку), клетка
скелетной мышцы имеет около 10 тысяч
рецепторов, а эритроциты — только 40
рецепторов на клетку.
Нервные
клетки не имеют рецепторов к инсулину,
который просто не проникает через
гематоэнцефалический барьер.
Рецептор
инсулина представляет собой гликопротеин,
построенный из двух димеров, каждый из
которых состоит из α- и β-субъединиц,
(αβ)2.
Обе субъединицы кодируются одним геном
19 хромосомы и формируются в результате
частичного протеолиза единого
предшественника. Период полужизни
рецептора составляет 7-12 часов.
При
связывании инсулина с рецептором
изменяется конформация рецептора и
они связываются друг с другом, образуя
микроагрегаты.
Связывание
инсулина с рецептором инициирует
ферментативный каскад реакций фосфорилирования.
Первым делом аутофосфорилируются тирозиновые
остатки на
внутриклеточном домене самого рецептора.
Это активирует рецептор и ведет
к фосфорилированию остатков серина
на особом белке, называемом субстрат
инсулинового рецептора (СИР,
или чаще IRS от
англ. insulin receptor substrate).
Таких IRS выделяют четыре типа – IRS‑1,
IRS‑2, IRS‑3, IRS‑4.
Также к субстратам инсулинового рецептора
относят белки Grb-1 и Shc,
которые отличаются от IRS аминокислотной
последовательностью.
Дальнейшие
события разделяются по двум направлениям:
1.
Реакции, связанные с активностью ферментов
MAP-киназ –
в целом управляют активностью хроматина.
2.
Процессы, связанные с
активацией фосфоинозитол-3-киназы –
в основном контролируют метаболические
реакции. Сюда же относятся процессы,
которые регулируют активность глюкозных
транспортеров и
поглощение глюкозы клетками.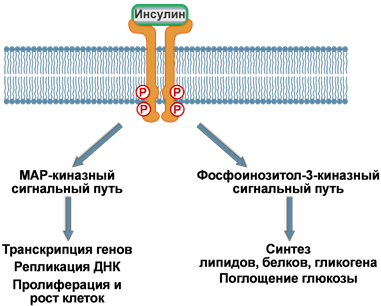
Тем
не менее, такое подразделение
условно,
так как в клетке присутствуют ферменты,
чувствительные к активации и того и
другого каскадного пути.
Соседние файлы в папке Рефераты Презентации
- #
- #
- #
- #
- #
Источник


