И патофизиология поджелудочной железы
Панкреатит — это воспаление поджелудочной железы, связанное с повреждением ее экзокринной части. Клинические проявления заболевания варьируют от слабовыраженного и ограниченного процесса до жизнеугрожающего острейшего воспаления, а течение заболевания — от транзиторных атак до утраты функции железы.
При остром панкреатите в случае устранения его причины возможно восстановление ткани поджелудочной железы. При хроническом панкреатите происходит необратимая утрата экзокринной части паренхимы поджелудочной железы.
Острый панкреатит — обратимое повреждение паренхимы поджелудочной железы, связанное с воспалением. Острый панкреатит встречается относительно часто, ежегодная заболеваемость им в западных странах составляет 10-20 случаев на 100 тыс. населения, при этом 80% наблюдений острого панкреатита связано с патологией желчных протоков и алкоголизмом.
Желчные камни обнаруживают в 35-60% наблюдений острого панкреатита, однако только у 5% пациентов с желчекаменной болезнью развивается панкреатит. Доля острого панкреатита, вызванного чрезмерным употреблением алкоголя, варьирует от 65% в США до 20% в Швеции и до 5% и менее в Южной Франции и Великобритании. Соотношение мужчин и женщин в группе с заболеваниями желчных протоков составляет 1:3, а в группе с алкоголизмом — 6:1.

Реже острый панкреатит вызывают:
— обструкция протоков поджелудочной железы. Причинами обструкции (помимо камней) могут быть периампуллярные опухоли (рак поджелудочной железы), холедохоцеле, разделенная поджелудочная железа (спорные данные), сладж-синдром желчного пузыря и паразитарные заболевания (особенно аскаридоз и хлонорхоз, вызываемый С. sinensis);
— лекарственные средства (более 85 наименований, например фуросемид, азатиоприн, 2′,3′-дидезоксииносин, эстрогены);
— инфекции (особенно эпидемический паротит);
— метаболические расстройства (например, гипертриглицеридемия, гиперпаратиреоз), сопровождающиеся гиперкальциемией;
— ишемическое повреждение при шоке, тромбозе сосудов, эмболии и васкулитах;
— травма (тупая травма живота или ятрогенное повреждение во время хирургического вмешательства либо при эндоскопической ретроградной холангиопанкреатографии);
— наследственные дефекты генов, кодирующих синтез панкреатических ферментов и их ингибиторов, включая зародышевые мутации гена PRSS1, кодирующего катионоактивный трипсиноген, и гена SPINK1.
Наследственный панкреатит. У 10-20% пациентов с острым панкреатитом невозможно обнаружить ни один из известных этиологических факторов. Несмотря на то что в таких случаях используют термин «идиопатический панкреатит», новые данные позволяют предположить, что иногда панкреатит имеет генетическую причину. Таким образом, генетические нарушения, ассоциированные с развитием панкреатита, заслуживают особого внимания.
Наследственный панкреатит характеризуется рецидивирующими тяжелыми приступами воспаления поджелудочной железы и обычно манифестирует в детском возрасте. Большинство случаев обусловлено зародышевой мутацией гена PRSS1. Такие мутации нарушают работу основного механизма, препятствующего самоперевариванию ткани поджелудочной железы, путем повреждения участка в гене PRSS1, ответственном за расщепление (инактивацию) трипсина самим трипсином. При наличии такой мутации трипсин становится резистентным к расщеплению другими молекулами трипсина.
И если даже небольшое количество такого трипсина активируется в поджелудочной железе, оно может активировать и другие пищеварительные проферменты, что приводит к развитию панкреатита. Для выработки устойчивого к расщеплению трипсина достаточно даже одного мутантного аллеля гена, т.е. такая форма наследственного панкреатита является аутосомно-доминантной.
Ген SPINK1 кодирует синтез панкреатического секреторного ингибитора трипсина, который подавляет действие трипсина, помогая предотвратить самопереваривание ткани поджелудочной железы активированным трипсином. Наследственные инактивирующие мутации гена SPINK1 также могут привести к развитию панкреатита. Эта форма наследственного панкреатита является аутосомно-рецессивной, т.к. для ее развития должны быть инактивированы оба аллеля гена.
Компьютерная томография: срезы пациентов с острым панкреатитом. Тело и хвост поджелудочной железы увеличены.
Видны следы жидкости в переднем околопочечном пространстве. Обнаружены различия в уменьшении жидкости в левом переднем околопочечном пространстве и подкожном жире.
Найдено крошечное скопление жидкости в теле поджелудочной железы. Жидкость инфильтрирует клетчатку левого переднего околопочечного пространства.
а) Морфология. Морфологическая картина острого панкреатита варьирует от незначительного воспаления и отека до выраженного распространенного некроза и обширных кровоизлияний. Основные виды повреждений:
(1) повышение проницаемости капилляров, приводящее к отеку;
(2) жировой некроз под действием липолитических ферментов;
(3) острое воспаление;
(4) разрушение паренхимы поджелудочной железы под действием протеолитических ферментов;
(5) разрушение кровеносных сосудов с кровоизлияниями.
Степень выраженности каждого из этих повреждений зависит от продолжительности и тяжести патологического процесса.
При легкой форме — остром интерстициальном панкреатите — наблюдаются незначительная воспалительная инфильтрация, интерстициальный отек и небольшие участки жирового некроза в ткани и жировой клетчатке поджелудочной железы. Жировой некроз является результатом ферментативной активности липазы. Высвобождающиеся жирные кислоты, взаимодействуя с ионами кальция, образуют нерастворимые соли, которые придают жировым клеткам вид голубых гранул.
При более тяжелой форме — остром некротизирующем (деструктивном) панкреатите — некрозу подвергаются ацинарная и протоковая ткани и островки Лангерганса. Повреждение сосудов может привести к кровоизлияниям в паренхиму поджелудочной железы. При макроскопическом исследовании в ткани поджелудочной железы выявляются красновато-черные участки кровоизлияний в сочетании с желтовато-белыми участками жирового некроза. Участки жирового некроза также могут быть в сальнике и брыжейке кишки, а также за пределами брюшной полости, например в подкожно-жировой клетчатке.
В большинстве наблюдений в брюшной полости содержится серозная, слегка мутная, с коричневатым оттенком жидкость, в которой можно обнаружить капли жира, образовавшиеся в результате действия ферментов на жировую ткань.
При самой тяжелой форме — геморрагическом панкреатите — некроз паренхимы сопровождается массивными кровоизлияниями в ткань железы.
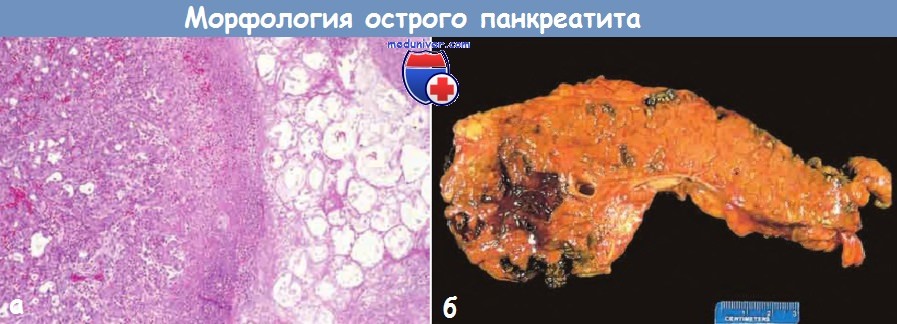
а — Острый панкреатит.
Микроскопическая картина участка жирового некроза (справа)
и очагов некроза паренхимы поджелудочной железы (в центре).
б — Острый панкреатит. Поджелудочная железа рассечена продольно.
На срезе определяются темные участки кровоизлияний в области головки железы,
а также бледная зона жирового некроза в перипанкреатической жировой клетчатке (вверху слева).
б) Патогенез. Морфологические изменения при острых формах панкреатита всегда предполагают самопереваривание ткани поджелудочной железы под действием преждевременно активированных панкреатических ферментов. Эта гипотеза подтверждается наличием наследственных форм панкреатита. Далее основное внимание будет уделено различным формам часто встречающегося приобретенного острого панкреатита.
Как уже обсуждалось, панкреатические ферменты, включая трипсин, синтезируются в форме неактивных проферментов. Если трипсин активируется преждевременно, то он может активировать другие проферменты, такие как профосфолипаза и проэластаза, которые затем повреждают жировые клетки и разрушают эластические волокна кровеносных сосудов соответственно. Трипсин также преобразует прекалликреин в активную форму, таким образом запуская систему кининов, а путем активации фактора XII (фактора Хагемана) — систему коагуляции и систему комплемента. За счет этого происходит усиление воспаления и прогрессирование тромбоза мелких сосудов, что может приводить к гиперемии и разрыву сосудов с уже поврежденной стенкой. Таким образом, аномальная активация трипсиногена является важным пусковым механизмом в развитии острого панкреатита.
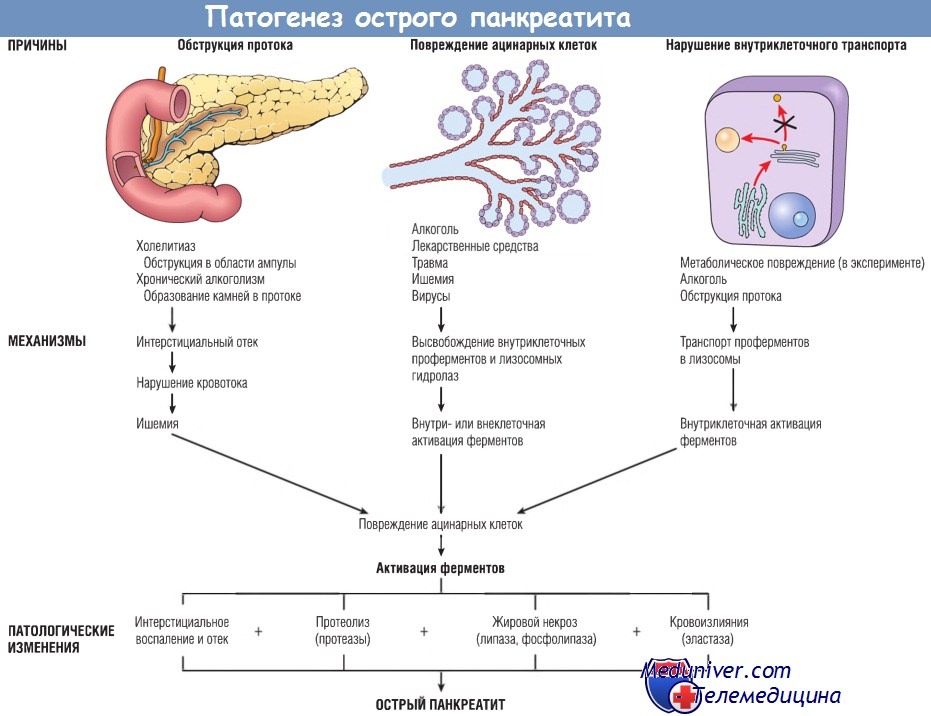
Механизмы, посредством которых происходит преждевременная активация панкреатических ферментов, до конца не ясны, однако есть данные о трех путях такой активации:
1. Обструкция протока поджелудочной железы. Желчные камни и сладж-синдром желчного пузыря в области ампулы фатерова сосочка могут приводить к повышению давления во внутрипанкреатических протоках, что сопровождается накоплением богатой ферментами жидкости в межуточной ткани железы. Поскольку липаза — один из немногих ферментов, секретирующихся в активной форме, это может приводить к появлению очагов жирового некроза. Затем поврежденные ткани, периацинарные миофибробласты и лейкоциты начинают высвобождать провоспалительные цитокины, включая IL-1b, IL-6, TNF, фактор активации тромбоцитов и субстанцию Р, которые запускают очаговый воспалительный процесс и вызывают интерстициальный отек путем повышения проницаемости капилляров. Отек может нарушить локальный кровоток, что станет причиной сосудистой недостаточности и ишемического повреждения ацинарных клеток.
2. Первичное повреждение ацинарных клеток. Этот механизм играет роль в патогенезе острого панкреатита, вызванного некоторыми вирусами (например, вирусом эпидемического паротита), лекарственными средствами и травмой поджелудочной железы, а также в патогенезе панкреатита, возникшего в результате ишемии или шока.
3. Нарушение внутриклеточного транспорта проферментов в ацинарных клетках. В нормальных ацинарных клетках пищеварительные ферменты и лизосомные гидролазы транспортируются разными путями. В эксперименте на животных после повреждения ацинарных клеток панкреатические проферменты попадают во внутриклеточные компартменты, которые содержат лизосомные гидролазы. Там проферменты активируются, разрушают лизосомы и высвобождают активированные ферменты. Роль этого механизма в развитии острого панкреатита у человека пока не ясна.
Алкоголь может вызвать панкреатит посредством нескольких механизмов. Употребление алкоголя приводит к секреции богатого белком панкреатического сока, который способствует отложению плотных белковых пробок и обструкции мелких протоков поджелудочной железы. Кроме того, алкоголь временно повышает экзокринную функцию поджелудочной железы и сократимость сфинктера Одди (мышцы в области ампулы фатерова сосочка), а также оказывает прямое токсическое действие на ацинарные клетки.
в) Клинические признаки. Основным симптомом при остром панкреатите является характерная боль в животе: постоянная, интенсивная, часто иррадиирует в верхние отделы спины, а иногда может сопровождаться болью в левом плече. Выраженность болевого синдрома варьирует от легкого дискомфорта до сильной боли, приводящей к нетрудоспособности. Часто боль сопровождают потеря аппетита, тошнота и рвота. Заподозрить острый панкреатит в качестве основного заболевания можно по повышению уровня амилазы и липазы в плазме крови при исключении других причин боли в брюшной полости.
При остром панкреатите необходима неотложная медицинская помощь. У таких пациентов обычно внезапно развивается картина острого живота. Многие системные проявления тяжелого острого панкреатита являются результатом выброса токсичных ферментов, цитокинов и других медиаторов в системную циркуляцию и молниеносной активации системного воспалительного ответа, проявляющегося в виде лейкоцитоза, гемолиза, ДВС, задержки жидкости, острого респираторного дистресс-синдрома и диффузного жирового некроза. Возможны периферический сосудистый коллапс и шок с развитием острого некроза почечных канальцев.
Лабораторные данные включают резкое повышение уровня амилазы в сыворотке крови в течение первых 24 час с последующим повышением в течение 7296 час уровня липазы. В 10% наблюдений развивается глюкозурия. Гипокальциемия может быть результатом осаждения кальциевых мыл (кальциевых солей высших жирных кислот) в некротизированной жировой ткани. Продолжительная гипокальциемия — неблагоприятный прогностический признак. Помогает поставить диагноз «острый панкреатит» прямая визуализация увеличенной воспаленной поджелудочной железы при рентгенографии.
Ключевым моментом лечения острого панкреатита являются «покой» поджелудочной железы за счет тотального ограничения перорального приема пищи и поддерживающая терапия в виде внутривенного введения жидкостей и обезболивания. Несмотря на то что большинство пациентов с острым панкреатитом полностью выздоравливают, 5% больных с тяжелым острым панкреатитом умирают от шока в течение первой недели заболевания. Наиболее грозные осложнения — острый респираторный дистресс-синдром и острая почечная недостаточность. Другим осложнением является формирование асептического абсцесса и псевдокисты поджелудочной железы. У 40-60% пациентов с острым некротизирующим панкреатитом некротический детрит инфицируется обычно грамотрицательными микроорганизмами желудочно-кишечного тракта, дополнительно осложняя заболевание.
Гистологическая картина острого панкреатита с воспалением вокруг главного протока.
Окраска гематоксилин-эозином (х 80).
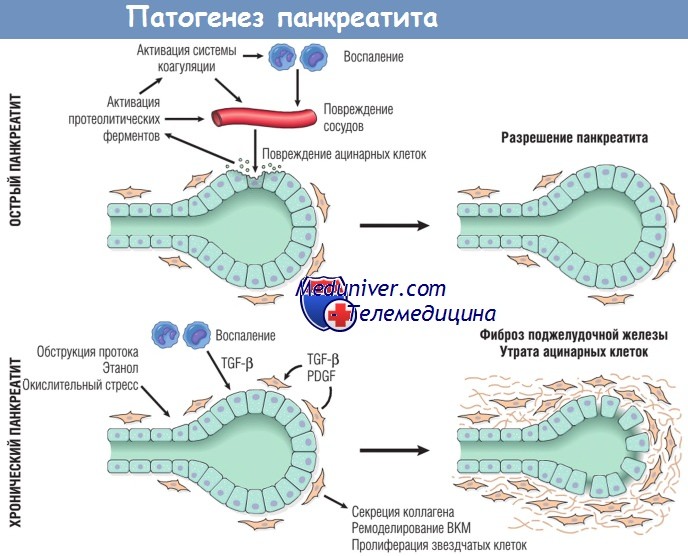
Особенности взаимодействий медиаторов при остром и хроническом панкреатите.
При остром панкреатите повреждение ацинарных клеток приводит к высвобождению протеолитических ферментов,
запускающих каскад реакций, запускающих активацию системы коагуляции, острое и хроническое воспаление, повреждение сосудов и отек.
У большинства пациентов после острого повреждения происходит восстановление ацинарных клеток.
При хроническом панкреатите повторяющиеся эпизоды повреждения ацинарных клеток приводят к выработке фиброгенных цитокинов,
таких как трансформирующий фактор роста р (TGF-p) и тромбоцитарный фактор роста (PDGF), что вызывает пролиферацию звездчатых клеток,
выработку коллагена и ремоделирование внеклеточного матрикса (ВКМ).
В итоге это приводит к необратимой утрате ацинарных клеток, фиброзу и недостаточности поджелудочной железы.
— Рекомендуем ознакомиться со следующей статьей «Механизм развития (патогенез) хронического панкреатита»
Оглавление темы «Патогенез болезней ЖКТ»:
- Механизм развития (патогенез) атрезии желчных протоков
- Механизм развития (патогенез) кисты холедоха
- Механизм развития (патогенез) рака желчного пузыря
- Строение и функции поджелудочной железы
- Механизм развития (патогенез) пороков развития поджелудочной железы
- Механизм развития (патогенез) острого панкреатита
- Механизм развития (патогенез) хронического панкреатита
- Механизм развития (патогенез) кисты поджелудочной железы
- Механизм развития (патогенез) кистозных опухолей поджелудочной железы
- Механизм развития (патогенез) рака поджелудочной железы
Источник
Этот
орган расположен под желудком. У
поджелудочной железы есть эндокринная
функция, но она также является экзокринной
железой (железой внешней секреции, с
выводным протоком). Как эндокринная
железа она производит инсулин и
соматостатин, глюкагон — три гормона,
которые контролируют количество сахара
в крови. Эти гормоны производятся
участками железы, называемым островками
Лангерганса. Поджелудочная железа также
выделяет пищеварительные соки в
двенадцатиперстную кишку (тонкую кишку).
Эти соки, которые смешиваются с желчью,
являются смесью ферментов, которые
переваривают пищу. 
43. Половые железы, внутрисекреторная функция. Физиологическая роль эндокринной части половых желез в организме.
Половые гормоны вырабатываются
половыми железами, которые относятся
к числу смешанных, так как часть их
клеток выполняет внешнесекреторную
функцию, другая часть- внутрисекреторную.
Половые гормоны в течение всей жизни
оказывают мощное влияние на формирование
тела, обмен веществ и половое поведение.
Мужские половые
гормоны(андрогены) вырабатываются
особыми клетками семенников. Они выделены
из экстрактов семенников, а также из
мочи мужчин.
Истинным мужским половым
гормоном является тестостерон и его
производное- андростерон. Они обусловливают
развитие полового аппарата и рост
половых органов, развитие вторичных
половых признаков: огрубление голоса,
изменение телосложения — шире становится
плечи, увеличиваются мышцы, усиливается
рост волос на теле и лице. Совместно с
гормонами гипофиза тестостерон активирует
сперматогенез (созревание сперматозоидов).
Женские половые гормоны-эстрогены
вырабатываются в яичниках. Они оказывают
влияние на развитие половых органов,
выработку яйцеклеток, обусловливают
подготовку яйцеклеток к оплодотворению,
матки- к беременности, молочных желез-
к кормлению ребенка.
Истинным женским половым
гормоном считают эстрадиол. К женским
половым гормонам относится и
прогестерон-гормон беременности(гормон
желтого тела).
Патология половых желез.
При гиперфункции семенников в раннем
возрасте отмечается преждевременное
половое созревание, быстрый рост тела
и развитие вторичных половых признаков.
Поражение семенников или их
удаление(кастрация) в раннем возрасте
вызывает прекращение роста и развития
половых органов; вторичные половые
признаки не развиваются, увеличивается
период роста костей в длину, отсутствует
половое влечение, не растут волосы на
лице, голос сохраняется высоким в течении
жизни.
Гиперфункция яичников
вызывает ранее половое созревание с
выраженными вторичными признаками и
менструацией. Описаны случаи раннего
полового созревания девочек в 4-5 лет.
44. Внутренняя среда организма, компоненты и её значение для жизнедеятельности человека. Кровь. Состав крови. Возрастные особенности строения и функционирования сердечно-сосудистой системы человека.
Внутренней
средой организма
называют совокупность биологических
жидкостей (кровь, лимфа, тканевая
жидкость), омывающих клетки и структуры
тканей и принимающих участие в процессах
обмена веществ. Предложил понятие
«внутренняя среда» в 19 веке Клод
Бернар, подчеркивая тем самым, что в
отличие от изменчивой внешней среды, в
которой существует живой организм,
постоянство жизненных процессов клеток
требует соответствующего постоянства
их окружения, т.е. внутренней среды.
Кровь—
это жидкая ткань, состоящая из плазмы
и взвешенных в ней кровяных клеток.
Кровь заключена в систему сосудов и
находится в состоянии непрерывного
движения.
Возрастные
особенности сердечно — сосудистой
системы.
В
процессе развития ребенка в его
сердечно-сосудистой системе происходят
существенные морфологические и
функциональные изменения. Формирование
сердца у эмбриона начинается со второй
недели эмбриогенеза и четырехкамерное
сердце образуется уже к концу третьей
недели. Кровообращение плода имеет свои
особенности, связанные прежде всего с
тем, что до рождения кислород поступает
в организм через плаценту и так называемую
пупочную вену.
Пупочная
вена разветвляется на два сосуда, один
питает печень, другой соединяется с
нижней полой веной. В результате в нижней
полой вене происходит смешивание крови,
богатой кислородом (из пупочной вены)
и крови, оттекающей от органов и тканей
плода. Таким образом, в правое предсердие
попадает смешанная кровь. Как и после
рождения, систола предсердий сердца
плода направляет кровь в желудочки,
оттуда из левого желудочка она поступает
в аорту, из правого — в легочную артерию.
Однако предсердия плода не обособлены,
а соединяются с помощью овального
отверстия, поэтому левый желудочек
направляет в аорту кровь частично и из
правого предсердия. По легочной артерии
в легкие попадает весьма незначительное
количество крови, так как легкие у плода
не функционируют. Большая же часть
крови, выбрасываемой из правого желудочка
в легочной ствол, по временно
функционирующему сосуду — боталлову
протоку — попадает в аорту.
Важнейшую
роль в кровоснабжении плода выполняют
пупочные артерии, отходящие от подвздошных
артерий. Через пупочное отверстие они
выходят из организма плода и разветвляясь,
образуют в плаценте густую сеть
капилляров, от которой берет начало
пупочная вена. Кровеносная система
плода замкнута. Кровь матери никогда
не попадает в кровеносные сосуды плода
и наоборот. Поступление кислорода в
кровь плода осуществляется путем
диффузии, так как его парциальное
давление в материнских сосудах плаценты
всегда выше, чем в крови плода.
После
рождения пупочные артерии и вена
запустевают и превращаются в связки. С
первым вдохом новорожденного начинает
функционировать малый круг кровообращения.
Поэтому обычно боталлов проток и овальное
отверстие быстро зарастают. У детей
относительная масса сердца и общий
просвет сосудов больше, чем у взрослых,
что в значительной степени облегчает
процессы кровообращения. Рост сердца
находится в тесной связи с общим ростом
тела. Наиболее интенсивно сердце растет
в первые годы жизни и в конце подросткового
периода. С возрастом меняются также
положение и форма сердца. У новорожденного
сердце шаровидной формы и расположено
значительно выше, чем у взрослого.
Различия по этим показателям ликвидируются
только к десяти годам. К 12-летнему
возрасту исчезают и основные функциональные
различия в сердечно-сосудистой системе.
Соседние файлы в предмете Анатомия и физиология
- #
- #
Источник

