Какие ферменты поджелудочной железы активирует трипсин
В
поджелудочной железе синтезируются
проферменты ряда протеаз: трипсиноген,
химотрипсиноген, проэластаза,
прокарбоксипептидазы А и В. В кишечнике
они путём частичного протеолиза
превращаются в активные ферменты
трипсин, химотрипсин, эластазу и
карбок-сипептидазы А и В.
Активация
трипсиногена происходит
под действием фермента эпителия
кишечника энтеропептидазы.
464
Этот
фермент отщепляет с N-конца молекулы
трипсиногена гексапептид Вал-(Асп)4-Лиз.
Изменение конформации оставшейся части
полипептидной цепи приводит к формированию
активного центра, и образуется активный
трипсин. Последовательность Вал-(Асп)4-Лиз
присуща большинству известных
трипсиноге-нов разных организмов — от
рыб до человека.
Образовавшийся
трипсин активирует
химотрипсиноген, из
которого получается несколько активных
ферментов (рис. 9-3). Химотрипсиноген
состоит из одной полипептидной цепи,
содержащей 245 аминокислотных остатков
и пяти дисульфидных мостиков. Под
действием трипсина расщепляется
пептидная связь между 15-й и 16-й
аминокислотами, в результате чего
образуется активный π-химотрипсин.
Затем под действием π-химотрипсина
отщепляется дипептид сер(14)-арг(15), что
приводит к образованию δ-химотрипсина.
Отщепление дипептида тре(147)-арг(148)
завершает образование стабильной формы
активного фермента — α-химотрипсина,
который состоит из трёх полипептидных
цепей, соединённых дисульфидными
мостиками.
Остальные
проферменты панкреатических протеаз
(проэластаза и прокарбоксипептидазы
А и В) также активируются трипсином
путём частичного протеолиза. В результате
образуются активные ферменты — эластаза
и карбокси-пептидазы А и В.
2. Специфичность действия протеаз
Трипсин
преимущественно гидролизует пептидные
связи, образованные карбоксильными
группами аргинина и лизина. Химотрипсины
наиболее активны в отношении пептидных
связей, образованных карбоксильными
группами ароматических аминокислот
(Фен, Тир, Три).
Карбоксипептидазы
А и В — цинксодержащие ферменты, отщепляют
С-концевые остатки аминокислот. Причём
карбоксипептидаза А
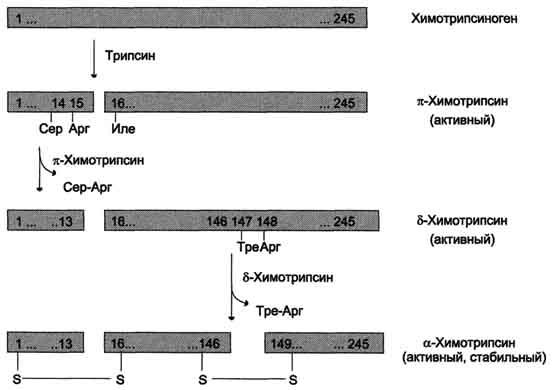
Рис.
9-3. Активация химотрипсиногена. Молекула
химотрипсиногена состоит из 245
аминокислотных остатков и имеет пять
дисульфидных мостиков. На схеме показаны
участки фермента, подвергающиеся
протеолизу. а-Химотрипсин — активная
стабильная форма фермента — состоит из
трёх полипептидных цепей, ковалентно
связанных между собой двумя дисульфидными
мостиками и нековалентно — за счёт
водородных связей и гидрофобных
взаимодействий.
465
отщепляет
преимущественно аминокислоты, содержащие
ароматические или гидрофобные радикалы,
а карбоксипептидаза В — остатки аргинина
и лизина.
Последний
этап переваривания — гидролиз небольших
пептидов, происходит под действием
ферментов аминопептидаз и дипептидаз,
которые синтезируются клетками тонкого
кишечника в активной форме.
Аминопептидазы последовательно
отщепляют N-концевые аминокислоты
пептидной цепи. Наиболее известна
лейцинаминопептидаза — Zn2+-
или Мn2+-содержащий
фермент, несмотря на название, обладающий
широкой специфичностью по отношению
к N-концевым аминокислотам.Дипептидазы расщепляют
дипептиды на аминокислоты, но не
действуют на трипептиды.
В
результате последовательного действия
всех пищеварительных протеаз большинство
пищевых белков расщепляется до свободных
аминокислот.
В.
Защита клеток от действия протеаз
Клетки
поджелудочной железы защищены от
действия пищеварительных ферментов
тем, что:
эти
ферменты образуются
в виде неактивных предшественников в
клетках поджелудочной железы и
активируются только после секреции в
просвет кишечника. Таким образом, место
синтеза и место действия этих ферментов
пространственно разделены.в
клетках поджелудочной железы
присутствует белок-ингибитор
трипсина, образующий
с активной формой фермента (в случае
преждевременной активации) прочный
комплекс.
В
полости желудка и кишечника протеазы
не контактируют с белками клеток,
поскольку слизистая оболочка покрыта
слоем слизи, а каждая клетка содержит
на наружной поверхности плазматической
мембраны полисахариды, которые не
расщепляются протеазами и тем самым
защищают клетку от их действия.
Разрушение
клеточных белков протеазами происходит
при язвенной болезни желудка или
двенадцатиперстной кишки. Однако
начальные механизмы возникновения
язвы ещё мало изучены.
Г.
Транспорт аминокислот в клетки
Аминокислоты,
образовавшиеся при переваривании
белков, быстро всасываются в кишечнике.
Транспорт их осуществляется двумя
путями: через воротную систему печени,
ведущую прямо в печень, и по лимфатическим
сосудам, сообщающимся с кровью через
грудной лимфатический проток. Максимальная
концентрация аминокислот в крови
достигается через 30-50 мин после приёма
белковой пищи (углеводы и жиры замедляют
всасывание аминокислот). Всасывание
L-аминокислот (но не D-изомеров) — активный
процесс, требующий затраты энергии.
Аминокислоты переносятся через кишечную
стенку от слизистой её поверхности в
кровь (рис. 9-4). Перенос через щёточную
кайму осуществляется целым рядом
переносчиков, многие из которых действуют
при участии Nа+-зависимых
механизмов симпорта, подобно переносу
глюкозы (см. раздел 7).
Различная
скорость проникновения аминокислот
через мембраны клеток указывает на
наличие транспортных систем, обеспечивающих
перенос аминокислот как через внешнюю
плазматическую мембрану, так и через
внутриклеточные мембраны. В настоящее
время известно по крайней мере пять
специфических транспортных систем,
каждая из которых функционирует
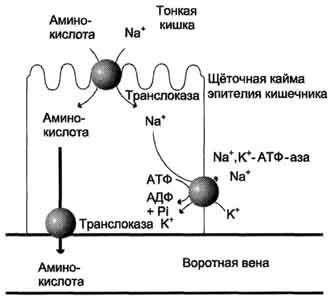
Рис.
9-4. Механизм всасывания аминокислот в
кишечнике. L-аминокислота
поступает в энтероцит путём симпорта
с ионом Na+.
Далее специфическая транслоказа
переносит аминокислоту через мембрану
в кровь. Обмен ионов натрия между
клетками осуществляется путём
первично-активного транспорта с помощью
Nа+,К+-АТФ-азы.
466
для
переноса определённой группы близких
по строению аминокислот:
нейтральных,
с короткой боковой цепью (аланин, серии,
треонин);нейтральных,
с длинной или разветвлённой боковой
цепью (валин, лейцин, изолейцин);с
катионными радикалами (лизин, аргинин);с
анионными радикалами (глутаминовая и
аспарагиновая кислоты);иминокислот
(пролин, оксипролин).
Причём
к числу Nа+-зависимых
относятся переносчики аминокислот,
входящих в первую и пятую группы, а
также переносчик метионина. Независимые
от Na+ переносчики
специфичны для некоторых нейтральных
аминокислот (фенилаланин, лейцин) и
аминокислот с катионными радикалами
(лизин).
Аминокислоты
конкурируют друг с другом за специфические
участки связывания. Например, всасывание
лейцина (если концентрация его достаточно
высока) уменьшает всасывание изолейцина
и валина.
Одна
из специфических транспортных систем
для некоторых нейтральных аминокислот
функционирует в кишечнике, почках и,
по-видимому, мозге. Она получила название
γ-глутамильного цикла (рис. 9-5).
В
этой системе участвуют 6 ферментов,
один из которых находится в клеточной
мембране, а остальные — в цитозоле.
Ключевую роль в транспорте аминокислоты
играет мембранно-связан-ный фермент
γ-глутамилтрансфераза. Этот
фермент является гликопротеином и
катализирует перенос γ-глутамильной
группы от глутатиона (иногда другого
γ-глутамильного пептида) на транспортируемую
аминокислоту и последующий перенос
комплекса в клетку. Глутатион представляет
собой трипептид — γ-глутамилцистеинилглицин,
который находится во всех тканях
животных. Реакция протекает следующим
образом (см. схему А на с. 468).
Аминокислота,
связанная с γ-глутамильным остатком,
оказывается внутри клетки. В следующей
реакции происходит отщепление
γ-глутамильного
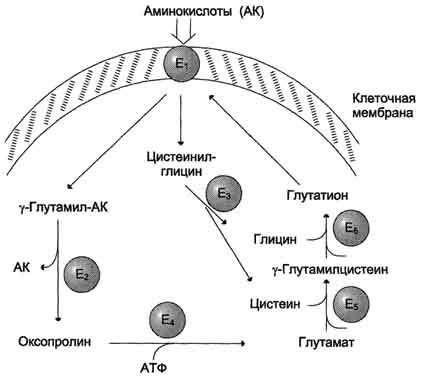
Рис.
9-5. γ-Глутамильный
цикл. Система
состоит из одного мембранного и пяти
цитоплазматических ферментов. Перенос
аминокислоты внутрь клетки осуществляется
в комплексе с глутамильным остатком
глутатиона под действием
γ-глутамилтрансферазы. Затем аминокислота
освобождается, а γ-глутамильный остаток
в несколько стадий превращается в
глутатион, который способен присоединять
следующую молекулу аминокислоты. Е1 —
γ-глутамилтрансфераза; Е2 —
у-глутамилциклотрансфераза; Е3 —
пептидаза; Е4 —
оксопролиназа; Е5 —
γ-глутамилцистеинсинтетаза; Е6 —
глутатионсинтетаза.
467
остатка
под действием фермента
γ-глутамилциклотрансферазы (см. схему
Б).
Дипептид
цистеинилглицин расщепляется под
действием пептидазы на 2 аминокислоты
— цис-теин и глицин. В результате этих
3 реакций происходит перенос одной
молекулы аминокислоты в клетку (или
внутриклеточную структуру). Следующие
3 реакции обеспечивают регенерацию
глутатиона, благодаря чему цикл
повторяется многократно. Для транспорта
в клетку одной молекулы аминокислоты
с участием γ-глутамильного цикла
затрачиваются 3 молекулы АТФ.
Д.
Нарушение переваривания белков и
транспорта аминокислот
Небольшую
долю продуктов переваривания белка
составляют негидролизованные короткие
пептиды. У некоторых людей возникает
иммунная реакция на приём белка, что,
очевидно, связано со способностью к
всасыванию
таких
пептидов. Продукты полностью переваренного
белка (аминокислоты) лишены антигенных
свойств и иммунных реакций не вызывают.
У
новорождённых проницаемость слизистой
оболочки кишечника выше, чем у взрослых,
поэтому в кровь могут поступать антитела
молозива (секрет молочных желёз,
выделяющийся в первые дни после родов,
обогащённый антителами и антитоксинами).
Это усугубляется наличием в молозиве
белка — ингибитора трипсина. Протеолитические
ферменты в пищеварительных секретах
новорождённых обладают низкой
активностью. Всё это способствует
всасыванию в кишечнике небольшого
количества нативных белков, достаточного
для обеспечения иммунной реакции.
Очевидно, подобное усиление всасывающей
способности кишечника является причиной
наблюдаемой иногда непереносимости
белков пищи (например, молока и яиц) у
взрослых людей.
Гниение
Известно,
что микроорганизмы кишечника
для своего роста также нуждаются в
доставке с пищей определенных аминокислот.
Микрофлора кишечника располагает
набором ферментных систем, отличных
от соответствующихферментов животных тканей и
катализирующих самые разнообразные
превращения пищевых аминокислот.
В кишечнике создаются оптимальные
условия для образования ядовитых
продуктов
распада аминокислот: фенола,индола, крезола, скатола, сероводорода,
метилмер-каптана, а также нетоксичных
для организма соединений: спиртов, аминов, жирных
кислот,кетокислот, оксикислот и
др.
Все
эти превращения аминокислот,
вызванные деятельностью микроорганизмовкишечника,
получили общее название «гниение белков в
кишечнике». Так, в процессе
распада серосодержащих
аминокислот (цистин, цистеин, метионин)
в кишечнике образуются сероводород H2S
и метил-меркаптан CH3SH.
Диаминокислоты – орнитин и лизин –
подвергаются процессудекарбоксилирования с
образованием аминов –
путресцина и кадаверина.
Из
ароматических аминокислот: фенилаланин, тирозин и триптофан –
при аналогичном
бактериальном декарбоксилировании образуются
соответствующие амины: фенилэтиламин,
параоксифенилэтиламин (или тира-мин)
и индолилэтиламин (триптамин).
Кроме того, микробные ферментыкишечника
вызывают постепенное разрушение боковых
цепей циклическихаминокислот,
в частности тирозина и триптофана,
с образованием ядовитых продуктов
обмена – соответственно крезола и фенола, скатола и индола.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
Покинув желудок, пища подвергается действию панкреатического сока, кишечного сока и желчи.
Сок поджелудочной железы содержит проферменты – трипсиноген, химотрипсиноген, прокарбоксипептидазы, проэластазу. Проферменты в просвете кишечника активируются, соответственно, до трипсина, химотрипсина, карбоксипептидаз и эластазы способом ограниченного протеолиза. Указанные ферменты осуществляют основную работу по перевариванию белков.
В кишечном соке активны дипептидазы и аминопептидазы. Они заканчивают переваривание белков.
Трипсин, химотрипсин, эластаза являются эндопептидазами. Карбоксипептидазы и аминопептидазы – экзопептидазы.
Регуляция кишечного пищеварения
В кишечнике под влиянием соляной кислоты, поступающей из желудка в составе пищевого комка, начинается секреция гормона секретина, который с током крови достигает поджелудочной железы и стимулирует выделение жидкой части панкреатического сока, богатого карбонат-ионами (HCO3–). В результате рН химуса в тонкой кишке повышается до 7,2-7,5 или, при усиленной секреции, до 8,5.
Благодаря работе желудочных ферментов в химусе имеется некоторое количество аминокислот, вызывающих освобождение холецистокинина-панкреозимина. Он стимулирует секрецию другой, богатой проферментами, части поджелудочного сока, и секрецию желчи.
Нейтрализация кислого химуса в двенадцатиперстной кишке происходит также при участии желчи. Формирование желчи (холерез) идет непрерывно, не прекращаясь даже при голодании.
Трипсин
Синтезируемый в поджелудочной железе трипсиноген в двенадцатиперстной кишке подвергается частичному протеолизу под действием фермента энтеропептидазы, секретируемой клетками кишечного эпителия. От профермента отделяется гексапептид (Вал-Асп-Асп-Асп-Асп-Лиз), что приводит к формированию активного центра трипсина.
Трипсин специфичен к пептидным связям, образованным с участием карбоксильных групп лизина и аргинина, может осуществлять аутокатализ, т.е. превращение последующих молекул трипсиногена в трипсин, также он активирует остальные протеолитические ферменты панкреатического сока – химотрипсиноген, проэластазу, прокарбоксипептидазу.
Параллельно трипсин участвует в переваривании пищевых липидов, активируя фермент переваривания фосфолипидов – фосфолипазу А2, и колипазу фермента липазы, отвечающей за гидролиз триацилглицеролов.
В таких продуктах, как бобовые (соя, горох, фасоль) содержится пептид – ингибитор трипсина, снижающий переваривание белков этих продуктов в сыром, термически необработанном, виде.
Химотрипсин
Образуется из химотрипсиногена при участии трипсина, который расщепляет пептидную связь между аргинином-15 и изолейцином-16, и уже активны промежуточных форм химотрипсина, которые выстригают два дипептида из цепи профермента. Три образованных фрагмента удерживаются друг с другом посредством дисульфидных связей.
Фермент специфичен к пептидным связям, образованным с участием карбоксильных групп фенилаланина, тирозина и триптофана.
Эластаза
Активируется в просвете кишечника трипсином из проэластазы. Гидролизует связи, образованные карбоксильными группами малых аминокислот аланина, пролина, глицина.
Карбоксипептидазы
Карбоксипептидазы являются экзопептидазами, т.е. гидролизуют пептидные связи с С-конца пептидной цепи. Различают два типа карбоксипептидаз – карбоксипептидазы А и карбоксипептидазы В. Карбоксипептидазы А отщепляют с С-конца остатки алифатических и ароматических аминокислот, карбоксипептидазы В – остатки лизина и аргинина.
Аминопептидазы
Являясь экзопептидазами, аминопептидазы отщепляют N-концевые аминокислоты. Важными представителями являются аланинаминопептидаза и лейцинаминопептидаза, обладающие широкой специфичностью. Например, лейцинаминопептидаза отщепляет с N-конца белка не только лейцин, но и ароматические аминокислоты и гистидин.
Дипептидазы
Дипептидазы гидролизуют дипептиды, в изобилии образующиеся в кишечнике при работе других ферментов.
Лизосомы энтероцитов
Малое количество дипептидов и пептидов пиноцитозом попадают в энтероциты и здесь гидролизуются лизосомальными протеазами.
При заболеваниях ЖКТ и нарушении переваривания, при недостаточности соляной кислоты, при желудочном или кишечном кровотечении, при высокобелковой диете часть пептидов, не успевая расщепиться, достигает толстого кишечника и потребляется живущими там микроорганизмами – развивается гниение белков в кишечнике.
В действительности же дела с перевариванием белков в ЖКТ обстоят не совсем так: постепенно в фармакологии накапливаются факты об эффективности пептидных лекарственных препаратов при их пероральном применении. Однако делать определенные выводы никто не спешит.
Источник
Представленная в разделе информация о лекарственных препаратах, методах диагностики и лечения предназначена для медицинских работников и не является инструкцией по применению.
 Трипсин (англ. trypsin) — протеолитический фермент, гидролизующий пептиды и белки, эндопептидаза, а также лекарство.
Трипсин (англ. trypsin) — протеолитический фермент, гидролизующий пептиды и белки, эндопептидаза, а также лекарство.
Трипсин — пищеварительный фермент
Трипсин является важнейшим для кишечного пищеварения ферментом, расщепляющий белки, поступающей в двенадцатиперстную кишку пищи.
Трипсин синтезируется в поджелудочной железе в виде профермента трипсиногена и, в таком виде, в составе панкреатического сока, попадает в двенадцатиперстную кишку, где, в щелочной среде, под воздействием протеолитического фермента энтерокиназы от молекулы трипсиногена удаляется гексапептид и формируется биологически активная структура трипсина.
После активации трипсина энтерокиназой начинается процесс автокатализа и трипсин далее выступает в качестве фермента, активирующего трипсиноген, химотрипсиноген, прокарбоксипептидазу, профосфолипазу и другие проферменты поджелудочной железы.
Трипсин активен при рН от 5,0 до 8,0 с оптимумом активности при рН = 7,0.
Трипсин (КФ 3.4.21.4), химотрипсин и эластаза представляют группу сериновых протеаз благодаря присутствию в их активном центре серина. Они относятся к одному семейству и составляют 44% от общего количества белка экзокринной части поджелудочной железы. По современным представлениям, трипсин и химотрипсин (аналогично ситуации с пепсином и гастриксином в желудке) существуют в виде множества изоформ.
Схема активации трипсина и других проферментов поджелудочной железы (Калинин А.В.)
Количество трипсина в крови и дуоденальном содержимом
Количество трипсина в крови или в дуоденальном содержимом является, наряду с количественными характеристиками других ферментов, важнейшим показателем внешнесекреторной деятельности поджелудочной железы.
При исследовании внешней секреции методом дуоденального зондирования измеряют активность трипсина до и после введения стимулятора. Активность трипсина в дуоденальном содержимом у здоровых при базальной секреции, измеренной по методу Гросса равен 355 ± 20 ед./мл. После введения таких стимуляторов, как 0,5 % раствор соляной кислоты или секретин у большинства здоровых пациентов в норме в первые 15–30 минут наблюдается снижение активности трипсина, а через час — восстановление исходных значений. При стимулировании холецистокинином активность трипсина через 15–30 минут резко возрастает, а через час возвращается к исходным значениям (см. также Саблин О.А. и др. Панкреозимин-секретиновый тест).
В крови здоровых пациентов среднее содержание трипсина — 169 ±17,6 нг/мл. Пределы колебаний (у детей) от 98,2 до 229,6 нг/мл.
Трипсин — лекарство
 Трипсин — международное непатентованное наименование (МНН) лекарственного средства, а также торговое наименование лекарства. Трипсин по АТХ включён в следующие группы и имеет коды:
Трипсин — международное непатентованное наименование (МНН) лекарственного средства, а также торговое наименование лекарства. Трипсин по АТХ включён в следующие группы и имеет коды:
- «B06 Прочие гематологические препараты», код «B06AA07 Трипсин»
- «D03 Препараты для лечения ран и язв», код «D03BA01 Трипсин»
- «M09 Прочие препараты для лечения заболеваний костно-мышечной системы», «M09AB52 Трипсин в комбинации с другими препаратами».
Трипсин, как единственное действующее вещество, входит в лекарства: Дальцекс-Трипсин, Трипсин кристаллический, Трипсин (раствор).
Показания к применению трипсина кристаллического
- заболевания дыхательных путей: трахеит, бронхит, бронхоэктатическая болезнь, пневмония, послеоперационный ателектаз легких, эмпиема плевры, экссудативный плеврит и другие
- тромбофлебит
- пародонтоз (воспалительно-дистрофические формы)

- остеомиелит
- гайморит
- отит
- ирит, иридоциклит
- кровоизлияние в переднюю камеру глаза
- отек периорбитальной области после операций и травм
- ожоги
- пролежни
- гнойные раны (местно).
Трипсин — компонент комбинированных лекарств
Трипсин также применяется в составе комбинированных ферментных, иммуномодулирующих и других лекарств. В частности, трипсин входит в Вобэнзим, Флогэнзим, Химопсин.
У трипсина имеются противопоказания, побочные действия и особенности применения, необходима консультация со специалистом.
Назад в раздел
Источник



