Кистозная трансформация поджелудочной железы
1. Feletti A., Anglani M., Scarpa B., Schiavi F., Boaretto F., Zovato S., Taschin E., Gardi M., Zanoletti E., Piermarocchi S., Murgia A., Pavesi G., Opocher G. Von Hippel-Lindau disease: an evaluation of natural history and functional disability. NeuroOncol. 2016; 18 (7): 1011-1020. DOI: 10.1093/neuonc/nov313.
2. Chen F., Slife L., Kishida T., Mulvihill J., Tisherman S.E., Zbar B. Genotype-phenotype correlation in von Hippel-Lindau disease identification of a mutation associated with VHL type A. J. Med. Genet. 1996; 33 (8): 716-717.
3. Frantzen C., Klasson T.D., Links T.P., Giles R.H. Von Hippel-Lindau Syndrome. In: Pagon R.A., Adam M.P., Ardinger H.H., Wallace S.E., Amemiya A., Bean L.J.H., Bird T.D., Fong C.T., Mefford H.C., Smith R.J.H., Stephens K., еds. Gene Reviews, 2000. Seattle (WA): University of Washington, Seattle; 1993-2016. ISSN: 2372-0697.
4. Ершова Е.В., Юкина М.Ю., Трошина Е.А., Бельцевич Д.Г., Мустафаева Э.З. Синдром фон Хиппеля-Линдау. Ожирение и метаболизм. 2011; 2: 65-68.
5. Алексеев Б.Я., Калпинский А.С., Исаев А.Р., Москвина Л.В., Нюшко К.М., Воробьев Н.В., Каприн А.Д. Органосохраняющее лечение больных с VHL-синдромом. Онкология. Журнал им. П.А. Герцена. 2014; 5: 57-60.
6. Latif F., Tory K., Gnarra J., Yao M., Duh F.M., Orcutt M.L., Stackhouse T., Kuzmin I., Modi W., Geil L. Identification of the von Hippel-Lindau disease tumor suppressor gene. Science. 1993; 260 (5112): 1317-1320.
7. Kaelin W.G. Jr. Molecular basis of the VHL hereditary cancer syndrome. Nat. Rev. Cancer. 2002; 2 (9): 673-682.
8. Pugh C.W., Ratcliffe P.J. The von Hippel-Lindau tumor suppressor, hypoxia-inducible factor-1 (HIF-1) degradation, and cancer pathogenesis. Semin. Cancer Biol. 2003; 13 (1): 83-89.
9. Vaganovs P., Bokums K., Miklaševics E., Plonis J., Zarina L., Geldners I., Gardovskis J., Vjaters E. Von Hippel-Lindau syndrome: diagnosis and management of hemangioblastoma and pheochromocytoma. Case Rep. Urol. 2013; 2013: 624096. DOI: 10.1155/2013/624096.
10. Friedrich C.A. Genotype-phenotype correlation in von Hippel-Lindau syndrome. Hum. Mol. Genet. 2001; 10 (7): 763-767.
11. Lonser R.R., Glenn G.M., Walther M., Chew E.Y., Libutti S.K., Linehan W.M., Oldfield E.H. Von Hippel-Lindau disease. Lancet. 2003; 361 (9374): 2059-2067.
12. MD Anderson Cancer Center URL: https://www.mdanderson.org/cancer-types/von-hippel-lindau-disease.html
13. Binderup M.L., Bisgaard M.L., Harbud V., Møller H.U., Gimsing S., Friis-Hansen L., Hansen Tv., Bagi P., Knigge U., Kosteljanetz M., Bøgeskov L., Thomsen C., Gerdes A.M., Ousager L.B., Sunde L.; Danish vHL Coordination Group. Von Hippel-Lindau disease (vHL). National clinical guidelinefor diagnosis and surveillance in Denmark. 3rd edition. Dan. Med. J. 2013; 60 (12): B4763.
14. VHL Alliance URL: https://vhl.org/
15. Pavesi G., Feletti A., Berlucchi S., Opocher G., Martella M., Murgia A., Scienza R. Neurosurgical treatment of von Hippel-Lindau-associated hemangioblastomas: benefits, risks and outcome. J. Neurosurg. Sci. 2008; 52 (2): 29-36.
16. Capitanio J.F., Mazza E., Motta M., Mortini P., Reni M. Mechanisms, indications and results of salvage systemic therapy for sporadic and von Hippel-Lindau related hemangioblastomas of the central nervous system. Crit. Rev. Oncol. Hematol. 2013; 86 (1): 69-84. DOI: 10.1016/j.critrevonc.2012.10.001.
17. Schmid S., Gillessen S., Binet I., Brändle M., Engeler D., Greiner J., Hader C., Heinimann K., Kloos P., Krek W., Krull I., Stoeckli S.J., Sulz M.C., van Leyen K., Weber J., Rothermundt C., Hundsberger T. Management of von Hippel-Lindau disease: an interdisciplinary review. Oncol. Res. Treat. 2014; 37 (12): 761-771. DOI: 10.1159/000369362.
18. Jonasch E., McCutcheon I.E., Waguespack S.G., Wen S., Davis D.W., Smith L.A., Tannir N.M., Gombos D.S., Fuller G.N., Matin S.F. Pilot trial of sunitinib therapy in patients with von Hippel-Lindau disease. Ann. Oncol. 2011; 22 (12): 2661-2666. DOI: 10.1093/annonc/mdr011.
19. Sternberg C.N., Davis I.D., Mardiak J., Szczylik C., Lee E., Wagstaff J., Barrios C.H., Salman P., Gladkov O.A., Kavina A., Zarbá J.J., Chen M., McCann L., Pandite L., Roychowdhury D.F., Hawkins R.E. Pazopanib in locally advanced or metastatic renal cell carcinoma: results of a randomized phase III trial. J. Clin. Oncol. 2010; 28 (6): 1061-1068. DOI: 10.1200/JCO.2009.23.9764.
20. Motzer R.J., Hutson T.E., Cella D., Reeves J., Hawkins R., Guo J., Nathan P., Staehler M., deSouza P., Merchan J.R., Boleti E., Fife K., Jin J., Jones R., Uemura H., De Giorgi U., Harmenberg U., Wang J., Sternberg C.N., Deen K., McCann L., Hackshaw M.D., Crescenzo R., Pandite L.N., Choueiri T.K. Pazopanib versus sunitinib in metastatic renal-cell carcinoma. N. Engl. J. Med. 2013; 369 (8): 722-731. DOI: 10.1056/NEJMoa1303989.
21. Jimenez C., Cabanillas M.E., Santarpia L., Jonasch E., Kyle K.L., Lano E.A., Matin S.F., Nunez R.F., Perrier N.D., Phan A., Rich T.A., Shah B., Williams M.D., Waguespack S.G. Use of the tyrosine kinase inhibitor sunitinib in a patient with von Hippel-Lindau disease: targeting angiogenic factors in pheochromocytoma and other von Hippel-Lindau disease related tumors. J. Clin. Endocrinol. Metab. 2009; 94 (2): 386-391. DOI: 10.1210/jc.2008-1972.
22. Kim B.Y., Jonasch E., McCutcheon I.E. Pazopanib therapy for cerebellar hemangioblastomas in von Hippel-Lindau disease: case report. Target Oncol. 2012; 7 (2): 145-149. DOI: 10.1007/s11523-012-0214-0.
23. Omar A.I. Bevacizumab for the treatment of surgically unresectable cervical cord hemangioblastoma: a case report. J. Med. Case Rep. 2012; 6: 238. DOI: 10.1186/1752-1947-6-238.
24. von Buelow M., Pape S., Hoerauf H. Systemic bevacizumab treatment of a juxtapapillary retinal haemangioma. Acta Ophthalmol. Scand. 2007; 85 (1): 114-116.
25. Hudes G., Carducci M., Tomczak P., Dutcher J., Figlin R., Kapoor A., Staroslawska E., Sosman J., McDermott D., Bodrogi I., Kovacevic Z., Lesovoy V., Schmidt-Wolf I.G., Barbarash O., Gokmen E., O»Toole T., Lustgarten S., Moore L., Motzer R.J. Temsirolimus, interferon alfa, or both for advanced renal-cell carcinoma. N. Engl. J. Med. 2007; 356 (22): 2271-2281.
Источник
Цистаденомы
Наиболее частое доброкачественное новообразование, которое развивается из протокового эпителия поджелудочной железы. Встречается в 10-15% всех кистозных поражений поджелудочной железы и в 1,5-4% опухолевого её поражения. Чаще локализуются в хвосте или теле железы. Страдают преимущественно женщины.
Согласно современной международной гистологической классификации ВОЗ (Дж. Клоппель и др., 1996) выделяют 3 варианта доброкачественных кистозных опухолей поджелудочной железы: серозную, муцинозную цистаденому и внутрипротоковую папиллярно-муцинозную опухоль.
Серозная цистаденома
Этот вид цистаденомы поджелудочной железы в большинстве случаев представляет собой полостное образование, внутри которого содержится прозрачная водянистая жидкость. Этиология серозной цистаденомы неясна, хотя полагают, что она может развиваться из эпителиальных клеток ацинусов поджелудочной железы вследствие альтерации в хромосоме Зр25.
Характерной особенностью макроскопического строения кистозных опухолей поджелудочной железы считают наличие в их полости дополнительных тканевых структур — перегородок или солидных масс (рис. 58-11).

Рис. 58-11. Серозная цистаденома хвоста поджелудочной железы: а — препарат на разрезе; б — магнитно-резонансная томограмма.
При гистологическом исследовании стенки серозной цистаденомы обнаруживают внутреннюю эпителиальную выстилку, состоящую из однослойных кубических клеток, а при гистохимическом окрашивании внутри этих эпителиальных клеток обнаруживают гранулы с гликогеном.
При серозной цистаденоме перегородки делят кистозную опухоль на множество более мелких кист, делая ее похожей на пчелиные соты. Этот вариант строения цистаденомы называется микрокистозным и он считается характерным только для серозной кистозной опухоли поджелудочной железы. Однако встречается и другой вариант макроскопического строения серозной кистозной опухоли, когда она имеет вид однополостной кисты, а внутренние перегородки в ней полностью отсутствуют. Такой вариант серозной цистаденомы называется макрокистозным, или олигоцистным. Её трудно отличить от псевдокисты.
Заболевание очень медленно прогрессирует, и многолетние наблюдения могут не выявлять увеличения размеров серозной цистаденомы. Случаи её злокачественной трансформации в серозную цистаденокарциному казуистичны.
Размеры такой кистозной опухоли обычно не превышают 5-7 см. Часто заболевание обнаруживают при профилактическом обследовании. Клинические симптомы редко выражены, неспецифичны, чаще всего это хроническая боль в эпигастральной области. В диагностике основное значение принадлежит УЗИ, КТ и МРТ, а также эндосонографии. Для дифференциальной диагностики с псевдокистами можно использовать чрескожную тонкоигольную пункцию с аспирацией и исследованием содержимого на активность амилазы и особенно клеточный состав.
Совокупность перечисленных особенностей этой разновидности кистозной опухоли позволяет избежать оперативного вмешательства и рекомендовать больным ежегодное инструментальное обследование. Операция показана при нарастании симптомов и увеличении размеров кисты свыше 5-6 см. Среди методов оперативного лечения предпочтительна энуклеация, и лишь при локализации кисты в хвосте допустима экономная резекция этого отдела поджелудочной железы. Недопустима операция наружного или внутреннего дренирования. Следует особо подчеркнуть важность экстренного гистологического исследования стенки кисты, без которого всегда есть риск выбора неадекватного метода или объёма операции, особенно в условиях широкого использования миниинвазивных методов.
Муцинозная цистаденома
Муцинозная цистаденома отличается полиморфизмом строения. В большинстве случаев она представляет собой крупную многокамерную кисту (рис. 58-12), заполненную вязкой слизью или геморрагическим содержимым с толстой стенкой.

Рис. 58-12. Муцинозная цистаденома поджелудочной железы: а — препарат на разрезе; б — компьютерная томограмма с контрастным усилением.
Нередко она имеет строение однополостной кисты без внутренних перегородок (макрокистозная олигоцистная форма). Согласно одной из наиболее распространённых гипотез, считают, что муцинозная кистозная опухоль развивается из ткани яичника, элементы которой попадают в закладку поджелудочной железы в периоде раннего внутриутробного развития. Стромальная ткань стенки и перегородок муцинозной цистаденомы имеет большое сходство со стромальной тканью яичника, в связи с чем получила название овариоподобной стромы. Это считают одной из отличительных особенностей строения муцинозной кистозной опухоли. Гистологическое строение стенки муцинозной кистозной опухоли характеризуется эпителиальной выстилкой, состоящей из призматического эпителия, содержащего муцин. Гистохимическая окраска на гликоген в этом случае даёт отрицательный результат.
Муцинозная цистаденома сравнительно быстро прогрессирует и ко времени обнаружения обычно имеет размеры до 10-15 см в диаметре. Поэтому для неё может быть характерен неотчётливый, но постоянный болевой синдром, чувство дискомфорта в эпигастрии. Описаны единичные наблюдения сдавления или обтурации этой опухолью общего жёлчного протока, двенадцатиперстной кишки и главного протока поджелудочной железы. Важнейшая особенность такой кистозной опухоли — очень высокий потенциал злокачественной трансформации.
Во многих исследованиях показано, что практически в любой муцинозной кистозной опухоли с течением времени появляются участки тяжёлой дисплазии эпителия, переходящие в карциному in situ, а далее — в цистаденокарциному поджелудочной железы.
По данным УЗИ и КТ приблизительно в 20-30% случаев выявляют кальцификацию её наружной стенки. В некоторых случаях, при КТ-исследовании с внутривенным болюсным усилением, можно выявить накопление контрастного вещества в перегородках и стенке кистозной опухоли (см. рис. 58-12). Коллатеральный кровоток внутри кистознои опухоли можно обнаружить и при УЗИ в режиме дуплексного сканирования, что обусловлено наличием сосудов во внутриполостных структурах и стенке кистозной опухоли.
Определённое значение для диагностики кистозной опухоли имеет состояние остальной паренхимы поджелудочной железы. Важно принимать во внимание, что при таких опухолях она не подвержена структурным изменениям. В то же время при псевдокисте поджелудочной железы в её паренхиме часто обнаруживают склероз, атрофию, включение кальцинатов, расширение главного протока поджелудочной железы. Муцинозная цистаденома сходна с цистаденокарциномой поджелудочной железы. Но по данным КТ или УЗИ только при цистаденокарциноме можно обнаружить признаки прорастания опухоли в окружающие ткани, увеличение регионарных лимфатических узлов или отдалённые метастазы в других органах. Для их различения важно определить онкомаркёры (СЕА и СА-19-9).
Большие возможности для диагностики кистозных опухолей поджелудочной железы открывает МРТ. Она позволяет не только получать и обрабатывать изображение органов, но и одновременно оценивать некоторые физические свойства биологических жидкостей при исследовании Т1- и Т2-взвешенных изображений. Эти данные могут быть использованы при проведении дифференциальной диагностики серозной от муцинозной кистозной опухоли. При серозной цистаденоме внутриполостная жидкость характеризуется низкой интенсивностью сигнала в T1- и высокой — в Т2-взвешенном изображении. Сигнал от внутреннего содержимого муцинозной кистозной опухоли более интенсивный в T1-взвешенном изображении.
Для псевдокисты поджелудочной железы, как и при серозной цистаденоме, характерна низкая интенсивность сигнала в Т1-взвешенном изображении и высокая — в Т2-взвешенном изображении. Однако присутствие внутри псевдокисты сгустков крови или секвестров может изменить характеристики получаемого сигнала.
Магнитно-резонансная панкреатикохолангиография позволяет установить взаимоотношение между кистой и главным протоком поджелудочной железы. При серозной и муцинозной кистозных опухолях такая связь отсутствует. А при внутрипротоковой папиллярно-муцинозной опухоли, наоборот, дилатированный, связанный с полостью кисты главный проток является одним из её основных дифференциально-диагностических признаков.
Однако специфичность УЗИ и КТ при диагностике кистозных опухолей не превышает 50-60%. Основное количество ошибочных заключений возникает при олигоцистном варианте строения кистозной опухоли.
В сомнительных случаях, когда характер кистозного поражения поджелудочной железы остаётся неясным, целесообразно использовать чрескожную ТАБ кисты с последующим биохимическим и цитологическим анализами. Один из перспективных методов диагностики патологических процессов в поджелудочной железе — метод эндоскопического УЗИ, обладающий высокой разрешающей способностью.
В лечении муцинозной цистаденомы принята активная хирургическая тактика независимо от её размеров, что обусловлено высокой опасностью малигнизации именно этой разновидности кисты. Среди методов оперативного лечения допустимо только полное её удаление обычно с резекцией соответствующего отдела поджелудочной железы после пункции, биопсии, цитологического и гистологического подтверждения диагноза.
Следует учитывать, что стенка кистозной опухоли часто имеет участки, лишённые внутренней эпителиальной выстилки. Исследованию подлежат несколько фрагментов стенки кисты, состоящих преимущественно из участков, где находятся внутриполостные тканевые разрастания или перегородки.
Внутрипротоковая папиллярно-муцинозная опухоль
Это редкая и труднодиагностируемая опухоль. Встречается в любом возрасте. Развивается из призматического, муцинпродуцирующего эпителия главного или боковых протоков поджелудочной железы и локализуется преимущественно в её головке или крючковидном отростке. Такие опухоли представлены в виде папиллярных эпителиальных разрастаний, продуцируют густую слизь и сопровождаются резким расширением главного и боковых протоков поджелудочной железы. В отдельных случаях может наблюдаться преимущественное поражение какого-то одного отдела железы. Эта разновидность опухоли имеет абсолютный риск малигнизации.
В связи с тем что ни один из методов инструментального исследования, кроме морфологического, не способен определить истинные границы распространения опухоли по протокам, основным методом лечения является тотальная панкреатэктомия. В отдельных случаях допустимо удаление железы в границах видимых изменений со срочным гистологическим исследованием срезов.
В.А. Кубышкин
Источник
По данным крупных исследований, общее число случаев кистозных опухолей поджелудочной железы (КОПЖ) неопределенного генеза составляет от 2,6% до 15% от общей численности населения и увеличивается с возрастом до 37% у пациентов > 80 лет.
 Ввиду широкого применения в клинической практике метода компьютерной томографии с получением высококачественных изображений поперечного слоя, КОПЖ также часто выявляют у пациентов, не обнаруживающих симптомов заболевания.
Ввиду широкого применения в клинической практике метода компьютерной томографии с получением высококачественных изображений поперечного слоя, КОПЖ также часто выявляют у пациентов, не обнаруживающих симптомов заболевания.
В руководстве приведем анализ авторов по вопросам диагностики и хирургического лечения кистозных опухолей поджелудочной железы.
↯
Больше статей в журнале
«Заместитель главного врача»
Активировать доступ
Ввиду широкого применения в клинической практике метода компьютерной томографии с получением высококачественных изображений поперечного слоя, КОПЖ также часто выявляют у пациентов, не обнаруживающих симптомов заболевания.
Соответственно, центры хирургии поджелудочной железы с высоким объемом выполняемых операций отмечают ежегодное увеличение числа пациентов с диагнозом КОПЖ.
При этом медиана размера основной кистозной опухоли на момент постановки диагноза продолжает снижаться (средний диаметр кисты при постановке диагноза составляет около 20 мм).
КОПЖ отличаются разными биологическими характеристиками, как это отражено в классификации ВОЗ от 2010 года и обобщенно представлено в таблице «Кистозные опухоли поджелудочной железы (классификация ВОЗ от 2010 года)».
Применение такой классификации для дифференцирования случаев, определенно требующих оперативного вмешательства, кажется простой задачей.
Главным вопросом, вызывающим разногласия в отношении лечения КОПЖ, является невозможность постановки точного патогистологического диагноза без хирургической резекции.
К счастью, подавляющему большинству пациентов, которых направляют к хирургу по поводу кисты поджелудочной железы, никогда не потребуется точный патогистологический диагноз.
Многие виды КОПЖ, являясь предзлокачественными изменениями, имеют потенциал к трансформации в злокачественные образования.
Было показано, что этот потенциал очень вариативный («Типичные эпидемиологические признаки и степень злокачественности кистозных образований поджелудочной железы»).
Он может быть высоким (риск трансформации в инвазивный рак в сочетании с внутрипротоковой папиллярной муцинозной опухолью (ВПМО) с поражением главного панкреатического протока, составляет приблизительно 44% в серии операций), а в некоторых случаях, крайне низким (как при небольших , медленно растущих ВПМО с поражением боковых ветвей ГПП) или даже почти отсутствовать (как при серозной цистаденоме).
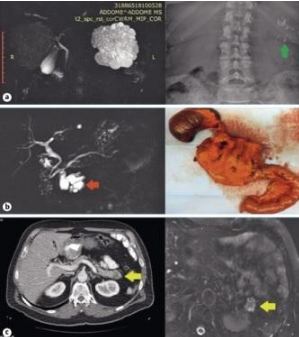
Из-за такой неоднородности клиницистам в практике бывает сложно найти баланс между двумя крайностями: не допустить назначения излишнего хирургического лечения и не совершить трагическую ошибку, сохранив злокачественную опухоль под наблюдением (рисунок).
Рисунок «Хороший, плохой и ужасный».
- a — Хороший: бессимптомное течение крупной серозной цистаденомы хвоста поджелудочной железы (микро-макрокистозный тип, с типичным большим центральным рубцом и кальцификациями), случайно обнаруженная у женщины средних лет.
Случайно установленный диагноз из-за присутствия кальцификации, выявленной по результатам рентгенографии органов брюшной полости (зеленая стрелка)
- b — Плохой: кистозная опухоль головки поджелудочной железы размером 4 см с солидным компонентом, накапливающим контраст, и начальными признаками ретроградной дилатации холедоха и ГПП (красная стрелка).
По данным патологического исследования была выявлена инвазивная протоковая аденокарцинома, ассоциированная с ВПМО с поражением боковых ветвей ГПП (гастроинтестинальный фенотип ВПМО с тяжелой дисплазией с инвазивным компонентом).
- c — Ужасный: наличие кистозной опухоли в хвосте поджелудочной железы размером 2,5 см (желтая стрелка) с множественными мелкими перегородками, накапливающими контраст, ассоциированной с накапливающим контраст солидным компонентом, по данным эндоскопической ультрасонографии («эндоскопический признак высокого риска»11).
По данным патологического исследования после операции был выявлен «злокачественный» характер серозной микрокистозной цистаденомы.
При всей ограниченности данных по этой конкретной теме, на сегодня точность методов визуализации поперечного слоя при КОПЖ составляет от 47 до 78%.
Как поликлинике организовать раннее выявление онкологии по новым требованиям. Образцы локальных документов и памятки для медработников в журнале «Заместитель главного врача».
Хотя в настоящее время отсутствует «идеальный метод» дооперационного определения истинной природы кисты, улучшения, произошедшие в диагностике благодаря разработке современных эндоскопических методов, большее понимание биологии различных патогистологических образований по данным наблюдательных исследований, и введение нескольких руководств, направленных на выделение групп риска, — все вместе сделали подход к данному вопросу более избирательным, позволяющим снизить к минимуму возможность клинически значимых ошибок при диагностике.
Целью настоящей статьи является критический обзор с позиций хирурга основных признаков КОПЖ в том виде, как они представлены в практике амбулаторного лечения и которыми руководствуются в процессе принятия клинических решений и лечения.
В обсуждении также рассматриваются разногласия, представленные в литературе последних лет.
В статье вы найдете только несколько готовых образцов и шаблонов.
В Системе «Консилиум» их более 5000.
Успеете скачать всё, что нужно, по демодоступу за 3 дня?
Активировать
Эпидемиология КОПЖ
В эпоху применения компьютерной томографии и эндоскопической ультрасонографии (ЭУС) не следует недооценивать некоторые важные эпидемиологические аспекты КОПЖ при постановке предполагаемого диагноза.
О них следует всегда помнить при первичном обследовании пациента на наличие КОПЖ. Как правило, частота развития ВПМО повышается с возрастом.
Некоторые формы ВПМО более характерны для женщин или мужчин, появляются в конкретном возрасте и имеют определенную локализацию.
Основные эпидемиологические признаки КОПЖ перечислены в таблице «Типичные эпидемиологические признаки и степень злокачественности кистозных образований поджелудочной железы» вместе с вероятностью их прогрессирования в злокачественные новообразования.
Диагностические средства выявления КОПЖ
МРТ / магнитно-резонансная панкреатохолангиография (МРПХГ), которая дифференцирует приблизительно 40-95% случаев КОПЖ (по сравнению с 40-81% при КТ), является золотым стандартом диагностики при подозрении на КОПЖ, поскольку он более чувствителен, чем КТ, в распознавании связи с протоковой системой поджелудочной железы, и информативен для идентификации солидного компонента, внутристеночного узла (ВУ) и многоочаговых КОПЖ.
Однако точность лучевой диагностики для идентификации конкретного типа КОПЖ с использованием одного метода визуализации остается относительно низкой, и часто требуется комбинированный подход.
Эндоскопия
В настоящее время ЭУС является важным диагностическим инструментом исследования КОПЖ. ЭУС рекомендуется в качестве метода диагностики второй линии в дополнение к КТ / МРТ во всех случаях, когда рентгенодиагностика злокачественности не является убедительной и / или когда КОПЖ имеет клинические или рентгенологические признаки, вызывающие озабоченность.
В частности, ЭУС с контрастированием (CE-EUS) всегда следует использовать, когда присутствуют внутристеночные узлы (ВУ) или солидные компоненты, для оценки на наличие васкуляризации.
Цитология и биомаркеры
При подозрении на злокачественную трансформацию следует назначать тонкоигольную аспирационную пункционную биопсию под контролем ЭУС, особенно когда результаты рентгенодиагностики неоднозначны.
Цитологическое исследование высоко специфично (83-100%), хотя имеет относительно низкую чувствительность (27-48%), что приводит в итоге к низкой диагностической точности исследования (8-59%).
Поэтому, его всегда необходимо сочетать с морфологическим исследованием с помощью ЭУС.
✔ Новые правила по УЗИ, клиническим исследованиям. Что изменится для медорганизаций, узнайте в журнале «Заместитель главного врача»
Химический анализ содержания РЭА в кистозной жидкости и уровня амилазы может быть полезным, но он не различает муцинозные кистозные опухоли (МКО) и ВПМО.
Повышенный уровень содержания РЭА является маркером, который позволяет различать муцинозные и немуцинозные кисты, но он не информативен для дифференцирования доброкачественных и злокачественных кист.
Предельная концентрация РЭА ≥192–200 нг/мл дает приблизительно 80% точности для диагностирования муцинозной кисты (при высокой специфичности, но низкой чувствительности метода).
Молекулярный анализ кистозной жидкости как метод диагностики все еще развивается. Анализ мутаций гена KRAS более точно диагностирует муцинозные кисты, но не обязательно злокачественные кисты.
Анализ мутаций гена GNAS может быть полезным для дифференциации значительных муцинозных кист и медленно растущих кист, которые поддаются консервативному лечению.
Раковый антиген СА 19-9 в сыворотке крови является независимым прогностическим фактором злокачественности ВПМО, и если его уровень превышает 37 ед/л, то это связывают с повышенным риском развития инвазивной карциномы.
В литературе отмечают низкую специфичность ракового антигена CA 19-9, и это, вероятно, также связано с тем, что, к сожалению, большинство исследований включало тяжелую дисплазию и инвазивный рак в одну категорию «злокачественности».
Смотреть список литературы

Материал проверен экспертами Актион Медицина
Источник