Клинические исследования рака поджелудочной железы
Врачи и ученые постоянно изучают новые методы лечения рака поджелудочной железы с целью улучшения уже существующих методик.
Клинические исследования — это один из способов изучения безопасности и эффективности новых методов лечения по сравнению со стандартным подходом к терапии.
В клинических исследованиях проводится оценка новых препаратов, новых комбинаций уже применяющихся лекарств, новых подходов к проведению радиотерапии или хирургического лечения, а также новых методов профилактики рака.
Пациенты, которые участвуют в клинических исследованиях, имеют возможность одними из первых получить новое лечение до его введения в общеклиническую практику. Однако всегда нужно учитывать, что безопасность и эффективность новых методов лечения еще не установлена.
Пациенты решаются на участие в клинических исследованиях по разным причинам. Для некоторых пациентов научные работы позволяют получить наилучшее на данный момент лечение. Поскольку стандартная терапия не безупречна, многие люди стремятся принять участие в клинических исследованиях в надежде на лучшие результаты лечения. Другие пациенты становятся добровольцами по той причине, что поиски новых лекарственных препаратов и других методов лечения очень важны для разработки способов борьбы с раком поджелудочной железы. Даже если клиническое исследование не поможет непосредственно им, могут получить пользу многие другие пациенты с раком поджелудочной железы.
Некоторые пациенты обеспокоены, что, участвуя в клинических исследованиях, они получат лишь плацебо, то есть таблетку-пустышку, которая не содержит лекарства. Однако в клинических исследованиях, которые посвящены вопросам онкологии, плацебо, используется крайне редко. Его применение возможно только с полного согласия участников исследования.
Перед участием в клиническом исследовании пациенты должны дать информированное согласие. В ходе предварительной беседы врач перечисляет все возможные варианты лечения так, чтобы пациент понял отличие нового метода от стандартной терапии. Кроме этого, врач обязан рассказать обо всех возможных рисках применения нового лечения, которые могут отличаться от побочных эффектов стандартной терапии. Наконец, врач должен разъяснить пациенту все требования, которые необходимо выполнить для участия в клиническом исследовании, включая все анализы, количество посещений и график лечения.
Пациенты могут в любой момент отказаться от участия в клиническом исследовании, например, если лечение не работает или развиваются тяжелые или опасные для жизни побочные эффекты, а также по любой другой причине личного или медицинского характера.
Важно обсудить с врачом и исследователями, кто будет проводить лечение и осуществлять сопутствующую помощь, особенно после окончания клинического исследования или в тех случаях, когда пациент решает отказаться от него до окончания всех процедур.
Узнать больше о доступных клинических исследованиях и их фазах, а также о вопросах, которые следует задать исследовательской группе, можно в интернете или у лечащего врача.
+7 495 66 44 315 — где и как вылечить рак
ЗАПРОС на ЛЕЧЕНИЕ РАКА
Источник
Рак поджелудочной железы занимает 10 место по распространенности раковых заболеваний среди населения всего земного шара. С каждым годом количество людей, кому поставили диагноз рак поджелудочной железы, растет. Даже с учетом хорошей диагностической базы большая часть пациентов обращается к врачу с 3 или 4 стадией заболевания.
Для того, чтобы увеличить продолжительность жизни пациентов с запущенной стадией онкопроцесса, диагностировать заболевание на ранних стадиях и успешно его лечить, во многих медицинских центрах по всему миру проводятся исследования. Основным направлением научной деятельности является поиск причин образования опухоли в поджелудочной железе, разработка диагностических тестов для выявления опухоли на ранней стадии, совершенствование старых методов лечения, поиск и тестирование новых химиопрепаратов.
Генетика и раннее выявление
Ученые все больше узнают о некоторых изменениях генов в клетках поджелудочной железы, которые приводят к образованию рака. Уже известны наследственные изменения в генах, такие как BRCA2, p16, и гены, вызывающие синдром Линча, которые могут увеличить риск развития рака поджелудочной железы.
Осталось только выяснить, как эти и другие гены могут быть изменены при онкологии поджелудочной железы. Информация о генах позволит разработать тесты для выявления приобретенных (не наследственных) изменений генов при предраковых состояниях поджелудочной железы.
Одним из наиболее распространенных изменений ДНК является KRAS онкоген, который влияет на регулирование роста клеток. Новые диагностические тесты способны распознать это изменение в образцах панкреатического сока, собранного во время ЭРХПГ (эндоскопической ретроградной холангиопанкреатографии). Однако тест на определение KRAS онкогена используется для людей только с наследственной предрасположенностью к раку поджелудочной железы.
Лечение
Сейчас многие исследования сосредоточены на поиске новых методов лечения данной патологии. Однако никто не забывает и об улучшении хирургии и радиотерапии, оптимальной комбинации различных методов лечения при раке на разных стадиях.
Хирургия
Операция по удалению рака поджелудочной железы (чаще всего процедура Уиппла) представляет собой длительный и сложный процесс, который тяжело переносится не только пациентом, но и врачом хирургом. Достаточно тяжело проходит и послеоперационный период, в основном из-за длительного восстановительного периода.
Альтернативой процедуре Уиппла является лапароскопическая операция. При таком подходе хирург делает несколько небольших разрезов в животе вместо одного большого. Длинные, тонкие хирургические инструменты и крошечные видеокамеры вставляют в разрезы, чтобы сделать операцию. Одно из преимуществ этой операции является то, что люди быстрее восстанавливаются после нее, она не требует длительного пребывания в стационаре.
Радиационная терапия
Для терапии рака поджелудочной железы преимущественно используют 2 вида лучевой терапии: интраоперационную и протонную. При первом варианте во время операции одна большая доза излучения подается непосредственно на очаг опухоли. При протонной лучевой терапии используют специальный тип излучения, который проникает на любую глубину человеческого тела, повреждает ДНК раковых клеток и останавливает дальнейший рост опухоли.
Химиотерапия
Сейчас проводится много клинических испытаний, на которых проверяют новые комбинации химиотерапевтических препаратов для рака поджелудочной железы. Последние исследования показали, что Гемцитабин в сочетании с другими лекарственными препаратами увеличивает продолжительность жизни, облегчает состояние пациентов с 3 и 4 стадией онкопроцесса.
Таргетная терапия
Целевые препараты работают по-разному, однако от стандартных препаратов химиотерапии они отличаются тем, что воздействуют преимущественно только на раковые клетки и имеют меньше побочных эффектов по сравнению с традиционными препаратами химиотерапии.
Многие типы раковых клеток, в том числе и раковые клетки поджелудочной железы, имеют определенные белки на своей поверхности, которые помогают им расти. Эти белки называются рецепторами фактора роста. Одним из примеров является рецептор эпидермального фактора роста (EGFR). Препараты, которые нацелены на EGFR в настоящее время изучаются. Один из них, известный как Эрлотиниб (Тарцева), уже одобрен для использования вместе с Гемцитабином.
На стадии разработки находятся препараты, блокирующие кровоснабжение опухоли, препараты, направленные на разрушение стромы опухоли поджелудочной железы. Бытует мнение, что химиопрепраты в лечении рака поджелудочный железы могут быть неэффективны по причине того, что они не могут пройти стромальный (наружный) барьер опухоли. Строма или наружная защитная оболочка опухоли защищает раковые клетки от химиопрепаратов. В настоящий момент тестирование проходит препарат PEGPH20, который “атакует” строму опухоли. Это позволит химио- и другим препаратам быть более эффективными.
Существует еще одна теория, почему рак поджелудочной железы трудно лечить. И она основана на том, что не все раковые клетки в опухоли являются одинаковыми. Там может быть небольшая группа раковых клеток, называемых стволовыми клетками. Это раковые клетки устойчивые к химиопрепаратам. При прохождении курса химиотерапии часть раковых клеток погибает, а стволовые продолжают расти. BBI-608 и demcizumab нацелены на такие раковые стволовые клетки.
Иммунная терапия
Иммунная терапия стимулирует иммунную систему больного человека либо дает ему готовые компоненты иммунной системы, которые ведут борьбу с раковыми клетками.
Моноклональные антитела. Одна из форм иммунотерапии использует инъекции искусственных моноклональных антител. Эти белки иммунной системы связываются с антигеном (таким как карциноэмбриональный антиген (CEA)) на поверхности раковых клеток. Моноклональные антитела на своей поверхности могут нести радиоактивные атомы, токсины, что приводит к локальной гибели опухоли без повреждающего воздействия на окружающие здоровые ткани. На данный момент это лечение при раке поджелудочной железы доступно только в клинических испытаниях.
Противораковые вакцины. Существует несколько типов вакцин для повышения иммунного ответа организма на раковые клетки поджелудочной железы. В отличие от вакцин против инфекций, как корь или эпидемический паротит, эти вакцины предназначены для лечения, а не для профилактики заболевания.
Одним из возможных преимуществ этих видов лечения является то, что они, как правило, имеют очень ограниченные побочные эффекты.
Препараты, которые нацелены на контрольно-пропускные пункты иммунной системы. Собственная иммунная система человека не повреждает клетки своего организма благодаря наличию «контрольных точек» — молекул на клетках иммунной системы, которые должны быть активированы (или инактивированной), чтобы начать иммунный ответ. Раковые клетки иногда находят способы использовать эти контрольно-пропускные пункты, чтобы избежать нападения со стороны иммунной системы. Препараты, активирующие клетки иммунной системы и закрывающие пропускные пункты для раковых клеток, находятся в разработке.
Индивидуальный подход к лечению онкозаболеваний
Некоторые препараты работают лучше, если в опухоли пациента найдены конкретные типы мутаций. Например, Эрлотиниб работает лучше у пациентов, у которых опухоли имеют конкретные изменения в гене EGFR. Эта концепция является областью интенсивного изучения.
В ближайшее время для эффективно назначенного лечения любого ракового заболевания на любой стадии достаточно будет сдать пару диагностических тестов.
Что касается организационных вопросов, то вводят обязательные диагностические процедуры для людей в поликлиниках, стационарах, ужесточают профилактические медицинские осмотры.
Важно! Для тех, у кого близкий родственник болеет раковым заболеванием есть шанс пройти экспериментальное (бесплатное) лечение. Всегда интересуйтесь у своего лечащего врача о возможности прохождения такого лечения.
Читайте больше на сайте Tumor-Clinic — Современные методы лечения рака
Коментарии:
Источник
Постоянно продолжаются клинические исследования рака поджелудочной железы. Некоторые достижения были сделаны в исследованиях, но на данный момент многие из них еще не одобрены или не введены в клиническую практику.
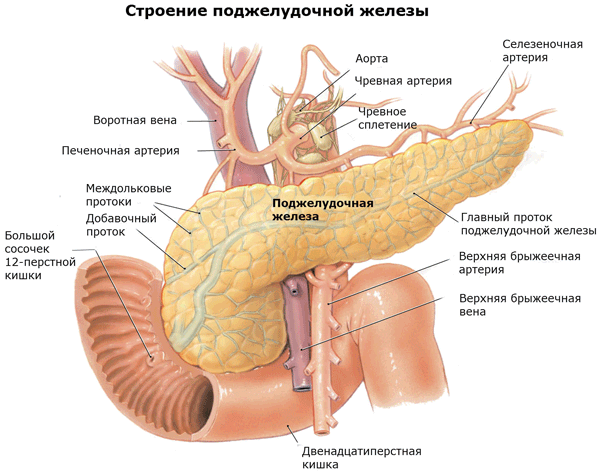
Ранее выявление рака поджелудочной железы
Максимально эффективно лечение рака поджелудочной железы в тех случаях, когда опухоль выявляется на ранних стадиях. Многие клинические исследования посвящены поиску и применению диагностических мероприятий для ранней диагностике рака поджелудочной железы до его распространения. Такие исследования особенно важны для людей из группы высокого риска развития рака поджелудочной железы. Пока еще неизвестна ценность методик скрининга для населения.
Генетические исследования
Работой поврежденного или дефектного гена обусловлен неконтролируемый рост клеток в раковых опухолях. Возможности коррекции или исправления поломок в генах или белках посвящены современные исследования. Для обнаружения генных мутаций, которые отвечают за развитие рака поджелудочной железы, проводятся генетические исследования. После обнаружения таких генов врачи смогут использовать их как маркер высокого риска развития опухоли у других людей.
Биологическая терапия
Для активации собственных защитных сил организма на борьбу с раком используется биологическая терапия или иммунотерапия. При этом используются препараты, являющиеся аналогами естественных веществ организма человека, которые стимулируют функции иммунной системы. Противоопухолевые вакцины являются одним из примеров иммунотерапии. Такие вакцины «учат» иммунную систему человека распознавать и уничтожать раковые клетки. Многие клинические исследования, посвященны изучению вакцин при различных типах рака.
Прицельная терапия
Единственным препаратом, который одобрен к применению при раке поджелудочной железы, является эрлотиниб. Он назначается в комбинации с гемцитабином. Изучается применение при раке поджелудочной железы и других лекарств, блокирующих рост и распространение раковых клеток. К ним относится бевацизумаб (Авастин) и цетуксимаб (Эртубикс). Они могут назначаться в виде комбинированной или монотерапии терапии. Пока учеными не отмечено увеличение коэффициентов выживаемости при раке поджелудочной железы на фоне применения данных препаратов.
Генная терапия
При генной терапии в раковые клетки вносятся особые гены, с помощью созданных специально для этого вирусов. Нормально функционирующие гены встраиваются в ядро раковой клетки. По мере ее размножения замещают дефектные генетические участки, отвечающие за рост и размножение клеток раковой опухоли.
Еще один вариант генной терапии непосредственное введение в опухоль гена TNF-alpha. Этог ген отвечает на образование белка под названием фактор некроза опухоли. При помощи радиотерапии происходит активация данного гена, и в результате этого усиливается противоопухолевая активность организма.
Химиотерапия
При распространенном раке поджелудочной железы эффективны несколько препаратов, применение которых изучается в комбинациях с гемцитабином. К таким преператам относятся новые формы паклитаксела (Таксола), увеличивающие эффективность действующего вещества. В настоящее время данные препараты изучаются в клинических исследованиях. Еще один препарат, с механизмом действия аналогичным капецитабину, является TS-1. Он состоит из тегафура, гимерацила и отерацила калия и одобрен в некоторых странах Азии, но в США широко не применяется.
Стволовые раковые клетки
Особые опухолевые клетки рака поджелудочной железы, которые могут быть частично устойчивы к стандартным методам лечения называются стволовые клетки. Проводятся исследования, посвященные поиску лекарств, влияющих на эти стволовые клетки опухоли.
Источник
Российский онкологический научный центр им. Н.Н. Блохина РАМН
Рак поджелудочной железы (РПЖ) относительно редкое заболевание – составляет 3% среди всех злокачественных опухолей, но стоит на 5 месте среди наиболее частых причин смертности от рака. В последние десятилетия отмечен устойчивый рост заболеваемости. В 1999 году в России выявлено 13 тыс. вновь заболевших, умерло 11 тыс. человек [1]. 5–летняя выживаемость при РПЖ самая низкая среди всех опухолей – 3%, медиана жизни нерезектабельных больных около 4 месяцев.
Пик заболеваемости приходится на шестое десятилетие жизни. Факторами риска являются курение, сахарный диабет, хронический панкреатит. Опухоли, главным образом, развиваются из экзокринной части поджелудочной железы и в 80% случаев представлены аденокарциномой.
Главная особенность РПЖ – поздняя диагностика. Опухоль дает раннее обширное метастазирование, у 90% больных в момент постановки диагноза уже имеется местнораспространенный или диссеминированный процесс, когда радикальное хирургическое лечение невозможно.
Таким образом, при местнораспространенном процессе химио– и/или лучевая терапия, а при диссеминированном процессе – химиотерапия, являются единственными методами возможного воздействия, однако из–за низкой чувствительности опухоли стандарта паллиативного лечения РПЖ не существует.
В течение многих лет 5–фторурацил (5ФУ) был препаратом выбора для больных, которым была показана монохимиотерапия. По результатам исследований 1970–80 гг. его эффективность составляет 15–20%, однако более поздний анализ показал активность 5ФУ от 0 до 14% [2]. Эффективность таких цитостатиков, как митомицин С (митС), ифосфамид (ифо), цисплатин (ДДП) при РПЖ около 15% [2,3,4]. Еще меньшей активностью обладают стрептозотоцин и доксорубицин (Dxr) [2]. Все препараты дают только частичные регрессии опухоли. Комбинированные режимы: ФАМ (5ФУ, Dxr, митС) или СМФ (стрептозотоцин, митС, 5ФУ) – увеличивая токсичность лечения, не улучшают его результатов [5, 6]. Гормональное лечение с использованием тамоксифена или аналога соматостатина октреотида не показало какого–либо клинического значения [7].
Еще одна серьезная проблема при РПЖ – оценка эффективности лечения. Такие современные технические средства, как компьютерная томография (КТ) или магнитно-резонансная томография (МРТ), из–за выраженных десмопластических реакций, включающих воспаление и фиброз внутри и вокруг опухоли, не позволяют измерить ее распространенность, уточнить локализацию внутри прилежащих тканей и, следовательно, четко интерпретировать ответ на лечение. Прежде всего, это относится к местнораспространенной опухоли.
Поэтому при РПЖ оценка качества жизни в процессе паллиативного лечения стала одним из параметров его эффективности. При этом учитывается общее состояние пациента, интенсивность боли и количество применяемых анальгетиков, меньшее значение имеет динамика массы тела.
Связанный с опухолью болевой синдром является ведущим симптомом РПЖ и наблюдается у 80% больных при установлении диагноза. Показано, что даже небольшое уменьшение размеров опухоли в процессе лечения, объективно соответствующее стабилизации, может сопровождаться значительным уменьшением болевого синдрома и количества применяемых анальгетиков [8].
Разработанная система оценки паллиативного эффекта при РПЖ включает: ослабление болевого синдрома на 50%, уменьшение суточного потребления наркотиков на 50%, улучшение общего состояния на 20% по шкале Карновского и положительную динамику веса на 7% от исходного [9]. Такая динамика этих показателей или хотя бы одного из них, сроком не менее, чем 4 недели, без ухудшения других, рассматривается как клиническое улучшение или клиническая выгода (КВ). Впервые качество жизни, как критерий эффективности лечения, было использовано при оценке роли гемцитабина в химиотерапии РПЖ.
Гемцитабин – производное дезоксицитидина. Цитостатик из группы антиметаболитов, обладает противоопухолевой активностью при ряде солидных опухолей. Первые сообщения о положительном эффекте гемцитабина при запущенном РПЖ появились в начале 90–х годов. В исследовании Casper с соавт. [10] частичная регрессия опухоли сроком более 6 месяцев зафиксирована у 5 из 39 больных (13%), еще у 3 пациентов (7,7%) отмечена регрессия менее 50%. Наблюдалось уменьшение как первичной опухоли, так и метастазов в печень. Эффект сопровождался уменьшением болевого синдрома и улучшением общего состояния. Международная медицинская экспертиза подтвердила эти результаты.
В 1997 г. опубликованы окончательные результаты кооперативного сравнительного рандомизированного изучения эффективности гемцитабина и 5ФУ у 126 больных, проведенного в США и Канаде [11]. Объективный эффект при лечении гемцитабином составил 5,4%, при 5ФУ – не наблюдался. Симптоматическое улучшение в группе с гемцитабином составило 23,8%, в группе с 5ФУ – 4,8%. Наблюдение за больными в течение года продемонстрировало следующее: живы 18% больных, леченных гемцитабином, в сравнении с 2%, леченных 5ФУ (р = 0,0025).
Результаты проведенных в США других кооперированных исследований показали симптоматический эффект у 17 из 63 больных, получавших гемцитабин (27%) и не ответивших на лечение 5ФУ, при этом объективная регрессия опухоли составила 10,5%. Больше 6 мес. прожили 31%, более 9 мес. – 15% и более 1 года – 4% пациентов [12]. В настоящее время гемцитабин рекомендован в качестве 1 линии химиотерапии при запущенном РПЖ в России и зарубежом. Общепринятая разовая доза препарата в режиме монохимиотерапии – 1000–1200 мг/м2, вводимая 30–минутной внутривенной инфузией 1 раз в неделю в течение 7 недель, затем после 1–недельного перерыва в 1, 8, 15 дни.
Гемцитабин обладает минимальными побочными действиями и хорошо переносится больными. Алопеция наблюдается редко, рвота возникает в среднем у 20% пациентов. Дозолимитирующая токсичность: нейтропения III–IV ст. – 24–30%, тромбоцитопения III–IV ст. – около 5%, анемия III–IV ст. – около 7%.
Комбинированная химиотерапия
Доклинические исследования показали синергизм взаимодействия гемцитабина с 5ФУ, ДДП и рядом других цитостатиков. В связи с этим в клинике изучались двойные комбинации гемцитабина с 5ФУ, ДДП, эпирубицином у больных РПЖ. Эффективность лечения в этих исследованиях варьировала от 5 до 21%, медиана времени до прогрессирования – от 2,4 до 7,4 мес., медиана общей выживаемости – от 4,3 до 10,3 мес., 1–годичная выживаемость – от 9 до 39,5% [13, 14, 15, 16, 17, 18, 19]. Гемцитабин вводился в стандартных дозах в виде 30–минутной инфузии, 5ФУ вводился болюсно, в виде 24–часовой инфузии или длительной внутривенной инфузией (ДВИ) ± лейковорин. Использовались стандартные и высокие дозы 5ФУ, однако преимуществ у комбинации гемцитабина с высокими дозами 5ФУ не отмечено.
Таким образом, продемонстрирован большой разброс результатов. Количество больных, включенных в эти исследования, варьировало от 26 до 66, метастатическая форма заболевания составляла от 46% до 100% всей популяции, поражение печени наблюдалось в 65–87% случаев, в большинстве случаев не учитывалась степень злокачественности опухоли, которая является одним из главных прогностических факторов при протоковой аденокарциноме поджелудочной железы [20]. Интерпретация полученных результатов затруднительна, кроме того, оценка влияния химиотерапии на выживаемость находится за пределами исследований по II фазе.
Активно изучается комбинация гемцитабина с доцетакселом, которая по мнению ряда исследователей является перспективной [21, 22, 23].
Опубликованы предварительные результаты рандомизированного исследования, сравнивающего активность гемцитабина в монотерапии с комбинацией гемцитабин + цисплатин при распространенном РПЖ [24]. В обеих группах гемцитабин вводился в дозе 1000 мг/м2 в 1, 8, 15 дни каждые 29 дней. ДДП вводился в дозе 25 мг/м2 во второй группе в те же дни, что и гемцитабин. У больных, получавших гемцитабин в монорежиме, общая эффективность лечения – 10%, у больных, получавших комбинацию – 42%. Клиническое улучшение практически одинаково в обеих группах (45% и 38%). Изучаются и другие, более сложные схемы полихимиотерапии. Villa с соавт. [25] разработал 4–х компонентный режим PEF–G, включающий гемцитабин (Гем), цисплатин, эпирубицин (эпи) и 5ФУ.
Схема лечения PEF–G:
ДДП – 40 мг/м2 в 1 день.
Эпи – 40 мг/м2 в 1 день.
Гем – 600 мг/м2 1–часовая инфузия в 1, 8 дни.
5ФУ – 200 мг/м2/день длительная инфузия в течение всего курса.
Лечение повторяется каждые 4 недели. Максимально до 6 курсов или до прогрессирования болезни (ПБ) или неприемлемой токсичности. Оценено 43 больных, отмечена 1 полная и 24 частичных регрессии опухоли, общая эффективность лечения – 58% (25 / 43). У 14 пациентов наблюдалась стабилизация (СТ) – 33%. Медиана длительности ремиссий – 8,5 мес., медиана времени до прогрессирования – 7,5 мес., медиана выживаемости – 11 мес. Клиническая выгода лечения оценена как положительная у 22 из 28 пациентов (78%). Токсичность режима PEF–G высока: нейтропения III–IV ст. – 85%, тромбоцитопения III–IV ст. – 59%, анемия III ст. – 7%, стоматит III ст. – 12%, диарея – 6%, рвота – 6%.
Наилучшая симптоматическая терапия
Наилучшая симптоматическая терапия – одна из составляющих всего комплекса паллиативного лечения при распространенном РПЖ, ее основными методами являются лечебное питание, симптоматическое лечение, психологическая помощь.
Лечение симптомов болезни проводится с целью улучшения качества жизни пациентов и включает облегчение абдоминальных болей, прекращение снижения веса, уменьшение анорексии. Очень важна проблема оказания психологической помощи больным, т.к. при РПЖ более высока частота психических нарушений, чем при других формах рака. Больные боятся этого заболевания в связи с его репутацией смертельного и вызывающего боли, тревога и депрессия часто осложняют течение болезни. В таблице 1 представлены лечебные мероприятия, включаемые в термин «наилучшая симптоматическая терапия».
К настоящему времени рядом рандомизированных исследований установлено, что паллиативная химиотерапия превосходит по результатам наилучшую симптоматическую терапию или отсутствие дополнительного лечения (данные представлены в таблице 2).
Итак, паллиативное лечение при распространенном раке поджелудочной железы включает в себя как специфическое противоопухолевое лечение, так и симптоматическую терапию (см. табл. 3).
Заключение
Рак поджелудочной железы – тяжелое заболевание, представляющее собой серьезную проблему в онкологии. Это обусловлено рядом причин:
Рак поджелудочной железы – тяжелое заболевание, представляющее собой серьезную проблему в онкологии. Это обусловлено рядом причин:
- рост заболеваемости;
- поздняя диагностика (80% больных имеют запущенный опухолевый процесс);
- низкая 1–годичная и 5–летняя выживаемость;
- низкая чувствительность опухоли к химио– и лучевой терапии.
В последнее десятилетие повысился интерес к паллиативному лечению при распространенном РПЖ. Это связано с появлением новых препаратов и подходов к комбинированной химиотерапии, а также с введением новых критериев оценки результатов лечения, учитывающих такие параметры как качество жизни (КЖ), и клиническую выгоду (КВ).
Доказано, что химиотерапия увеличивает выживаемость и улучшает качество жизни больных по сравнению с наилучшей симптоматической терапией. Максимальная эффективность химиотерапии достигается при использовании гемцитабина, который является препаратом I линии при этом заболевании.
В настоящее время химиотерапия обладает наибольшим потенциалом в паллиативном лечении распространенного РПЖ, одновременно воздействуя на опухоль и качество жизни больных.
Литература:
1. Н.Н. Трапезников, Е.М. Аксель, Статистика злокачественных новообразований в России и странах СНГ (состояние онкологической помощи, заболеваемость и смертность). Москва 2001, 295 с.
2. O’Connell M.J. «Current status of chemotherapy for advanced pancreatic and gastric cancer». J. Clin Oncol 1985; 3: 1032–1039.
3. Loehrer P. et al. «Ifosfamide: an active drug in the treatment of adenocarcinoma of the pancreas». J. Clin Oncol 1985; 3:367–372.
4. Wils J., Kok T., Wagener D. et al. «Activity of cisplatin in adenocarcinoma of the pancreas». Eur. J. Cancer 1993; 29 A (2): 203–204.
5. Smith F.P., Hoth D.F., Levin B., et al. «5–fluorouracil, Adriamycin and mitomycin C (FAM) chemotherapy for advanced adenocarcinoma of the pancreas». Cancer 1981; 46: 2014–2018.
6. Wiggaus R.G., Wooley P.V., Mac Donald J.S., et al. «Phase II trial of streptozotocin, mitomycin C, and 5–fluorouracil (SM7) in the treatment of advanced pancreatic cancer». Cancer 1978; 41: 387–391.
7. Cascinu S., DelFerro E., Catalano G. «Arandomized trial of octreotide vs best supportive care only in advanced gastrointestinal cancer patients refractory to chemotherapy». Br. J. Cancer 1995; 71: 97–101.
8. Glimelius B., Hoffman K., Sjoden P.–O., et al. «Chemotherapy improves survival and quality of life in advanced pancreatic and biliary cancer». Ann Oncol 7: 593–600, 1996.
9. Fink U., Russel R.C., Spittle M.E., et al. « Phase II study of gemcitabine in patients with advanced pancreatic cancer». Eur. J. Cancer 1993; 29 (suppl 6): 101.
10. Casper E.S., Green M.R., Kelsen D.F., et al. «Phase II trial of gemcitabine in patients with adenocarcinoma of the pancreas». Invest New Drugs 12: 29–34, 1994.
11. Burris H.A. III, Moore M.J., Andersen J., et al. «Improvement in survival and clinical benefit with gemcitabine as first–line therapy for patients with advanced pancreatic cancer: A randomized trial». J. Clin Oncol 15: 2403–2413, 1997.
12. Rothemberg M.L., Moore M.J., Cripps M.C., et al. «A phase II trial of gemcitabine in patients with 5–FU–refractory pancreas cancer». Ann Oncol 7: 347–353, 1996.
13. Heinemann V., Wilke H., Mergenthaler H.–G., et al. « Gemcitabine and cisplatin in the treatment of advanced or metastatic pancreatic cancer». Ann Oncol 11: 1399–1403, 2000.
14. Scheitauer W., Kornek G.V., Raderer M., et al. «Phase II trial of gemcitabine 4, epirubicin and granulocyte cololny–stimulating factor in patients with advanced pancreatic adenocarcinoma». Br. J. Cancer 80: 1797–1802, 1999.
15. Hidalgo M., Castellano D., Paz–Ares L., et al. « Phase II study of gemcitabine 4 and fluorouracil as a continious infusion in patients with pancreatic cancer». J. Clin Oncol 17: 585–592, 1999.
16. Oettle H., Arning M., Pelzer U., et al. «A phase II trial of gemcitabine in combination with 5–fluorouracil (24 hour) and folinic acid in patients with chemonaive advanced pancreatic cancer». Ann Oncol 11: 1267–1272, 2000.
17. Berlin J.D., Adak S., Vaughn D.J., et al. « A phase II study of gemcitabine and 5–fluorouracil in metastatic pancreatic cancer: An Eastern Cooperative Oncology Group study (E3296)». Oncology 58: 215–218, 2000.
18. Cascinu S., Silva R.R., Barni S., et al. «A combination of gemcitabine and 5–fluorouracil in advanced pancreatic cancer: A report from the Italian Group for the study of Digestive Tract Cancer (GISCAD)». Br. J. Cancer 80: 1595–1598, 1999.
19. Cascinu S., Frontini L., Labianca R., et al. « A combination of a fixed dose– rate infusion of gemcitabine associated to a bolus 5–fluorouracil in advanced pancreatic cancer: A report from the Italian Group for the study of Digestive Tract Cancer (GISCAD)». Ann Oncol 11: 1309–1311, 2000.
20. Luttges J., Schemm S., Vogel I., et al. «The grade of pancreatic ductal carcinoma is an independent prognostic factor and is saperior to the immunohistochemical assessment of proliferation». J. Pathol 191: 154–161, 2000.
21. Cascinu S., Graziano F., Catalano G., et al. « A phase I–II study of gemcitabine and docetaxel in advanced pancreatic cancer: A report from the Italian Group for the study of Digestive Tract Cancer (GISCAD)». Ann Oncol 10: 1377–1379, 1999.
22. Kakolyris S., Stathopulos G., Tsavaris N., et al. « First–line treatment with docetaxel (D) and gemcitabine (G) in patients with unresactable pancreatic cancer: A multy–center phase II study». Proc. ASCO, 1999.
23. Jacobs A.D., Otero H., Picozs V., et al. « A phase I/II study of gemcitabine (G) and docetaxel (D) in patients (Pts) with unresactable pancreatic cancer». ASCO 2000; Educational Book.
24. Colucci G., Riccardi F., Giuliani F., et al. «Randomized trial of gemcitabine above or with cisplatin in treatment of advanced pancreatic cancer: A phase II multicentre study of the Southeru Italy Oncology Group». Proc. ASCO 18: 961, 1999.
25. Reni M., Passoni P., Panucci M.G., et al. «PE7–g (cisplatin, epirubicin, 5–fluorouracil continuous infusion, gemcitabine): A new combination in advanced pancreatic adenocarcinoma. Phase II study». J. Clin Oncol 19: 2679–2686, 2001.
26. Mallison C.N., Rake M.O., Cocking J.B., et al. «Chemotherapy in pancreatic cancer. Results of a controlled, prospective, randomized multicentre trial». Br. Med. J. 1980; 281: 1589–1591.
Источник

