Кубышкин вишневский рак поджелудочной железы
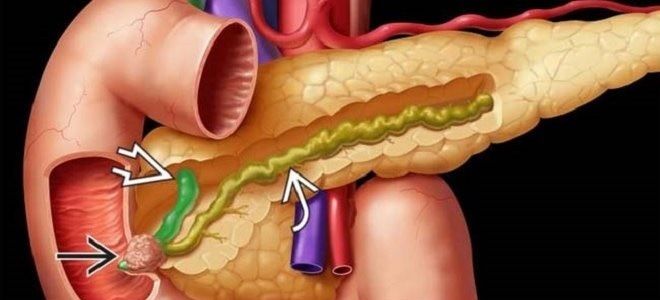
Рак головки поджелудочной железы — это злокачественные заболевания, поражающие различные структурные компоненты органа: протоки, ацинусы, островки Лангерганса. Среди опухолей, развивающихся в ПЖ, рак головки – самый агрессивный и прогностически неблагоприятный. Из-за позднего выявления болезни в 95% случаев радикальное оперативное вмешательство невозможно. Чаще подвержены патологии мужчины (соотношение с женщинами 8:6), средний возраст пациентов – 65 лет.
Локализация раковой опухоли в поджелудочной железе
Код по МКБ 10 — с.25.0. Злокачественная опухоль локализуется в любой части органа. Чаще всего в процесс вовлекается головка: в структуре онкопатологии ПЖ ее поражение составляет 60-65%. Остальные 35-40% приходятся на онкопроцесс:
- в теле — 10%,
- в хвосте — 5-9%,
- на протяжении всей железы (мультицентрическое расположение) — 20%.
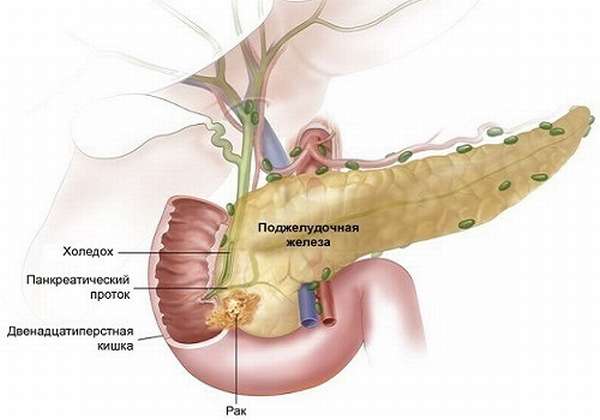
Опухоли головки могут иметь однотипную симптоматику, но исходить при этом из разных анатомических образований:
- фатерова сосочка ДПК или общей ампулы протоков (холедоха и вирсунгова),
- ацинусов,
- протокового эпителия.
Все эти образования объединяются в группу, которая носит общее название – рак головки ПЖ.
Причины появления рака в головке ПЖ
Самое частое образование головки ПЖ – аденокарцинома (более 90% случаев). Считается, что основная причина — мутация гена KRAS 2. Это подтверждается методом ПЦР при пункционной биопсии.
Это самая неблагоприятная онкопатология с учетом поздней диагностики и несвоевременного лечения. Причины не изучены до конца. Но установлены факторы риска, которые провоцируют развитие патологии. К ним относятся:
- Регулярное употребление алкоголя, разрушающего клетки ПЖ.
- Курение: токсины, поступающие с дымом, попадают также в ПЖ. В ее паренхиме и протоках происходят гиперпластические изменения.
- Сахарный диабет — предполагает развитие опухоли в 2 раза чаще.
- Имеющийся хронический панкреатит и холецистит, болезни желчевыводящих путей, в том числе ЖКБ, резекции желудка. Эта патология изначально вызывает изменения в головке ПЖ. При наличии других факторов риска возможно развитие злокачественного образования.
- Неправильное питание — чрезмерное употребление жирной, жареной, копченой еды приводит к высокой функциональной нагрузке на ПЖ. Растительная диета снижает риск развития опухолей.
- Вредные производственные условия (деревообрабатывающее, резиновое).
- Наследственность: наличие у ближайших родственников этой патологии повышают шанс заболевания на 15%.
Существуют косвенные факторы:
- возраст (после 50 лет),
- пол (мужской),
- раса (негроидная).
Во многих случаях рака ПЖ выявить причину не удается.
Симптомы и клиника онкологии головки
В начальных стадиях болезнь протекают бессимптомно, обнаруживается случайно при обследовании по поводу другой патологии. Могут беспокоить:
- дискомфорт в животе,
- ощущение тяжести в правом подреберье, связанное с приемом вредной пищи,
- подташнивание,
- слабость, утомляемость.

Обычно таким жалобам не придается значения, особенно при наличии в анамнезе гастрита, холецистита или панкреатита.
Развернутая симптоматика появляется на этапе, когда прогноз может быть неблагоприятным: степень выраженности жалоб зависит от изменений в железе:
- Интенсивная боль с локализацией в подреберье справа, часто опоясывающего характера – это основное проявление рака головки ПЖ. Она может быть связана с большими размерами опухоли, которая сдавливает ткань и нервные окончания. Усиливается ночью в положении лежа и после вредной еды.
- Тошнота, отвращение к некоторым видам продуктов — характерное проявление неопластического процесса.
- Неустойчивый стул, прогрессирующее снижение массы тела, вплоть до развития кахексии, связаны с функциональной недостаточностью ПЖ, нарушением усвоения белков, жиров и углеводов.
- Снижение работоспособности и постоянная слабость.
- При сдавливании холедоха опухолью развивается механическая желтуха. Она наблюдается у 80% больных: кожа, слизистые, склеры становятся иктеричными, со временем желтушность нарастает. Может проявляться положительный симптом Курвуазье — пальпируется увеличенный безболезненный, наполненный желчью из-за ее нарушенного оттока желчный пузырь. Желчные кислоты в крови вызывают кожный зуд, кал становится ахоличным из-за отсутствия стеркобилина, моча приобретает цвет темного пива из-за наличия уробилина и желчных пигментов.
- Появление асцита связано с метастазированием опухоли в полость брюшины, сдавливанием воротной вены.
- Тромбофлебит без видимых на то причин.
Диагностика опухоли
Для уточнения диагноза используется комплексная диагностика:
- опрос больного с детализацией жалоб,
- выяснение история болезни,
- объективный осмотр,
- лабораторная диагностика,
- функциональные методы исследования.
Топографическое расположение ПЖ не дает возможности ее пропальпировать даже при больших размерах. На ранней стадии низкая выявляемость образования связана и с информативностью КТ, УЗИ и МРТ: она составляет 85% из-за малых размеров опухоли. КТ определяет образование свыше 2 сантиметров.
Точный диагноз не дает даже проведение лапаротомии. Во многих случаях вокруг опухоли образуется воспаление с отеком. Поэтому биопсия поверхностных слоев не является точной.
Лабораторные методы
К лабораторным методам относятся:
- общеклинический анализ крови — определяется лейкоцитоз, лимфоцитоз, анемия, тромбоцитоз, повышенная СОЭ,
- сахар крови,
- биохимические анализы (диастаза, билирубин — общий, прямой, трансаминазы, белок и его фракции, холестерин) – их показатели значительно повышаются,
- кровь на онкомаркеры ПЖ (Са 19-9) — анализ не является строго специфическим, повышенное значение маркера часто бывает при панкреатите,
- анализ кала на стеркобилин — отрицательный при механической желтухе,
- анализ мочи на уробилин и желчные пигменты – положительный,
- копрограмма — кал кашицеобразной консистенции с блестящим блеском, зловонным запахом, непереваренными остатками пищевых волокон и каплями жира.
Инструментальная диагностика
Для выявления рака ПЖ необходима комплексная диагностика, которая включает несколько функциональных методов и проведение биопсии с последующим микроскопическим исследованием тканей. Благодаря биопсии диагноз рака окончательно подтверждается. Но предварительно проводится:
- УЗИ,
- МРТ,
- КТ,
- ЭРХПГ (эндоскопическая ретроградная холангиопанкреатография) проводится в неясных случаях,
- лапароскопия,
- МРПХ (магнитно-резонансная панкреатография).
УЗИ, МРТ и КТ применяются для выявления:
- новообразования,
- его локализации,
- размеров,
- наличия метастазов.
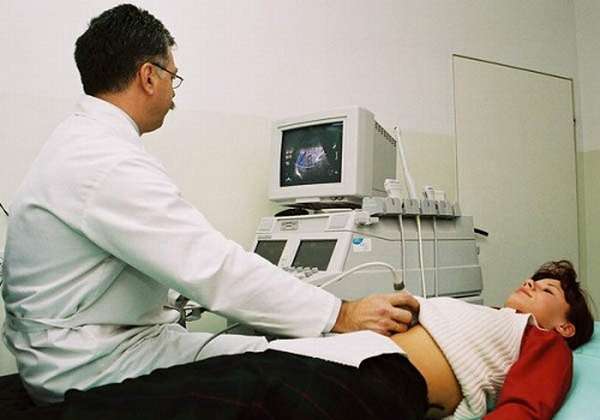
Самым удобным способом исследования является ультразвуковой. С помощью УЗИ обследуют органы брюшной полости и забрюшинного пространства. Это скриннинговый метод, первым назначается при подозрении на заболевание пищеварительных органов, имеет хороший отзыв врачей всех специальностей. Для более точной информации применяется МРТ, при невозможности ее проведения — КТ, но в этом случае на организм действует высокая лучевая нагрузка. МРТ – более безопасный и точный метод, при его использовании визуализируется детально в трехмерном изображении опухоль от 2 см, обнаруживаются метастазы и измененные лимфоузлы.
Инвазивные методы
При неясном диагнозе или для окончательного подтверждения рака ПЖ используются инвазивные методы.
ЭРХПГ и МРПХ удобны для выявления патологии протоков. В процессе проведения этих методов берется материал для биопсии. Методики имеют побочные действия: существует высокая вероятность обсеменения организма раковыми клетками.
ЭРХПГ – инвазивная манипуляция, заключается во введении через специальный эндоскоп катетера с каналом. Через него подается контраст, поступающий в протоки через фатеров сосочек. Делаются рентгеновские снимки, при необходимости берется материал для биопсии.
Лапароскопия также относится к инвазивным методам, поскольку для ее проведения на передней брюшной стенке делается надрез диаметром 0,5-1 см для введения трубки аппарата. С его помощью берут ткань органа, чтобы провести дифференциальный диагноз и диагностировать: доброкачественный процесс или рак вызвал изменения в ПЖ.
Методы лечения рака головки ПЖ на различных стадиях
Лечение при симптомах данного заболевания напрямую зависит от стадии рака.
Применяются:
- хирургические методы,
- лучевая терапия,
- химиотерапия (составляются специальные схемы лечения),
- обезболивающие препараты.
Консервативные методы
В случае неоперабельной опухоли применяется консервативное лечение:
- химиотерапия (вводятся химические вещества),
- адекватное обезболивание,
- радиотерапия.
Все методы назначаются индивидуально в условиях специализированной клиники, оснащенной современным оборудованием. Чтобы сделать правильный выбор лечебного учреждения, необходимо ориентироваться на квалификацию специалистов, укомплектованность медицинским оснащением, название и отзывы.
Иногда рак ПЖ пытаются вылечить различными средствами народной медицины. Одно из них – сода, которую рекомендуют принимать ежедневно натощак по определенной схеме. По утверждению пациентов, при соблюдении всех условий можно вылечить даже четвертую стадию болезни. Но нет статистики и исследований доказательной медицины, которые подтвердили бы эффективность метода.
Хирургия рака головки ПЖ
Выбор тактики лечения зависит от состояния больного и опыта хирурга.
Наиболее эффективное лечение опухоли – ее резекция. Метод применяется на ранних стадиях, на более поздних назначается лучевая и химиотерапия. Но только после хирургического иссечения шансы на выживаемость увеличиваются в течение следующих 5 лет. Без операции срок жизни не превышает полугода.
При первой стадии рака в головке ПЖ размер опухоли не превышает двух сантиметров. В этих случаях проводится панкреатикодуоденэктомия, после чего пациенту назначают 6 курсов химиотерапии с применением Фторурацила или Гемзара.
При второй стадии возможно возникновение метастазов в сосуды, лимфоузлы, окружающие нервы. Для лечения застоя желчи, вызванного сдавливанием холедоха и изменениями в печени, используется эндоскопическое стентирование или оперативное вмешательство.
Если опухоль можно удалить технически, то применяют метод Уиппла: резецируют головку, часть тонкой кишки и желудка, также другие органы, которые поражены метастазами.
Операция сопровождается медикаментозным лечением: проводят химиотерапию или лучевую терапию. Это замедляет развитие рака и повышает шансы на выздоровление.
На 3 или 4 стадии рака головки ПЖ проводится паллиативное вмешательство:
- выполняются обходные анастомозы,
- эндоскопическое или чрескожное стентирование.
При появлении на фоне желтухи рвоты, обусловленной непроходимостью ДПК, выполняются:
- холедохоеюностомия,
- гастроэнтеростомия.
При изолированной обструкции жёлчного протока некоторые авторы рекомендуют во время наложения билиодигестивного анастомоза, а с профилактической целью дополнительно — гастроэнтероанастомоз. Но выбор тактики лечения происходит с учетом:
- размеров образования,
- проходимости ДПК.
Проведение химио- и рентгенотерапии перед оперативным вмешательством иногда дает положительный результат. При неоперабельных опухолях схемы лучевой или химиотерапии неэффективны. Выполнение эндоскопического стентирования успешно в 95% случаев (в 60% с первой попытки). При неудачном лечении выполняется чрескожное или комбинированное стентирование.
Результаты стентирования, летальность, частота осложнений аналогичны результатам паллиативных операций. К осложнениям метода относятся кровотечение и желчеистечение. Эндоскопическое эндопротезирование реже сопровождается осложнениями и смертью больных, чем чрескожное.
Стентирование холедоха, которое проводится без вскрытия брюшной полости, применяется у пожилых с высоким риском (наличие неоперабельной опухоли ПЖ или обширные метастазы). У более молодых прибегают к наложению билиодигестивного анастомоза.
Новые технологии
В медицинских учреждениях, оснащенных современной аппаратурой, применяются для избавления от рака ПЖ современные методики:
- заморозка опухоли,
- удаление пораженного участка при помощи Кибер-ножа,
- воздействие на пораженную ткань микроволнами, лазером,
- радиочастотное лечение.
Диетотерапия при заболевании
Диета при раке ПЖ необходима для уменьшения функциональной нагрузки на железу. Любые погрешности в еде в этот период приводят к ухудшению состояния в связи с повышенной секрецией панкреатического сока. Если опухоль большая и передавливает вирсунгов проток, ферменты попадают в ткань железы, где активируются, начинается процесс самопереваривания, возникают признаки воспаления. Это значительно утяжеляет состояние пациента и может служить толчком к дальнейшему росту опухоли.

Правила диетического питания зависят от стадии рака, но в целом ограничиваются столом № 5 по Певзнеру. Общие принципы:
- Исключается жирная, острая, жареная, копченая пища.
- Разрешается отварная, паровая, тушеная еда, измельченная до кашицеобразной консистенции.
- Частый прием маленькими порциями.
- Комфортная температура — слишком холодная или горячая недопустима.
Прогноз благоприятного исхода и возможный срок жизни
Сколько будет жить пациент с раком головки ПЖ, зависит от сроков проведения диагностики и от того, какой лечебный метод или средство использовалось. Быстрое прогрессирование и метастазирование новообразования приводит к тому, что после верификации диагноза в течение пяти лет живет небольшое количество пациентов, и 99% из них погибают в короткие сроки. Большая продолжительность жизни отмечается только в случаях, когда опухоль выявлена на ранних стадиях, и можно подобрать эффективный вариант лечения, чтобы предупредить развитие метастазов.
Прогноз на излечение условно неблагоприятный. Операционная летальность составляет 15%, после хирургического вмешательства выживаемость пациентов составляет 10%.
При развитии метастазов полное удаление опухоли невозможно, состояние пациента всегда вызывает рецидив заболевания.
После оперативного лечения пациенты проживают в 3-4 раза дольше людей, которым операцию не делали.
После полного курса терапии средняя 5-летняя выживаемость больных составляет около 9%.
Профилактика онкологии поджелудочной железы
Профилактика ракового заболевания любого органа пищеварительной системы — здоровый образ жизни и питание. Отказ от вредных привычек и неправильной еды, которые вызывают панкреатит и сахарный диабет (основные факторы риска рака ПЖ) — главный метод предупреждения болезни. Особенно это касается людей, у которых в семейном анамнезе были такие заболевания у близких родственников.

Важно при появлении клинических симптомов, которых раньше не было, не заниматься самолечением или полагаться на народный метод, который излечивает все, а сразу обращаться к врачу. Только таким образом возможна своевременная диагностика заболевания и адекватное лечение. Это поможет избежать распространения болезни и перехода ее в конечные стадии, когда даже самые современные способы не смогут восстановить утраченные органы и надолго продлить жизнь.
Играет роль неблагоприятная экология, малоактивный образ жизни, острые и хронические стрессы, недостаточный отдых. Во избежание тяжелой патологии ПЖ необходимо исключить все эти факторы.
Рекомендованные клиники в России и за рубежом
Согласно опубликованным данным Американского журнала Lancet Oncology о состоянии онкологии в России, Китае и Индии в сравнении с Европой и США, летальность от рака в России составляет 15% от всех случаев смерти людей.
Это связано с поздней диагностикой по разным причинам, включая ограниченный доступ к качественной медицинской помощи людей, живущих вдали от крупных центров. Крупные онкоцентры сконцентрированы в Москве и Санкт-Петербурге, но там проживает лишь 12% населения. Помимо этого, не везде есть современное оборудование и специалисты с соответствующей квалификацией.
Ассута (Тель-Авив)— сеть клиник в Израиле, занимается лечением рака ПЖ. Функционирует уже более 80 лет, включает два диагностических центра (Ашдод и Ранаан), центральный госпиталь в столице Израиля.

В Москве – Лечебно-диагностический Центр (ЛДЦ) Патеро Клиник использует ультрасовременные медицинские технологии и ориентируется на европейские стандарты качества лечения. Получила лучший отзыв пациентов с раком ПЖ.
В связи с невиданным ростом смертности от этого заболевания, в последние годы необходимо бережно относиться к своему организму и не допускать развития тяжелых стадий патологии, своевременно обращаясь за медицинской помощью.
Список литературы
- Восканян С.Э., Оноприев В.И., Буклов А.В., Артемьев А.И. Современные подходы хирургического лечения локализованного рака головки поджелудочной железы. Вестник хирургической гастроэнтерологии 2007 г. №3 стр. 102.
- Земляной А.Г. Диагностика и лечение рака поджелудочной железы. Вестник хирургии им. И.И.Грекова 1987 г. №8 стр. 33–40.
- Боженков, Ю. Г. Практическая панкреатология. Руководство для врачей М. Мед. книга Н. Новгород Изд-во НГМА, 2003 г.
- Говард Дж.M. (Howard J.M.) Рак поджелудочной железы — прогностическая оценка СА 19-9. Хирургия хронического панкреатита и опухолей поджелудочной железы: тезисы доклада на международной конференции М., 1993 г. стр. 70.
- Патютко Ю.И., Котельников А.Г. Рак поджелудочной железы: диагностика и хирургическое лечение на современном этапе. Анналы хирургической гепатологии. 1998 г, том 3, №1, стр. 96–111.
- Кубышкин В.А., Вишневский В.А. Рак поджелудочной железы. М., 2003 г.
Источник
Рак поджелудочной железы (ПЖ) имеет наихудший прогноз среди всех злокачественных опухолей органов пищеварения. Опухоль распространяется на общий желчный проток, двенадцатиперстную кишку, паравазальные соединительные структуры, нервные волокна, лимфатические сосуды и лимфатические узлы вокруг общей печеночной артерии, верхних брыжеечных сосудов, чревного ствола, селезеночных сосудов. Периневральная внеорганная инвазия обнаруживается у 81-100% больных протоковым раком ПЖ [1, 4, 10, 13]. Хирургическое удаление опухоли продолжает оставаться единственным методом радикального лечения больных раком поджелудочной железы, которое позволяет получать обнадеживающие результаты. В свою очередь полнота хирургической резекции (R0/R1/R2) зависит от точности предоперационного и интраоперационного выявления опухоли [5, 6, 8, 12]. Тяжелый прогноз рака ПЖ ставит проблему своевременной диагностики в ряд наиболее актуальных. КТ признана «золотым стандартом» в диагностике рака ПЖ [2, 3, 9, 14].
Несмотря на большой прогресс в разработке новых методов обследования, только около 50% неоперабельных опухолей ПЖ диагностируются до операции и около 10% опухолей ложно диагностируются как нерезектабельные [4, 5, 11]. У 21-55% больных на дооперационном этапе при КТ ошибочно диагностируют опухоль ПЖ как резектабельную, только чтобы интраоперационно убедиться в обратном. Наиболее частой причиной ошибки является вовлечение магистральных сосудов, канцероматоз или метастазы в печень маленького размера (<15 мм) [3, 13]. Чтобы избежать диагностических ошибок при оценке сосудистой инвазии и повысить точность определения резектабельности и нерезектабельности опухоли, необходимо четкое представление о КТ-критериях вовлечения хирургически значимых сосудов панкреатогепатобилиарной области [14].
Цель настоящего исследования — изучить возможности КТ с болюсным контрастным усилением при обследовании больных раком ПЖ и при оценке резектабельности опухоли на дооперационном этапе лечения.
За период с января 2004 по май 2011 г. в Институте хирургии им. А.В. Вишневского обследованы 174 человека с объемными образованиями ПЖ, требующими проведения комплексной диагностики (67 женщин, средний возраст 58±0,9 года и 107 мужчин, средний возраст 59±1,1 года).
У всех пациентов на дооперационном этапе было выполнено КТ-исследование органов брюшной полости (СКТ, МСКТ) с болюсным контрастным усилением, также были проанализированы дополнительные методы обследования: МРТ, УЗИ в В-режиме, дуплексное сканирование в режиме цветового допплеровского картирования, эндо-УЗИ, онкомаркеры, протоколы операций и результаты гистологического исследования.
Прямым КТ-признаком рака ПЖ являлось обнаружение гиподенсного по отношению к окружающей паренхиме очага (не менее чем на 10 ед. Н), чаще с нечеткими неровными контурами.
Непрямые КТ-признаки рака ПЖ: локальное увеличение размеров, панкреатическая и билиарная гипертензия с блоком на уровне образования, причем для рака ПЖ более характерен сигарообразный обрыв общего желчного протока, в то время как его обрыв по типу писчего пера определялся при опухоли терминального отдела общего желчного протока. Также оценивали локальную инвазию опухоли в смежные органы и/или парапанкреатические сосуды, увеличение регионарных лимфатических узлов, метастатическое поражение печени, асцит.
Для объективизации диагностических возможностей КТ понятия «резектабельность» и «операбельность» мы рассматривали отдельно. Другими словами, мы раздельно оценивали способность метода в выявлении сосудистой инвазии и определении отдаленных метастазов. В большинстве работ, посвященных данной теме, преимущественно рассчитывается усредненная точность метода в стадировании рака ПЖ, которая не дает четких представлений об истинных преимуществах и ограничениях КТ.
В нашем исследовании опухоль считалась резектабельной при отсутствии распространения на верхнюю брыжеечную артерию, чревный ствол и общую печеночную артерию.
Если имелись отдаленные метастазы (в том числе в отдаленные лимфатические узлы), инфильтративное поражение ретроперитонеальных тканей и органов, в том числе корня брыжейки толстой и тонкой кишки или брюшной аорты, ситуация расценивалась как неоперабельная.
Для компьютерно-томографической оценки распространенности опухоли на магистральные сосуды мы использовали следующую градацию:
— тип 0 — между опухолью и стенкой сосуда прослеживается сохранная жировая прослойка или неизмененная паренхима поджелудочной железы (рис. 1); Рисунок 1. Рак головки ПЖ (а, б). Тип 0. Между опухолью и стенкой сосуда прослеживается сохранная жировая прослойка или неизмененная паренхима поджелудочной железы.
Рисунок 1. Рак головки ПЖ (а, б). Тип 0. Между опухолью и стенкой сосуда прослеживается сохранная жировая прослойка или неизмененная паренхима поджелудочной железы.
— тип 1 — тесный контакт опухоли и стенки сосуда, жировая прослойка прослеживается фрагментарно (рис. 2); Рисунок 2. Рак головки ПЖ (а, б). Тип 1. Тесный контакт опухоли и стенки сосуда, жировая прослойка прослеживается фрагментарно.
Рисунок 2. Рак головки ПЖ (а, б). Тип 1. Тесный контакт опухоли и стенки сосуда, жировая прослойка прослеживается фрагментарно.
— тип 2 — жировая прослойка между стенкой сосуда и опухолью не прослеживается, сосуд инфильтрирован (рис. 3); Рисунок 3. Рак головки ПЖ (а, б). Тип 2. Жировая прослойка между стенкой сосуда и опухолью не прослеживается, сосуд инфильтрирован.
Рисунок 3. Рак головки ПЖ (а, б). Тип 2. Жировая прослойка между стенкой сосуда и опухолью не прослеживается, сосуд инфильтрирован.
— тип 3 — сосуд деформирован, просвет сужен (рис. 4); Рисунок 4. Рак головки ПЖ. Тип 3. а — каплевидная деформация ВБВ; б — сосуд деформирован, просвет сужен.
Рисунок 4. Рак головки ПЖ. Тип 3. а — каплевидная деформация ВБВ; б — сосуд деформирован, просвет сужен.
— тип 4 — опухоль прилежит к сосуду, охватывая <50% окружности сосуда (рис. 5); Рисунок 5. Рак головки ПЖ (а, б). Тип 4. Опухоль прилежит к сосуду, охватывая <50% окружности ВБА.
Рисунок 5. Рак головки ПЖ (а, б). Тип 4. Опухоль прилежит к сосуду, охватывая <50% окружности ВБА.
— тип 5 — опухоль прилежит к сосуду, охватывая >50% окружности сосуда, просвет сосуда не дифференцируется, расположен в структуре опухоли (рис. 6). Рисунок 6. Рак головки ПЖ (а, б). Тип 5. Опухоль прилежит к сосуду, охватывая >50% окружности сосуда, просвет сосуда не дифференцируется, расположен в структуре опухоли.
Рисунок 6. Рак головки ПЖ (а, б). Тип 5. Опухоль прилежит к сосуду, охватывая >50% окружности сосуда, просвет сосуда не дифференцируется, расположен в структуре опухоли.
С целью объективизации факторов, определяющих резектабельность, в нашем исследовании больные были разделены на 2 группы в зависимости от вида проведенного оперативного вмешательства. В 1-ю группу вошли 93 (53,4%) больных раком ПЖ (58 мужчин и 35 женщин, средний возраст 57,5±0,9 года) с резектабельными опухолями, которым произведена радикальная операция. 2-ю группу составил 81 (46,6%) пациент с нерезектабельным раком поджелудочной железы (49 мужчин и 32 женщины, средний возраст 60,4±1,1 года), в том числе пациенты, которым выполнены различные виды паллиативных хирургических вмешательств (включая больных, которым на дооперационном этапе планировалась операция, а во время операционной ревизии радикальное вмешательство оказалось невозможным из-за местного распространения опухоли и отдаленного метастазирования).
Мы проанализировали две группы по 11 КТ-признакам и сравнили с интраоперационными находками и результатами патоморфологического исследования.
Пользуясь описанной выше градацией контакта опухоль-сосуд (тип 0 — тип 5), у каждого больного в нашей работе (n=174) мы исследовали 8 хирургически значимых сосудов (воротную вену, селезеночную вену, верхнюю брыжеечную вену, верхнюю брыжеечную артерию, чревный ствол, общую печеночную артерию, селезеночную артерию и нижнюю полую вену), всего 1392 сосуда и сравнили данные с интраоперационными протоколами и результатами патоморфологического исследования.
В 1-й и 2-й группах исследовались онкомаркеры крови: в группе больных с резектабельными опухолями средний уровень карбоангидратного антигена 19-9 составил 657,4±279,2 ед/мл (норма 0-37 ед/мл), в группе с нерезектабельным раком — 2728,2±2212,8 ед/мл, что достоверно выше, чем в 1-й группе. Средний уровень канцероэмбрионального антигена в 1-й группе составил 6,38±1,91 нг/мл (норма 0-3 нг/мл), в группе больных с нерезектабельным раком — 24,1±15,7 нг/мл (статистически значимые различия по сравнению с 1-й группой; p<0,05).
Средний размер удаленных опухолей в 1-й группе был достоверно меньше, чем во 2-й, и составил 43,2±2,3 мм (диапазон от 15 до 100 мм), во 2-й группе — 59,6±2,8 мм (диапазон от 20 до 100 мм). В обеих группах размеры опухолей, измеренные при КТ (МСКТ)-исследовании, были значительно ниже истинных (со статистически значимым различием по сравнению с размерами, указанными в протоколах операции и патоморфологического исследования; р<0,05). В 1-й группе размер опухоли, указанный в протоколах исследования, составил 29,2±1,3 мм (диапазон от 11 до 66 мм), во 2-й — 38,1±2,0 мм (диапазон от 14 до 85 мм). Размеры опухоли, измеренные по данным КТ, совпали с истинными в 24% наблюдений, превосходили их в 1% и были недооценены в 75%.
Выявлена умеренная прямая зависимость (r=0,316) размера опухоли от степени ее дифференцировки. Подобные данные получены и в других исследованиях [1, 8].
На основании протоколов исследования мы сравнили точность всех методов инструментальной диагностики в определении размеров первичной опухоли. Хирургам и онкологам следует иметь в виду, что все методы инструментального обследования (КТ, МРТ, УЗИ, эндо-УЗИ) имеют тенденцию к занижению размеров опухоли при дооперационном стадировании больных раком ПЖ. Это может существенно влиять на объем операции и послеоперационную выживаемость, а также имеет важные последствия для неоадъювантной терапии, при планировании которой необходимо соответствующим образом расширять зону воздействия.
При нерезектабельном раке (2-й группа) опухоль достоверно чаще визуализировалась при нативном исследовании (92,6%). При внутривенном контрастировании в обеих группах аденокарциномы ПЖ в большинстве наблюдений были видны как очаги пониженной плотности («гиподенсные» образования), располагающиеся на фоне накапливающей контрастное вещество неизмененной паренхимы органа. Лишь в одном наблюдении аденокарцинома головки ПЖ выявлялась как очаг повышенного накопления контрастного вещества («гиперденсная» зона) с нечеткими контурами. При оценке денситометрических показателей в 1-й группе отмечено более интенсивное накопление контрастного средства опухолью во все фазы контрастного усиления (статистически значимые различия по сравнению со 2-й группой).
Признаки панкреатической и билиарной гипертензии встречались с приблизительно равной частотой в обеих группах. В 1-й группе достоверно чаще выявлялась неизмененная парапанкреатическая клетчатка (61,3%), в то время как в группе с нерезектабельными опухолями инфильтрация клетчатки выявлена почти у половины больных (45,7%). Также в группе больных с нерезектабельными опухолями достоверно чаще определялись увеличенные лимфатические узлы (38,3%), метастазы в печень (42%) и инвазия в смежные органы (42%).
По всем этим признакам можно говорить о наличии опухоли ПЖ и о ее операбельности, но нельзя судить о резектабельности рака. В группе больных с нерезектабельными опухолями достоверно чаще определялся тип 5 контакта опухоль-сосуд (у 30% больных хирургически значимые сосуды были охвачены опухолью более чем на >50% своей окружности). В группе с резектабельным раком наиболее часто определялся тесный контакт опухоли и стенки сосуда (тип 1 — жировая прослойка дифференцировалась фрагментарно) — 13 (14%) больных.
Для оптимизации протокола КТ-исследования больных раком ПЖ и достоверности нашего анализа все протоколы исследования были проанализированы «двойным слепым» методом двумя рентгенологами (первый — врач отделения лучевой диагностики, м.н.с. с опытом работы 4 года, второй — врач отделения лучевой диагностики, профессор с опытом работы 27 лет). На основании описания в протоколе каждый врач-рентгенолог независимо друг от друга давал свое заключение о наличии/отсутствии опухоли ПЖ, о резектабельности и операбельности опухолевого процесса. Полученные результаты сравнивали с интраоперационными данными и протоколами патоморфологического исследования. Все случаи расхождения диагноза (между рентгенологом 1 и рентгенологом 2), особенно в группе с «погранично-резектабельным» раком, были проанализированы отдельно для выявления недостатков стандартного протокола обследования и определения причины ошибочного дооперационного стадирования.
При анализе 174 протоколов КТ-исследования двумя рентгенологами отдельно друг от друга совпадение диагнозов получено только в 155 (89%) случаях из 174 (табл. 1). Таким образом, в 19 случаях, просматривая одни и те же протоколы исследования, врачи дали различные заключения о резектабельности и операбельности опухоли.
Таким образом, в 19 случаях, просматривая одни и те же протоколы исследования, врачи дали различные заключения о резектабельности и операбельности опухоли.
При анализе КТ-протоколов и заключений мы столкнулись со следующими проблемами.
1. Неинформативный протокол: «опухоль распространяется на окружающие структуры…», «образование контактирует с магистральными сосудами…», «опухоль прилежит к верхней брыжеечной артерии…».
На основании такого описания практически невозможно достоверно оценить реальную распространенность опухолевого процесса, предположить степень инвазии в сосуд или судить о резектабельности рака без повторного просмотра изображений. Если пациент пришел амбулаторно, то для адекватного стадирования опухоли и для планирования тактики ведения больного назначается повторное исследование, поэтому диагностический процесс удлиняется, а пациент получает лишнюю лучевую нагрузку.
В связи с этим мы считаем важным введение единой системы описания протокола МСКТ-исследования у пациентов с подозрением на рак ПЖ. В протоколе необходимо детально описывать соотношение опухоли и сосуда с указанием степени контакта (в градусах, процентах окружности и т.д.), с измерением протяженности поражения сосуда, а также характеристикой контура сосуда, ширины просвета и наличия контрастирования сосуда при контрастном усилении.
2. Неинформативное заключение: «образование поджелудочной железы…», «изменения поджелудочной железы…», «нельзя исключить наличие опухоли…».
При отсутствии детального описания патологических изменений в протоколе и возможности просмотра изображений самого исследования практически невозможно определить, какое заболевание подразумевал врач, делавший описание. Безусловно, бывают ситуации, в которых тяжело достоверно дифференцировать рак ПЖ от хронического панкреатита или иного заболевания. Мы считаем что предпочтительнее постановка более конкретного диагноза в заключении с описанием наиболее вероятного морфологического типа опухоли (возможно с наличием дифференциального ряда, но с понятной последовательностью предполагаемых диагнозов, а главное, с оценкой вероятной злокачественности патологического процесса). Это также внесет ощутимый вклад в научные исследования: при определении точности, чувствительности и специфичности метода, при сравнении этих показателей с другими методами визуализации и для проведения межцентровых исследований.
Согласно данным зарубежных авторов, КТ-признаки инвазии артерий и вен различаются. Для повышения точности диагностики сосудистой инфильтрации и правильной оценки резектабельности опухоли очень важно обращать внимание на эти различия и уметь правильно интерпретировать данные КТ [8, 9]. Главная причина различия КТ-признаков сосудистой инвазии артерий и вен заключается в том, что стенки вен тоньше и податливее стенок артерий. Когда опухоль окружает вену, ее стенки становятся неровными и калибр вены сужается. Скорость тока крови по венам низкая, опухоль зачастую пенетрирует стенку, обусловливая венозный тромбоз, следствием которого является окклюзия вены. У артериальных сосудов, наоборот, стенки толще и более упругие, калибр артерий меньше, поэтому, даже когда артерии располагаются в структуре опухоли, калибр их зачастую не меняется и при контрастном усилении просвет сосудов остается равномерным.
Таким образом, к критериям инвазии артерии относится окружение сосуда опухолью более чем на 50% его диаметра (тип 5) в сочетании с неровностью стенки или уменьшением калибра артерии [11, 14]. Чувствительность и специфичность данных критериев — соответственно 79 и 99%, что выше, чем в нашем исследовании, в котором критерии инвазии были одинаковыми как для вен, так и для артерий.
Средняя точность КТ в определении распространения опухоли на магистральные сосуды равна 87,8% (по данным литературы, от 70 до 95%) [2, 7, 11]. В целом при оценке инвазии артериального русла КТ показала большую точность (91,2%) и специфичность (96,5%) по сравнению с поражениями венозного русла — соответс?


