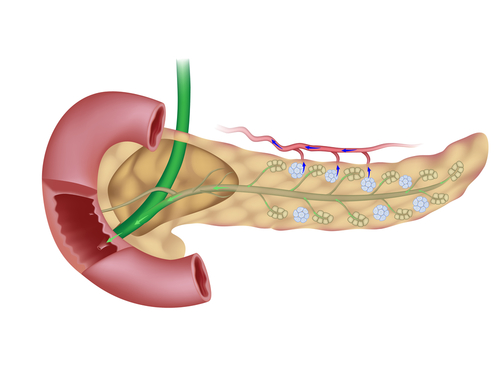
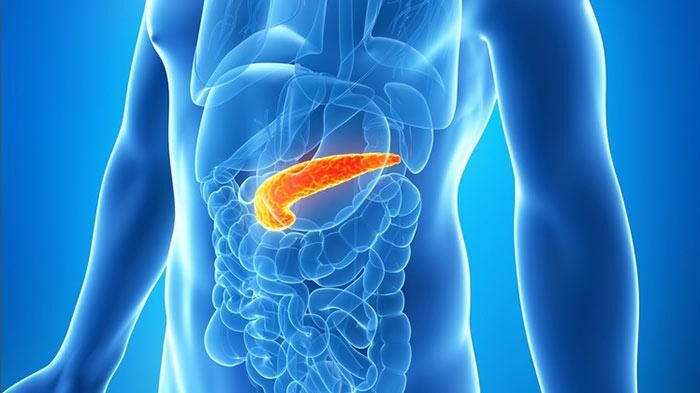
О последних исследованиях поджелудочной железы
19 мая 2014 года в журнале Американской ассоциации по исследованию рака (AACR) размещены данные, полученные в ходе последних исследований, которые указывают на то, что рак поджелудочной железы до 2030 года в США выдвинется на второе место по смертности. Тем же исследованием предполагается выдвижение на третье место рака печени.
Очевидно, что эти тенденции будут касаться не только США. Учитывая, что и поджелудочная железа и печень задействованы в процессе переваривания пищи, можно сделать предположение, что качество современного питания человека примерно одинаково во всех странах мира и характеризуется трендом к химизации, что самым непосредственным образом отражается в первую очередь именно на поджелудочной железе и печени. Так что в выявленных тенденциях ничего удивительного нет. Исследования только подтвердили догадки. Вот что сообщают исследователи.
Изначально исследования были направлены на то, чтобы обосновать факт того, что рак молочной железы, предстательной железы и рак легких будут оставаться в тройке основных диагнозов рака в 2030 году. Однако в поле зрения исследователей попал рак поджелудочной железы. В докладе по этому поводу говорится, что, несмотря на то, что рак легких по-прежнему будет самым смертоносным среди смертей от рака, однако количество смертей, связанных с раком поджелудочной железы и печени, как ожидается, превысит количество смертей, связанных с раком молочной железы, предстательной железы и колоректального рака.
В настоящее время рак молочной железы является второй по значимости причиной онкологической смертности у женщин, рак предстательной железы занимает второе место среди мужчин, и рак толстой кишки занимает третье место у мужчин и женщин. Исследования по раку легких, раку молочной железы, предстательной железы и колоректального рака получают в настоящее время наибольшее финансирование.
Линн Матрисиан (Lynn Matrisian), ведущий автор и вице-президент по научно-медицинским вопросам в центре исследований рака поджелудочной железы, говорит, что в то время как общая смертность от рака снижается, но это не касается смертности от рака поджелудочной железы и рака печени. Она говорит, что инвестиции в фундаментальные и клинические исследования помогли переломить ситуацию с другими видами рака и то же самое должно быть сделано для рака поджелудочной железы и печени. Только 6 процентов больных раком поджелудочной железы имеют выживаемость пять лет после постановки диагноза.

Линн Матрисиан (справа) в лаборатории
“Это исследование является призывом к действию для научных и клинических сообществ, а также населения в целом, чтобы повысить внимание, понимание и, в конечном счете, получить прогресс в борьбе с раком поджелудочной железы”, говорит Матрисиан.
Исследователи подсчитали, что заболеваемость раком и смертность, принимая во внимание изменения в демографии, вызванные увеличением старения бэби-бумеров и национальных меньшинств, несут большие риски. Например, говорит Матрисиан, афро-американцы имеют более высокую заболеваемость раком поджелудочной железы, чем кавказцы. Она говорит, что ожирение и диабет могут способствовать незначительному увеличению заболеваемости.
Результаты исследований были сообщены на специальной конференции в отделении AACR по проблемам поджелудочной железы 18-21 мая 2014 года в Новом Орлеане. На конференции были рассмотрены следующие новости онкологии.
Комплекс биомаркеров может позволить диагностировать рак на ранней стадии
Была представлена группа из четырех биомаркеров крови, содержащая известный биомаркер рака поджелудочной железы CA 19-9 и три новых биомаркеры. В качестве участников эксперимента были уважаемые люди, которые имели рак поджелудочной железы, те, кто были здоровы и те, кто имел хронический панкреатит или кисту поджелудочной железы около 90 процентов времени.

Ауму Тагучи
Ауму Тагучи (Ayumu Taguchi), доцент Университета Техаса Anderson Cancer Center в Хьюстоне, говорит, что группа биомаркеров была намного информативней при диагностировании пациентов с раком поджелудочной железы, чем СА 19-9 в одиночку.
“Это означает, что выявленная группа биомаркеров имеет высокий потенциал, чтобы существенно уменьшить количество пациентов, которые должны были бы пройти чрезвычайно инвазивные процедуры скрининга”, говорит он.
Тагучи говорит, что лишь около 10 процентов людей, которые имеют рак поджелудочной железы могут быть диагностированы, когда болезнь локализована, и эта ситуация при наличии группы биомаркеров может улучшить результаты. Нет, стандарт скрининг-теста пока еще не определен.
Тесты для людей с высоким риском включает эндоскопическое ультразвуковое исследование и компьютерное аксиальное сканирование (томографию). Должно быть сделано еще больше исследований, говорит Тагучи: “Мы надеемся, что мы сможем определить комплекс биомаркеров, который будет иметь клиническое применение”.
Сочетание радиоиммунотерапии и Гемцитабина обещает успех в лечении рака
Сопряжение радиоиммунотерапии с химиотерапией гемцитабином может продлить жизнь больных раком поджелудочной железы с метастазами в протоки, в соответствии с первыми результатами клинических исследований, представленных на конференции.
Методы лечения радиоиммунотерапии, которые включают радиоактивные вещества, связанны с моноклональным антителом, предназначенным белкам раковых клеток, называемым антигены. Таким образом, моноклональное антитело обеспечивает доставку радиоактивного вещества к раковым клеткам, которые затем разрушаются.

Винсент Дж. Пиккози
Винсент Дж. Пиккози младший (Vincent J. Picozzi Jr.), директор Центра исследований заболеваний поджелудочной железы в Вирджинии, говорит, что в то время как лучевая терапия является эффективным средством против большинства видов рака, в том числе рака поджелудочной железы, антитела могут распознавать цель на большинстве раковых клеток поджелудочной железы и нести радиоактивный источник, который имеет потенциал, чтобы убить раковые клетки по всему телу, в отличие от лучевой терапии, которая ориентирована на определенную область тела.
В фазовом Ib клиническом испытании, исследователи использовали несколько небольших доз радиоиммунотерапии 90Y-clivatuzumab tetraxetan вместе с низкой дозой гемцитабина. Они разделили 58 пациентов на две группы. Группа А получила радиоиммунотерапию и химиотерапию, а группа В получала только радиоиммунотерапию. Пациенты из группы А получили на 45% больший срок выживаемости, чем больные, получавшие только радиоиммунотерапию. Общая выживаемость для пациентов, которые завершили несколько циклов лечения составила 7,9 месяцев для группы А и 3,4 месяца для группы В.
Побочные эффекты были минимальными, но у некоторых пациентов наблюдалось ухудшение показателей крови. В настоящее время третья стадия испытаний в стадии реализации.
Новая потенциальная терапия для лечения рака поджелудочной железы
Блокирование белка CD47 вызвало регрессию нейроэндокринных опухолей поджелудочной железы и аденокарциномы протока поджелудочной железы у мышей, по данным исследования, результаты которого были представлены на конференции. Повышенные уровни CD47 были обнаружены в случае обоих вариантов рака.
В одной модели, в которой мышам трансплантировали опухоли от пациентов с нейроэндокринными опухолями поджелудочной железы или аденокарциномы поджелудочных протоков, лечение с моноклональным антителом (Hu5F9), которое распознает раковые клетки и блокирует функцию CD47, вызвало резкую регрессию опухоли.
“Мы надеемся, что нацеливаясь на CD47 таким образом, можно обеспечить новый подход для лечения пациентов с раком поджелудочной железы, которые имеют отчаянную необходимость совершенствования методов лечения”, говорит Джеффри У. Крампитц (Geoffrey W. Krampitz), директор Института биологии стволовых клеток и регенеративной медицины Стэнфордского университета в Калифорнии. Крампитц говорит, что исследователи надеются начать клинические испытания в течение года.
Источник
Рак поджелудочной железы на сегодняшний день остается одним из самых агрессивных видов рака и характеризуется низкой выживаемостью пациентов, поэтому международные исследования в большинстве своем направлены на поиск методов ранней диагностики заболевания и эффективной химиотерапии для улучшения показателей выживаемости.
Комбинация из двух химиотерапевтических препаратов существенно улучшает прогноз
Хирургический метод лечения рака поджелудочной железы имеет позитивный прогноз в 8% случаев. У остальных 92% пациентов данный вид рака выявляется на поздних стадиях, когда хирургический метод лечения нецелесообразен.
В исследовании ESPAC-4, проведенном Европейской исследовательской группой по раку поджелудочной железы, участвовали 732 пациента из 92 больниц в Англии, Шотландии, Уэльсе, Германии, Франции и Швеции. В течение 12 недель после операции 732 пациента (57% мужчин, средний возраст 65 лет) были рандомизированы в соотношении 1:1 для получения 6 циклов гемцитабина 1000 мг/м2 1 раз в неделю на протяжении 3 недель с последующим перерывом в 7 дней (n=366) или 6 циклов гемцитабина в сочетании с пероральным капецитабином в дозе 1660 мг/м2 на протяжении 21 дня с последующим 7-дневным перерывом (n=364).
Основной конечной точкой служила общая выживаемость. Средний период наблюдения составил 43,2 мес. Группа, получавшая комбинированную терапию, продемонстрировала лучшие, по сравнению с группой гемцитабина, показатели общей выживаемости через 12 мес (84,1 против 80,5% соответственно) и 24 мес (53,8 против 52,1%).
Одновременный прием двух препаратов позволяет продлить общую выживаемость в среднем от 25,5 мес на фоне монотерапии гемцитабином до 28 мес. Клиническое испытание показало, что 29% пациентов, получавших в ходе химиотерапии комбинированное лечение, жили по меньшей мере 5 лет, по сравнению с 16% больных, которые получали терапию одним химиопрепаратом.
Монотерапия по-прежнему является стандартом лечения в странах Европы. Результаты данного исследования чрезвычайно важны, так как улучшают перспективы для людей с раком поджелудочной железы [1].
Новый взгляд на нейроэндокринные опухоли поджелудочной железы
Недавние открытия в области генетики опухолей предоставляют ряд возможностей для выявления пациентов, подверженных риску развития нейроэндокринного рака поджелудочной железы. Исследование проводилось в рамках Австралийской инициативы рака поджелудочной железы (APCGI) посредством секвенирования генома опухолей у 100 австралийских пациентов.
Из всех случаев рака поджелудочной железы, ежегодно диагностируемых в мире, панкреатические нейроэндокринные опухоли составляют всего 2%. И хотя пациенты с такими опухолями часто имеют лучший прогноз, чем те, у которых диагностированы другие формы рака поджелудочной железы, данная группа опухолей характеризуется высокой нестабильностью, а также возможностью как медленного роста и хорошего ответа на терапию, так и быстрого метастазирования и резистентности к лечению. В результате проведенных APCGI исследований у каждого пятого пациента с нейроэндокринными опухолями была выявлена генетическая предрасположенность к развитию рака, при этом наследственность не была отягощена онкологическими заболеваниями.
Клинически спорадические нейроэндокринные опухоли содержат более крупную, чем ожидалось, долю зародышевых мутаций, включая ранее не зарегистрированные мутации в генах репарации ДНК MUTYH, CHEK2 и BRCA2, которые известны как предрасполагающие к развитию рака молочной железы и редких форм рака толстой кишки. Наряду с мутациями в MEN1 и VHL эти мутации происходят у 17% пациентов. Опухоли, несущие мутации DAXX или ATRX, были связаны с плохим прогнозом у пациентов. Таким образом, используя своеобразную метку для распознавания предрасположенности к развитию раковой опухоли, можно будет заранее определять группы пациентов, нуждающихся в ранней агрессивной терапии.
Исследование, проведенное APCGI, внесло новый вклад в работу Международного консорциума генома рака (ICGC), в частности в формирование атласа по каждому типу рака с указанием всех мутаций, которые приводят к развитию рака у сотен тысяч пациентов [2].
Гены, определяющие выживаемость пациентов с раком поджелудочной железы
Последние исследования, проведенные Университетом Нового Южного Уэльса (Австралия), Институтом Гарвана (Австралия), Институтом здоровья и медицинских исследований Иллаварры при Университете Вуллонгонга (Австралия) и Университетом Глазго (Великобритания), показали, что экспрессия гена SerpinB2, особенно в стромальной части поджелудочной железы, связана с уменьшением метастазирования и продолжительной выживаемостью при аденокарциноме. SerpinB2 необходим для нормального ремоделирования коллагена стромальными клетками, поскольку регулирует взаимодействие фибробластов между собой и их связывание с коллагеном для образования внеклеточно- го матрикса. В модели аллотрансплантата рака поджелудочной железы совместная инъекция раковых клеток PDAC и эмбриональных фибробластов мыши привела к увеличению роста опухоли, аберрантному ремоделированию внеклеточного матрикса и увеличению локальной инвазии из первичной опухоли, что подтверждает способность опухолевых клеток к делеции гена SerpinB2. Эти опухоли также демонстрируют повышенную протеолитическую активность первичной биохимической мишени SerpinB2 – активатора плазминогена урокиназы (uPA), экспрессия которого в норме ингибируется этим геном. В большой когорте пациентов, которым была проведена резекция панкреатической аденокарциномы, увеличение экспрессии матричной рибонуклеиновой кислоты uPA было тесно связано с более низкой выживаемостью после панкреатэктомии.
Таким образом, можно будет прогнозировать выживаемость в зависимости от конкретного генетического профиля. Это исследование устанавливает новую роль SerpinB2 в строме при инвазии PDAC посредством регуляции стромального ремоделирования и открывает новые возможности для дальнейшего исследования взаимозависимости SerpinB2 и uPA в качестве потенциальной терапевтической цели при раке поджелудочной железы [3].
Спектроскопия для ранней диагностики рака
Новый оптический спектроскоп способен обнаруживать структурные изменения, происходящие в предраковых и раковых поражениях поджелудочной железы, с помощью высокоточного минимально инвазивного метода. Обычно показатели выживаемости пациентов с раком поджелудочной железы очень низки из-за отсутствия диагностических средств, которые могут обнаружить болезнь на ранних стадиях.
Используя спектроскопию, израильские ученые под руководством доктора философии Льва Перельмана проанализировали отраженный спектр и пришли к выводу, что почти в 20% случаев рак поджелудочной железы развивается из кист, но не все поражения злокачественны. Хотя технологии визуализации, такие как компьютерная и магнитно-резонансная томография, все чаще помогают врачам идентифицировать кисты поджелудочной железы, они не могут предоставить информацию об их злокачественности.
Новый инструмент позволит определить, нужно оперировать поджелудочную кисту или нет. При определении злокачественных кист точность метода спектроскопии составляла 95%, по сравнению с 58%-ной точностью цитологии – единственного доступного в настоящее время предоперационного теста.
Исследователи проанализировали свет, отраженный от взятого в ходе недавних операций материала из 13 кист, и сравнили результаты с полученными с помощью ряда других методов, используемых для определения злокачественности, включая предоперационную визуализацию, тонкоигольную биопсию, аспирационную биопсию и цитологический анализ тканей после операции. По словам исследователей, во всех случаях диагноз, поставленный с помощью метода спектроскопии, совпадал с диагнозом, поставленным по результатам послеоперационного анализа.
В другом тесте миниатюрный экспериментальный волоконно-оптический зонд спектроскопа был объединен с аспирационной иглой у пациентов, которые проходили стандартную биопсию. Всем 9 пациентам был поставлен правильный диагноз с помощью спектроскопии, в отличие от тонкоигольной биопсии, результаты которой были верны лишь в половине случаев. Таким образом, в двойном слепом проспективном исследовании у 25 пациентов методика достигла общей точности 95% [4].
Метаболиты витамина А подавляют рост опухоли
Стойкая активация панкреатических звездчатых клеток (ПЗК) может нарушить биомеханический гомеостаз микроокружения опухоли, что способствует инвазии раковых клеток. Трансретиноевая кислота, активный метаболит витамина A, приводит в неактивное состояние ПЗК посредством соединения с бета-рецептором ретиноевой кислоты, что снижает регуляцию сократительной способности актомиозина.
Метаболит витамина А уменьшает способность ПЗК генерировать сильные тяговые усилия и адаптироваться к внеклеточным механическим сигналам, а также подавляет ремоделирование внеклеточного матрикса для ингибирования локальной инвазии раковых клеток в 3D органотипических моделях.
Предполагается, что соединение ретиноевой кислоты с рецепторами актомиозина является пусковым фактором стромального ремоделирования окружающих опухоль тканей и механосенсорной активации ПЗК. Таким образом, механическое перепрограммирование панкреатических звездчатых клеток с производными ретиноевой кислоты может стать жизнеспособной альтернативой абляции стромы в лечении панкреатической аденокарциномы [5].
Два мигрирующих белка повышают прогностическую ценность биомаркера рака поджелудочной железы
Единственным одобренным биомаркером для мониторинга лечения пациентов с данным заболеванием является CA 19-9, но в то же время маркер антигенов, продуцируемых раком поджелудочной железы, имеет низкую положительную прогностическую ценность для выявления ранней стадии заболевания, когда лечение может привести к пятилетней выживаемости ≥30% больных. Добавление двух белков, связанных с миграцией раковых клеток, повышает прогностическую способность текущего биомаркера для рака поджелудочной железы, который выявляет раннюю стадию заболевания.
Трио биомаркеров, протестированных в трех отдельных когортах, включая два слепых валидационных ис- следования, улучшило выявление пациентов с ранней стадией заболевания по сравнению со здоровыми людьми или пациентами с доброкачественными контрольными заболеваниями. Добавление двух биомаркеров, а именно ингибитора тканевого фактора свертывания крови и тенасцина C, обеспечило статистически значимое улучшение обнаружения всех ранних стадий рака по сравнению с контрольной группой, а также других субкогорт при использовании с текущим золотым стандартом CA 19-9. Эффективность измерялась с помощью показателя «площадь под фармакокинетической кривой», т.е. измерения чувствительности и специфичности биомаркеров. Комбинация из трех биомаркеров приближалась к идеальному значению показателя – 1 [6].
Подготовила Катерина Коваль
Литература
1. Neoptolemos J.P. et al. Comparison of adjuvant gemcitabine and capecitabine with gemcitabine monotherapy in patients with resected pancreatic cancer (ESPAC-4): a multicentre, open-label, randomised, phase 3 trial. The Lancet. January 2017.
2. Scarpa Aldo et al. Whole-genome landscape of pancreatic neuroendocrine tumours. Nature. 2017.
3. Harris N.L.E. et al. SerpinB2 regulates stromal remodelling and local invasion in pancreatic cancer. Oncogene. 2017.
4. Zhang Lei et al. Light scattering spectroscopy identifies the malignant potential of pancreatic cysts during endoscopy. Nature Biomedical Engineering. January 2017.
5. Chronopoulos Antonios et al. ATRA mechanically reprograms pancreatic stellate cells to suppress matrix remodelling and inhibit cancer cell invasion. Nature Communications. 2016.
6. Balasenthil Seetharaman et al. A Plasma Biomarker Panel to Identify Surgically Resectable Early-Stage Pancreatic Cancer. Journal of the National Cancer Institute. 2017.
СТАТТІ ЗА ТЕМОЮ Онкологія та гематологія
07.10.2019
Онкологія та гематологія
Урологія та андрологія
Пазопаніб при нирково-клітинній карциномі пізніх стадій
Протягом останніх 10 років таргетні протипухлинні препарати, спрямовані проти VEGF (судинного ендотеліального фактора росту) або mTOR (мішені рапаміцину ссавців), витіснили цитокіни (інтерферон-α, інтерлейкін [IL]-2) у лікуванні метастатичної нирково-клітинної карциноми (НКК). Анти-VEGF препарати включають низку пероральних мультитаргетних інгібіторів тирозинкінази, які діють переважно на рецептори VEGF (VEGFR). Одним із таких препаратів є пазопаніб (Вотрієнт®), схвалений у Європейському союзі, США, Японії та інших країнах для лікування НКК пізніх стадій. Пазопаніб може застосовуватися у першій лінії терапії або після лікування цитокінами.
…
09.09.2019
Кардіологія
Онкологія та гематологія
Клинический случай тромбоэмболии легочной артерии в кардиоонкологической практике: акцент на ведение пациентов с онкоассоциированными венозными тромбоэмболиями
Венозная тромбоэмболия (ВТЭ) является частым осложнением у онкологических больных. ВТЭ – независимый негативный фактор прогноза, который повышает вероятность летального исхода у таких пациентов и считается второй по значимости причиной смерти у госпитализированных больных раком. Риск ВТЭ у лиц с онкозаболеваниями, перенесших оперативное вмешательство, в 3‑5 раз выше, чем у таковых без рака. Профилактика развития ВТЭ – один из важных шагов для увеличения выживаемости данных пациентов [2]….
19.07.2019
Онкологія та гематологія
Історія Храму медичної літератури відтворена в новій книзі
Цей афористичний вислів ученого, розміщений на офіційному сайті Національної наукової медичної бібліотеки України, привертає увагу своєю влучністю. Справді, ця бібліотека заслуговує на те, щоб знали не тільки місце її розташування, рідкісні фонди літератури, які репрезентують всі напрями медичної освіти та науки, а й її історію та діяльність. …
Источник