Паллиативное лечение рака поджелудочной железы
Лечение рака поджелудочной железы в полном объёме, включающем радикальную операцию и химио- или химиолучевую терапию, далеко не всегда осуществимо: на момент установления диагноза радикальная операция возможна только у 10-20% больных, а 25% из этого числа не смогут пройти химиотерапию в связи с неудовлетворительным общим состоянием после оперативного вмешательства.
Радикальная операция подразумевает полное удаление первичной опухоли и ряда регионарных лимфоузлов, которые могут быть поражены микроскопическими метастазами.
Раковые опухоли бывают резектабельными (если имеется техническая возможность выполнения радикальной операции) и нерезектабельными (если такой возможности нет).
Возможность выполнения радикальной операции по поводу аденокарциномы поджелудочной железы оценивается согласно критериям разработанных для этого шкал резектабельности и зависит от того, насколько вовлечены в патологический процесс магистральные сосуды – чревный ствол, общая печёночная артерия, верхняя брыжеечная вена с ветвями, портальная вена.
Причины столь низкой доли резектабельных опухолей:
- значительные трудности с ранней диагностикой;
- близкое соседство опухоли с крупными сосудами.
Ранняя диагностика рака поджелудочной железы затруднена ввиду того, что ранние симптомы (ощущение боли или дискомфорта в верхней части живота) характерны для массы других заболеваний, а надёжных тесты для выявления ранних стадий этой опухоли на сегодняшний день отсутствуют.
Кроме того, больной может быть неоперабельным по другим причинам, например, ввиду выраженного нарушения функций жизненно важных органов — как развившихся в связи с ростом опухоли, так и безотносительно к ней.
Лечение рака поджелудочной железы на разных стадиях включает:
- радикальные хирургические вмешательства;
- нерадикальные вмешательства, направленные на поддержание важных функций;
- химио- или химиолучевую терапию;
- паллиативную помощь.
Однако даже радикальная операция в комбинации с химио- и лучевым лечением часто не способны отложить прогрессирование болезни на длительное время. Основная причина этого – раннее, ещё на стадии формирования, метастазирование опухоли. Микрометастазы в отдалённых органах невозможно выявить во время обследования, вследствие чего при установлении диагноза стадия бывает зачастую снижена. Соответственно, даже радикальное удаление первичной опухоли практически не влияет на неблагоприятный исход, а химиотерапия лишь замедляет рост метастазов. Печальная статистика – лишь 10-20% пациентов после радикальной операции живут пять и более лет.
Жёлчеотведение
Опухолевое поражение поджелудочной железы часто сопровождается обструкцией (нарушением проходимости) жёлчных путей, симптомы которой нарастают по мере роста опухоли и степени сдавления ею жёлчных протоков. Обструкция жёлчных путей – осложнение, характерное для локализации опухоли в головке поджелудочной железы.
Обструкция жёлчных путей сопровождается:
- болью различной интенсивности в области правого подреберья с «отдачей» в правую (реже — левую) лопатку;
- снижением аппетита;
- тошнотой;
- кожным зудом;
- желтухой (приобретением жёлтого оттенка склер, кожи слизистых оболочек), обесцвечиванием стула, потемнением мочи.
Зуд, желтуха и изменение цвета физиологических отправлений являются следствием холестаза (частичного или полного прекращения оттока жёлчи в кишечник) и поступления в кровь билирубина. Прямой билирубин – продукт естественного распада эритроцитов – в норме перерабатывается печенью, а затем поступает с жёлчью в желудочно-кишечный тракт, откуда выводится с калом и мочой. При обструкции жёлчевыводящих путей билирубин начинает накапливаться в крови.
Операция жёлчеотведения (декомпрессия жёлчных путей) применяется:
- для стабилизации больного перед радикальной операцией по поводу рака поджелудочной железы;
- для облегчения страданий больных на поздних стадиях, когда радикальное лечение невозможно.
Предоперационная декомпрессия назначается больным с обструкцией жёлчевыводящих путей, у которых опухоль признана резектабельной, однако откладывается из-за сопутствующего холестазу холангита (воспаления жёлчных путей), обменных нарушений, связанных с расстройством пищеварения (в котором жёлчь принимает непосредственное участие). Обычно предоперационная декомпрессия назначается при повышении билирубина в крови более 200 мкг/л.
В такой ситуации радикальная операция без предварительного жёлчеотведения чревата значительным повышением вероятности осложнений. Так, длительный холестаз (в течение месяца и более) может привести к кровотечению из стенок жёлчных протоков во время или после операции. В случае послеоперационных осложнений возникает необходимость откладывать химиотерапию, раннее начало которой улучшает прогноз.
Жёлчеотведение необходимо и лицам, которым перед операцией назначена химиотерапия или необходимо проведение дополнительных исследований.
В случае невозможности проведения радикальной операции (поздняя стадия рака, сердечно-сосудистая недостаточность и другие факторы, снижающие благоприятный исход операции), жёлчеотведение показано для улучшения качества жизни пациента.
Декомпрессия жёлчных путей осуществляется следующими методами:
- стентирование;
- наложение билиодигестивного анастомоза.
Стентирование – это введение в просвет протока пластикового каркаса, препятствующего сдавлению. Стентирование может осуществляться разными методами.
Билиодигестивный анастомоз – это операция по соединению жёлчного протока с двенадцатиперстной или тощей кишкой в обход сдавленного участка.
Выбор метода декомпрессии зависит от состояния больного, прогнозов, индивидуальных особенностей анатомических нарушений.
Общие принципы лечения больных с резектабельной опухолью
Резекция поджелудочной железы является основной (но не единственной) составляющей лечения рака, позволяющей максимально увеличить продолжительность жизни больного. Однако резекция должна обязательно дополняться химиотерапией или химиолучевой терапией.
Хирургическое лечение
Радикальная хирургическая операция направлена:
- на предотвращение местного рецидива новообразования;
- одновременно – на сохранение функции пищеварительной функции на таком уровне, который позволит максимально безопасно проводить химиотерапию (и чаще всего далеко не единственный курс).
Перед операцией врач должен убедиться, что:
- функциональное состояние жизненно важных органов позволит больному благополучно перенести и операцию, и последующее агрессивное консервативное лечение;
- нет отдалённых метастазов опухоли;
- опухоль соответствует критериям резектабельности.
Для этого проводится соответствующая диагностика. Только после полноценного обследования врач, а нередко – врачебный консилиум, принимает решение о целесообразности хирургического вмешательства. Тем не менее, после операции у четверти больных осуществление химиотерапии бывает невозможно.
Виды хирургических операций:
- гастропанкреатодуоденальная резекция (ГПДР) или панкреатодуоденальная резекция (ПДР);
- дистальная резекция поджелудочной железы;
- панкреатэктомия.
ГПДР – иссечение головки поджелудочной железы, части желудка, двенадцатиперстной кишки, общего жёлчного протока и жёлчного пузыря. При ПДР желудок не резецируется. Кроме того, в ходе операции удаляются регионарные лимфатические узлы, могут иссекаться сосуды и нервы. После иссечения проводится реконструкция желудочно-кишечного тракта, пластика сосудов. Операции в подобном объёме выполняются при раке головки поджелудочной железы. ГПДР и ПДР могут повлечь нарушения функций пищеварительной системы разной степени тяжести, панкреонекроз, внутренние и желудочно-кишечные кровотечения.
Дистальная резекция может выполняться в следующем объёме:
- удаление хвоста поджелудочной железы;
- удаление хвоста и тела;
- удаление хвоста, тела и перешейка;
- субтотальная дистальная резекция – удаление хвоста, тела, перешейка и большей части головки поджелудочной железы.
Такие операции в большинстве случаев сопровождаются удалением селезёнки ввиду нарушения её кровоснабжения. Операция выполняется при раке тела или хвоста поджелудочной железы, в случае внутрипротоковой аденокарциномы – только в объёме субтотальной резекции. При нейроэндокринныех опухолях (НЭО) высокой и умеренной дифференцировки (грубо говоря, низкой и умеренной степени злокачественности) возможна дистальная резекция в меньшем объёме, в том числе и с сохранением селезёнки. В зависимости от объёма операции, больному может потребоваться пожизненный контроль сахара в крови, приём инсулина.
Тотальная панкреатодуоденэктомия (панкреатэктомия) – удаление всей поджелудочной железы, двенадцатиперстной кишки, жёлчного пузыря и общего жёлчного протока, селезёнки, регионарных лимфатических узлов – выполняется в случае обнаружения нескольких очагов опухоли или распространения опухоли тела поджелудочной железы на хвост и головку. После операции требуется пожизненный частый контроль диабета и приём пищеварительных ферментов. Невозможность обеспечения такого контроля является противопоказанием к операции.
Химиотерапия
Адъювантная (послеоперационная) терапия является обязательным этапом лечения рака, поскольку:
- согласно данным новых исследований, аденокарцинома поджелудочной железы способна метастазировать ещё на этапе формирования первичной опухоли;
- отдалённые метастазы трудно выявить своевременно, и они являются основной причиной смерти после радикальной операции.
Химиотерапия замедляет рост отдалённых метастазов, отодвигая время их проявления, тем самым позволяя увеличить продолжительность жизни больного. С той же целью в комбинации с химиотерапией применяется лучевое лечение, но вопрос эффективности последней пока остаётся открытым. Больные, получающие послеоперационную химио- или химиолучевую терапию, живут в среднем в полтора-два раза дольше по сравнению с теми, кто её не получает, однако такое лечение может существенно снижать качество жизни.
Общие принципы лечения больных нерезектабельным раком поджелудочной железы
Основная задача лечения нерезектабельных опухолей – перевод их в категорию резектабельных. Иногда этого удаётся добиться при помощи неоадъювантной (предоперационной) химиотерапии (или химиолучевой терапии).
Нерезектабельные опухоли поджелудочной железы бывают разные – со значительным поражением местным распространением и лишь немного не соответствующие критериям нерезектабельности. Последние называют пограничнорезектабельными. Такие опухоли являются особенно перспективными в плане последующего осуществления радикальной операции.
Если опухоль достаточно чувствительна к химиотерапии, неоадъювантное противоопухолевое лечение подавляет рост не определённых на момент установления диагноза метастазов и замедляет местное распространение – поэтому, если в дальнейшем удастся провести радикальную операцию, такое лечение может улучшить прогноз.
В случаях резектабельной опухоли назначение дооперационной химиотерапии сопряжено с рисками: во-первых, за время консервативного лечения малочувствительная к химиотерапии опухоль может стать нерезектабельной, во-вторых, химиотерапия (и лучевое лечение), ввиду высокой токсичности, может привести к ухудшению общего состояния и невозможности выполнения операции.
Больные, перенёсшие адъювантное противоопухолевое лечение и последующую радикальную операцию, после хирургического вмешательства продолжают получать химиотерапию.
Паллиативное лечение рака поджелудочной железы
Паллиативное лечение направлено на устранение мучительных симптомов, которыми чаще всего сопровождается рак поджелудочной железы (особенно на 4 стадии).
Такое лечение не приостанавливает рост опухоли и процесс метастазирования, однако значительно облегчает жизнь больному.
Паллиативное лечение рака поджелудочной железы направлено на устранение:
- симптомов, обусловленных сдавлением опухолью жёлчевыводящих путей;
- развития нарушения проходимости двенадцатиперстной кишки (дуоденальной обструкции), также связанного с её сдавлением;
- изнуряющего болевого синдрома;
- симптомов, обусловленных интоксикацией: сильнейшей слабости, потери аппетита и прочих;
- психических нарушений, связанных как с самим фактом выявления смертельной болезни, так и с вызванными заболеванием физическими страданиями.
При обструкции жёлчевыводящих путей выполняется стентирование или билиодигестивный анастомоз.
При дуоденальной обструкции выполняется гастроэнтероанастомоз — формирование соединения желудка в обход двенадцатиперстной кишки с другими отделами тонкого кишечника
Несмотря на короткий срок жизни больных с распространённым раком поджелудочной железы, согласно данным ряда исследований, проведённых за рубежом, 40% доживает до того момента, когда начинает развиваться непроходимость двенадцатиперстной кишки. Поэтому некоторые зарубежные специалисты рекомендуют совмещать билиодигестивный анастомоз с гастроэнтероанастомозом. По наблюдениям этих авторов, такая операция позволяет продлить жизнь и улучшить её качество по сравнению со случаями, когда профилактическое наложение гастроэнтеростомоза не выполняется. В России, в целом, не принята тактика профилактического гастроэнтеростомоза, а соответствующие исследования не проводились.
Если на момент установления диагноза боль отмечается у 25-40% пациентов, в терминальной стадии этот симптом наблюдается уже у 80% больных раком поджелудочной железы. Боли бывают разной интенсивности, однако даже умеренная постоянная боль истощает, отнимает последние силы. Для купирования болевого синдрома применяются анальгетики, преимущественно — наркотические.
Хороший результат даёт в комбинации с медикаментозным лечением спланхникэктомия – хирургическое иссечение чревного узла солнечного сплетения или его разрушение с помощью введения химических веществ. В результате такой процедуры болевые импульсы из зоны, поражённой опухолью, перестают передаваться в мозг и боль перестаёт ощущаться.
Для улучшения общего состояния неплохо зарекомендовала себя фитотерапия (траволечение) – например, отвары и настои берёзового гриба – чаги. Экстракт чаги можно приобрести в аптеке под торговым названием «бефунгин».
При развитии психических нарушений назначается психотерапия. Вообще, психотерапия должна назначаться с момента установления диагноза и проводиться на всех этапах лечения независимо от резектабельности опухоли и прогнозов. В случае психогенных реакций, сопровождающихся выраженным страхом, депрессией, больной может замыкаться в себе и «не слышать» врача. В этих случаях с целью успокоения пациента и установления контакта применяются психотропные средства.
При распространённом (местно или по всему организму) раке с целью продления жизни нередко назначается химиотерапия, но чаще всего качество жизни при этом весьма сомнительно.
Лечение народнеыми средствами
На любой стадии рака недопустимо самолечение, в том числе, и так называемыми «народными» методами (например, употреблением внутрь дёгтя, креолина, керосина и прочих подобных «чудодейственных» снадобий). В лучшем случае такое «лечение» бесполезно, но чаще всего – пагубно. Уверовав в чудо-средства, больной с резектабельной опухолью отказывается от медицинской помощи, а возвращается в клинику, когда время для эффективной помощи упущено. Кроме того, ряд снадобий относится к откровенно ядовитым веществам и вносит свою лепту в опухолевую интоксикацию организма, а также в интоксикацию от применения противоопухолевых препаратов.
Лечить рак поджелудочной железы лучше в специализированных центрах, где опыт и навык специалистов несравнимо выше, чем в неспециализированных больницах. Например, в Москве это Институт хирургии им. А. В. Вишневского, Московский клинический научный центр, Московский научно-исследовательский онкологический институт им. П. А. Герцена.
Источник
12 апреля 2019 г.
Просмотров: 273
В последние десятилетия отмечается рост пациентов со злокачественными опухолями органов гепатопанкреатодуоденальной зоны. При этом частота диагностики рака этих органов на ранних стадиях практически не повысилась. В основном пациенты продолжают поступать в стационары только при развитии осложнений, наиболее частым из которых является механическая желтуха. Рак головки поджелудочной железы находится на втором месте среди причин подпеченочной желтухи (30–35%), уступая лишь холедохолитиазу (35–40%), третье место занимает рак внепеченочных желчных протоков (10–12%), затем — рак большого сосочка двенадцатиперстной кишки (1–2%).
При этом, по данным литературы, только в 10–20% случаев при выявлении рака поджелудочной железы пациентам выполняется радикальная операция, несмотря на которую большинство умирает в первый год после вмешательства. К сожалению, большая часть больных по разным причинам не может рассчитывать на радикальное лечение. Лечение больных этой категории осложняется наличием обтурации желчных путей, холангита, а в большинстве случаев и печеночной недостаточности. Общепризнано, что оперативное вмешательство, выполненное при нарастающей механической желтухе, является чрезвычайно рискованным и сопровождается высокой летальностью, достигающей 20-60%, что наряду с возрастающей частотой опухолевого поражения поджелудочной железы, несомненно, обусловливает актуальность данной проблемы.
В последние годы основными методами декомпрессии желчных путей считаются минимально инвазивные: ретроградные (эндоскопические) или антеградные (чрескожные чреспеченочные). Активное использование в клинической практике современных антеградных чрескожно-чреспеченочных) и ретроградных (эндоскопических) минимально инвазивных вмешательств позволяет эффективно сочетать диагностические и лечебные мероприятия, направленные в первую очередь на достижение билиарной декомпрессии. При этом следует признать, что при исторически сложившемся приоритете эндоскопических вмешательств ретроградный доступ в желчные протоки тем не менее, очевидно, перестал быть безальтернативным.
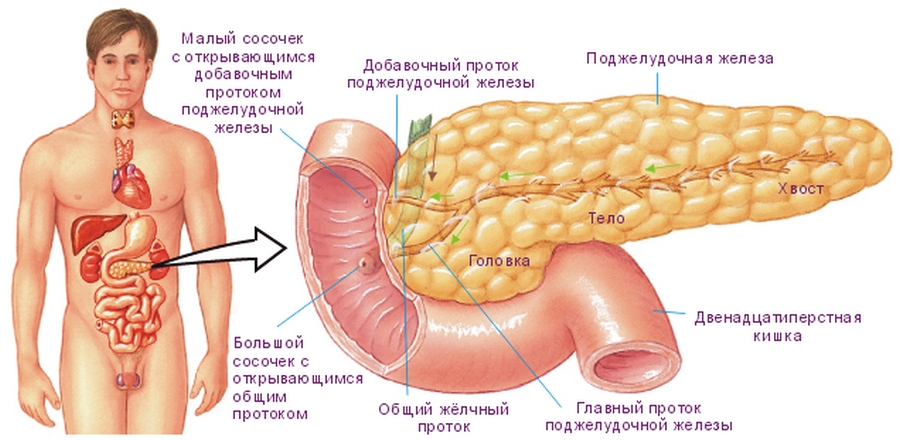
Антеградные методы декомпрессии желчевыводящей системы, реализуемые в виде чрескожно-чреспеченочной холангиостомии, продленного наружно-внутреннего дренирования, антеградного эндобилиарного стентирования, могут служить альтернативой эндоскопическим методам при их неэффективности или невозможности выполнения. При этом чрескожные миниинвазивные вмешательства позволяют либо успешно подготовить пациентов к основному этапу операции, в случае возможного выполнения радикального хирургического лечения, либо могут стать окончательным вмешательством, являясь примером паллиативного лечения. Целью нашего исследования явилась оценка эффективности паллиативного лечения с применением антеградных миниинвазивных технологий при раке поджелудочной железы.
Материалы и методы
За период с января 2010 по декабрь 2016 года в хирургическом отделении Орловской областной клинической больницы под наблюдением находилось 160 больных со злокачественным поражением поджелудочной железы, осложненным синдромом механической желтухи. В связи с чем все пациенты были госпитализированы в экстренном порядке. Больные доставлялись в стационар скорой медицинской помощью, направлялись другими лечебно-профилактическими учреждениями города и области, а также обращались самостоятельно. Женщин в исследуемой группе было 76 (47,5%), мужчин — 84 (52,5%). Возраст больных колебался от 48 до 76 лет. Проводилось комплексное обследование больных, включающее исследование клинико-лабораторных данных (общий и биохимический анализ крови, общий анализ мочи, коагулограмма и др.), выполнялось ультразвуковое исследование брюшной полости, гастродуоденоскопия, по показаниям эндоскопическая ретроградная холангиопанкреатография и мультиспиральная компьютерная томография, а также ряд других инструментальных исследований в зависимости от сопутствующей патологии.
При поступлении уровень прямого билирубина в исследуемой группе больных колебался от 68 до 580 мкмоль/л. Уровень общего билирубина в отдельных случаях достигал 780 мк-моль/л. Известно, что чем выше уровень гипербилирубинемии, тем больше вероятность развития у больного некорригируемой печёночной недостаточности и прогрессирующей полиорганной недостаточности. В связи с этим наличие гипербилирубинемии и билиарной гипертензии требует проведения срочных хирургических вмешательств, направленных на декомпрессию желчных путей. При этом билиарная декомпрессия должна быть прогнозируемо эффективной и управляемой.
У всех пациентов, находящихся под нашим наблюдением, при ультразвуковом исследовании были выявлены признаки актуальной желчной гипертензии, что наряду с невозможностью выполнения по различным причинам ретроградного эндоскопического дренирования явилось основанием для антеградного дренирования желчных путей под сонофлюороскопическим контролем по срочным показаниям (1-2 сутки от момента поступления в стационар). При этом во всех случаях антеградные миниинвазивные вмешательства несли не только лечебную, но и диагностическую нагрузку. Так как выполняемая интраоперационная антеградная холангиография позволяла уточнить уровень и степень блока. Адекватность выполненного чрескожного чреспеченочного дренирования оценивалась по изменению интенсивности желтухи, по суточному дебиту желчи, степени снижения гипербилирубинемии в биохимическом анализе крови, а также по устранению признаков билиарной гипертензии при динамическом ультразвуковом исследовании. После снижения уровня билирубина крови, дообследования и стабилизации состояния пациентов решался вопрос о переводе наружной холангиостомы в наружно-внутреннюю или об антеградном эндобилиарном стентировании.
Результаты исследования
Чувствительность, специфичность и диагностическая точность холангиографии во время постановки холангиостомы при раке поджелудочной железы составила соответственно 91,2%, 80,1% и 85,3%. Всего в группе пациентов со злокачественным поражением поджелудочной железы выполнено 204 минимально инвазивных вмешательств. Распределение характера вмешательств было следующим: наружная холангиостомия — 62,7% (128); антеградное эндобилиарное стентирование — 25% (51); наружно-внутреннее дренирование протоков — 10,3% (21); чрескожно-чреспеченочная микрохолецистостомия — 2% (4).
Учитывая, что у 51 пациента (32%) в исследуемой группе при проведении клинико-инструментальных и морфологических исследований был подтвержден неоперабельный характер поражения поджелудочной железы, выполнение радикального оперативного лечения не представлялось возможным. В связи с этим окончательным видом хирургического лечения, направленным на улучшение качества жизни, у данных больных, явилось антеградное стентирование внепеченочных желчных протоков.
Стентирование, по данным литературы, является более предпочтительным и менее травматичным способом восстановления пассажа желчи у больных с неоперабельным раком поджелудочной железы, так как значительно улучшает качество жизни больного.
В каждом исследуемом случае стентирование выполнялось вторым этапом после предварительной чрескожно-чреспеченочной холангиостомии или наружно-внутреннего дренирования. Техника стентирования заключалась в проведении металлического проводника через опухолевую структуру за зону большого сосочка двенадцатиперстной кишки под сонофлюороскопическим контролем, по которому в последующем производилась транспапиллярная установка стента. После выполненного стентирования в обязательном порядке производили постановку страховочной наружной холангиостомы, которая позволяла выполнять динамическую антеградную холангиографию для контроля процесса раскрытия стента и адекватности его функционирования в раннем послеоперационном периоде.
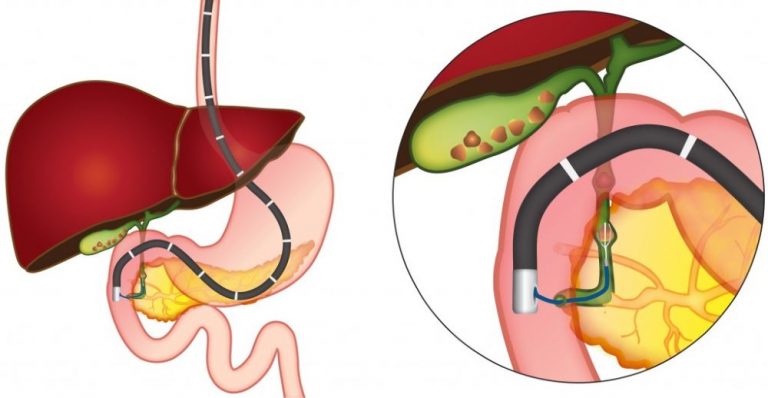
Выбор стента по диаметру раскрытия, длине и типу покрытия осуществлялся индивидуально в каждом конкретном случае в зависимости от протяженности зоны поражения. Использование покрытого стента при неоперабельном раке поджелудочной железы имеет ряд преимуществ, так как позволяет предотвратить возможное прорастание опухолевой или грануляционной тканью ячеистой стенки стента, тем самым вызывая обтурацию его просвета. Однако учитывая транспапиллярное положение устанавливаемого стента, применение покрытых форм было ограничено у пациентов с сохраненной проходимостью и функцией панкреатического протока.
Использование в подобных случаях покрытых форм стента значительно повышало риск перекрытия устья панкреатического протока. Как правило, в большинстве случаев сразу же после установки нитинолового саморасправляющегося стента под рентгенологическим контролем отмечали поступление контрастного препарата в просвет двенадцатиперстной кишки. Однако при этом рентгенологически сохранялась зона сужения в пораженном участке билиарного тракта. Полное раскрытие стента, сопровождавшееся свободным поступлением контрастного вещества в просвет двенадцатиперстной кишки, определялось в течение 24-48 часов с момента его установки. Восстановление пассажа подтверждалось контрольной антеградной холангиографией.
Обсуждение результатов
Осложнения после проведенных миниинвазивных вмешательств возникли в 26 случаях, и были связаны у 12 пациентов (7,5%) с дислокацией холангиостомического дренажа; в 4 случаях (2,5%) с развившимся острым холециститом; в 2 случаях (1,2%)с развившимся острым панкреатитом; у 5 пациентов с гидротораксом (3,1%). В отдаленные сроки после стентирования у 3 (1,9%) больных развился рецидив механической желтухи, обусловленный нарушением функции эндобилиарного стента.
В 2 наблюдениях через 4-5 мес. с момента постановки непокрытого стента произошла обтурация его внутреннего просвета за счет прорастания опухолевыми тканями ячеистой стенки.
В 3-м наблюдении рецидив желтухи развился через 6 мес. с момента постановки покрытого эндобилиарного стента и был обусловлен сдавлением его просвета разрастающейся опухолевой тканью. Двум пациентам из данной группы наблюдения выполнено антеградное рестентирование покрытым стентом по методике «стент в стент». В 3-м случае рецидива желтухи, связанного со сдавлением покрытого стента, рестентирование не проводилось. Пациенту было выполнено наружно-внутреннее дренирование.
Среди осложнений, развившихся после проведения антеградного эндобилиарного стентирования в ранний послеоперационный период, были зафиксированы острый холецистит (4 пациента) и острый панкреатит (2 пациента). В 3 случаях после установки непокрытого стента и в 1 после установки покрытого у пациентов отмечены клинико-эхографические признаки острого холецистита. У одного больного выполнена лапароскопическая холецистэктомия, у трех других произведена постановка чрескожно-чреспеченочной микрохолецистостомии под контролем УЗИ, на фоне которой клинические проявления острого холецистита удалось полностью купировать. Клиническая картина острого панкреатита, развившаяся в течение 24-48 часов после выполненного стентирования у двух пациентов, полностью купировалась на фоне проведенной консервативной терапии.
Мы в своем опыте не наблюдали смещений и миграций стентов после установки. Таким образом, антеградное эндобилиарное транспапиллярное стентирование саморасправляющимися металлическими стентами обеспечивает надежное и длительное дренирование желчных протоков, является малотравматичным, довольно безопасным и эффективным методом билиарной декомпрессии при механической желтухе, обусловленной неоперабельным раком поджелудочной железы. Летальный исход возник у 12 больных, что составило 7,5%, и был обусловлен прогрессированием основного заболевания и нарастанием полиорганной недостаточности.
Выводы
У пациентов с неоперабельным раком поджелудочной железы выполнение антеградного эндобилиарного стентирования представляет собой окончательный вариант хирургического лечения, позволяющий при минимальном объеме вмешательства обеспечить адекватный дренирующий эффект желчевыводящих путей. Кроме того, отсутствие наружных дренажей улучшает качество жизни пациента, его психологическое состояние, позволяет активизировать его в более ранние сроки, избавляет от необходимости приема желчи внутрь.
Литература:
- Альянов А.Л., Мамошин А.В., Борсуков А.В., Мурадян В.Ф. Эффективность применения минимально инвазивных технологий в лечении больных с синдромом механической желтухи // Ученые записки Орловского государственного университета. Серия: Естественные, технические и медицинские науки. 2015. № 4. С. 280-284.
- Гальперин Э.И., Ветшев П.С. Руководство по хирургии желчных путей. М.: Издательский дом Видар-М, 2006.
- Данилов М.В., Фёдоров В.Д. Повторные и реконструктивные операции при заболеваниях поджелудочной железы.М.: Медицина, 2003.
- Долгушин Б.И., Авалиани М.В., Буйденок Ю.В. и др.Эндобилиарная интервенционная онкорадиология.М.: ООО «Медицинское информационное агентство«.2004. — 224 с.
- Затевахин И.И., Цициашвили М.Ш., Дзарасова Г.Ж. и др.Возможности доплеровской сонографии в оценке функционального состояния печени при механической желтухе // Анн. хирург. гепатолог. 2001. Т. № 1. С. 113-124.
- Ившин В.Г., Якунин А.Ю., Лукичев О.Д. Чрескожные диагностические и желчеотводящие вмешательства у больных механической желтухой. Тула, 2000. — 312 с.
- Израилов Р.Е. Миниинвазивные технологии в лечении больных с опухолями органов билиопанкреатодуоденальной зоны: автореф. дис… докт. мед. наук / Р.Е. Израилов.Москва, 2011. — 47 с.
- Кубышкин В.А., Вишневский В.А. Рак поджелудочной железы. М., 2003.
- Охотников О.И., Яковлева М.В., Григорьев С.Н., Пахомов В.И. Антеградные эндобилиарные вмешательства в лечении осложненной желчнокаменной болезни // Анн.хирург. гепатолог. 2013. Т. 18. № 1. С. 29-37.
- Патютко Ю.И., Котельников А.Г. Хирургия рака органов билиопанкреатодуоденальной зоны. М.: Медицина, 2007.
- Costamagna G., Pandolfi M. Endoscopic stenting for biliary and Pancreatic malignancies. J ClinGastroenterol 2004; 38: 59–67.
- Hans-Joachim Wagner. With or Against the Bile Flow?Radiology. 2002; 225: 7-9.
- Katsinelos P., Paikos D., Kountouras J. et al. Tannenbaum and metal stents in the palliative treatment of malignant distal bileduct obstruction: a comparative study of patency and cost effectiveness. SurgEndosc 2006; 20: 1587–1593.
- May A., Ell C. A New Self-Expanding Nitinol Stent for Palliation of Malignant Biliary obstruction. Endoscopy 2004; 36: 329–333.
- Mehmet M.D., Aksungur E., Seydaolu G. Percutaneousplacement of biliary metallic stents in patients with malignanthilar obstruction, unilobar versus bilobar drainage. Journal ofVascular and Interventional Radiology. 2003; 14: 1409-1416.
- Yushidome H., Miyazaki M., Shimizu H. et al. Obstructivejaundice impairs hepatic sinusoidal endothelial cell functionand renders liver susceptible to hepatic ischemia/ reperfusion //J. Hepatology. 2000. V.33 (1). P.59-67.
Источник: Научно-практический журнал «Паллиативная медицина и реабилитация» № 1. 2018.
Источник


