Переваривание белков ферментами поджелудочной железы
единица | 9.1. Роль 9.2. Переваривание 9.3. Трансаминирование |
Модульная | 9.4. Обмен 9.5. Орнитиновый 9.6. Гипераммониемия 9.7. Пути 9.8. Биосинтез |
Модульная | 9.9. Обмен 9.10. Обмен 9.11. Обмен 9.12. Заболевания, 9.13. Биогенные |
ЕМА 9.1. РОЛЬ
БЕЛКОВ В ПИТАНИИ. АЗОТИСТЫЙ БАЛАНС
В организме
человека содержится примерно 15 кг
белков. Количество свободных аминокислот
составляет около 35 г. Ежесуточно в
организме распадается до аминокислот
почти 400 г белков и столько же синтезируется.
1. Основным
источником аминокислот для человека
являются пищевые белки. Суточная норма
потребления белков составляет в среднем
около 100 г.
20 α-аминокислот,
которые встречаются в белках организма,
можно разделить на четыре группы:
• заменимые
аминокислоты — Ала, Асп, Асн, Глу, Глн,
Про, Гли, Сер —
синтезируются в необходимых количествах
в организме;
• незаменимые
аминокислоты — Вал, Лей, Иле, Мет, Фен,
Три, Лиз, Тре —
не могут синтезироваться в организме
и должны поступать с пищей;
• частично
заменимые аминокислоты — Гис, Арг —
синтезируются очень медленно, в
количествах, не покрывающих потребности
организма, особенно в детском возрасте;
• условно
заменимые аминокислоты — Цис, Тир —
синтезируются из незаменимых аминокислот
Мет и Фен соответственно.
2. Полноценность
белкового питания зависит
от аминокислотного состава белков и
определяется наличием незаменимых
аминокислот.Отсутствие
в пищевых белках незаменимых аминокислот
(даже одной) нарушает их синтез в
организме. Обновление белков в различных
тканях происходит с разной скоростью.
Так, белок соединительной ткани коллаген
обновляется полностью за 300 дней, а
белки системы свертывания крови — от
нескольких минут до нескольких дней.
3. Большая
часть свободных аминокислот используется
для синтеза собственных белков организма.
Кроме того, из аминокислот синтезируется
большое количество биологически
активных молекул:
• биогенные
амины (медиаторы); некоторые аминокислоты
сами являются нейромедиаторами —
например, глицин и глутамат;
• гормоны
белковой природы;
• гем,
креатин, карнитин и другие азотсодержащие
соединения.
Аминокислоты
подвергаются реакции дезаминирования;
образовавшиеся безазотистые остатки
используются для синтеза глюкозы,
кетоновых тел или окисляются до СО2 и
Н2О.
Азот аминокислот
выводится из организма почками в виде
мочевины или аммонийных солей.
Аминокислоты и белки содержат до 95%
всего азота организма.
4. Азотистый
баланс —
разница между количеством азота,
поступающего с пищей, и количеством
азота, выделяемого почками в виде
мочевины и азотистых солей. Он является
показателем состояния белкового и
аминокислотного обмена.
Азотистый
баланс может
быть:
• положительным —
у детей, беременных женщин, при увеличении
мышечной массы у спортсменов и больных,
выздоравливающих после тяжелой болезни,
что свидетельствует о преобладании
синтеза белков и роста тканей над их
распадом;
• отрицательным —
при тяжелых заболеваниях, голодании,
старении, что свидетельствует об
усилении процессов распада белков;
• равным
нулю (азотистое равновесие) — у
здоровых взрослых людей при нормальном
питании.
1. При
переваривании происходит гидролиз
пищевых белков до свободных аминокислот.
Процесс переваривания начинается в
желудке и продолжается в тонком кишечнике
под действием ферментов пептидгидролаз
(пептидаз). Основные
пептидазы синтезируются в клетках
желудка, поджелудочной железы и кишечника
(рис. 9.1). В желудке белки
пищи денатурируются и гидролизуются
с образованием олигопептидов.
Вкишечнике панкреатические
пептидазы продолжают гидролиз
олигопептидов до ди- и трипептидов и
свободных аминокислот. Короткие пептиды
расщепляются до свободных аминокислот
в пристеночном
слое или
в клетках кишечного эпителия. Затем
происходит их всасывание.
Все пептидазы, в
зависимости от места расположения в
пептиде гидролизуемой связи, делятся
на
эндопептидазы и экзопептидазы:
• эндопептидазы —
расщепляют пептидные связи, удаленные
от концов пептидной цепи (пепсин,
трипсин, химотрипсин, эластаза);
• экзопептидазы
— гидролизуют
пептидные связи, образованные N- и
С-концевыми аминокислотами (аминопептидаза,
карбоксипептидазы А и В),
а также расщепляют ди- и трипептиды.
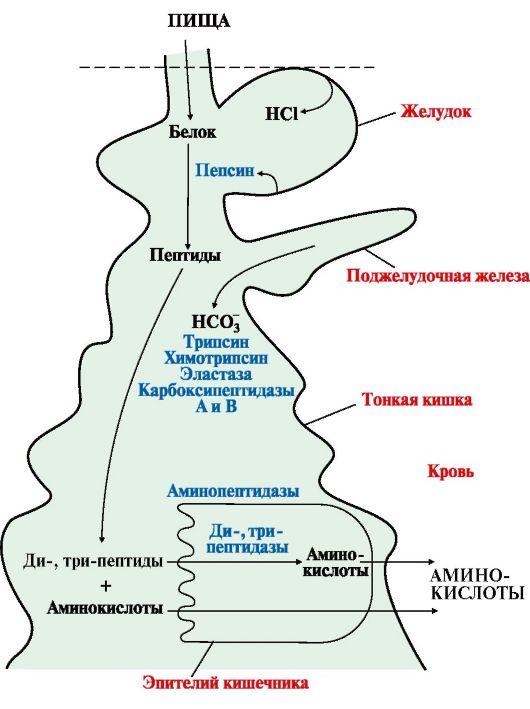 Рис.
Рис.
9.1. Переваривание белков в желудочно-кишечном
тракте
Ферменты,
участвующие в переваривании белков,
обладают относительной субстратной
специфичностью и гидролизуют пептидные
связи; при этом каждая пептидаза
преимущественно расщепляет связи,
образованные определенными аминокислотами
(табл. 9.1).
2. Желудочные
и панкреатические пептидазы вырабатываются
в неактивной форме (проферменты), секретируются
к месту действия, где активируются путем
частичного протеолиза (отщепление
пептида различной длины, чаще с N-конца
молекулы профермента). Место
синтеза проферментов (клетки
слизистой оболочки желудка, поджелудочная
железа) и место
их активации (полость
желудка, тонкого кишечника)пространственно
разделены. Такой
механизм образования активных ферментов
необходим для защиты секреторных клеток
желудка и поджелудочной железы от
самопереваривания.
Таблица
9.1. Характеристика протеолитических
ферментов желудочно-кишечного тракта
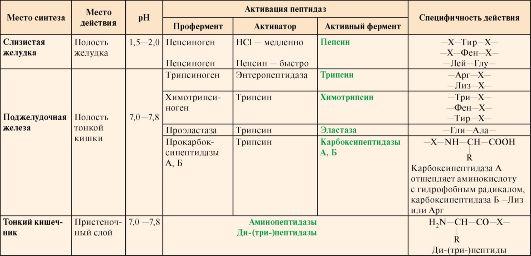 Примечание: X
Примечание: X
— любая аминокислота
Преждевременная
активация проферментов в секреторных
клетках происходит при:
• язвенной
болезни желудка —
пепсиноген превращается в пепсин в
клетках слизистой желудка;
• остром
панкреатите —
трипсиноген превращается в трипсин в
клетках поджелудочной железы и активирует
остальные панкреатические пептидазы.
3. Слизистая
оболочка желудка вырабатывает следующие
факторы, необходимые для переваривания
белков:
• пепсиноген —
синтезируется в главных клетках;
• соляную
кислоту —
вырабатывается обкладочными клетками.
Гидролиз белков в
желудке происходит
под действием пепсина.
Профермент
пепсиноген при поступлении пищи
секретируется в полость желудка, где
в два этапа происходит его активация:
• с помощью
НС! — медленно;
• аутокаталитически
— быстро, уже имеющимся пепсином. Соляная
кислота желудочного
сока выполняет следующие функции:
• .участвует
в активации пепсиногена;
• создает
оптимум рН для пепсина;
• оказывает
бактерицидное действие;
• денатурирует
белки пищи.
Значение рН
желудочного сока в норме составляет
1,5-2,0. Определение
кислотности желудочного сока используется
для диагностики различных заболеваний
желудка (табл. 9.2).
Таблица
9.2. Компоненты желудочного сока в норме
и при патологических состояниях
• 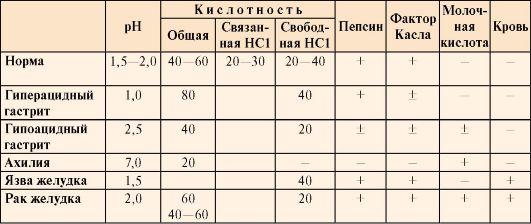 Общая
Общая
кислотность желудочного сока —
это совокупность всех кислотореагирующих
веществ желудочного сока, представляющая
собой секрет желудка, собираемый в
течение 1 часа (предварительно отбирают
секрет, ранее содержащийся в желудке).
• Связанная
соляная кислота —
это соляная кислота, связанная с белками
и продуктами их переваривания.
• Свободная
соляная кислота —
это соляная кислота, не связанная с
другими молекулами.
• Общая
кислотность желудочного сока выражается
в титрационных единицах (ТЕ) и
измеряется количеством 0,1 М NaOH в
миллилитрах, затраченным на титрование
100 мл желудочного сока в присутствии
определенных индикаторов.
• Кислотность
желудочного сока в
норме составляет:
общая 40-60 ТЕ;
связанная
HCl 20-30 ТЕ;
свободная
HCl 20-40 ТЕ.
При диагностике
заболеваний желудка помимо биохимических
анализов обязательно проводят
рентгенологические и эндоскопические
исследования, иногда биопсию.
В слизистой
оболочке желудка вырабатывается
также внутренний
фактор (фактор Касла), который
представляет собой белок, способствующий
всасыванию витамина В12 в
тонкой кишке. Отсутствие этого витамина
часто приводит к развитию анемии.
Молочная
кислота в
норме в желудочном соке отсутствует.
Образуется при уменьшении содержания
или отсутствии свободной соляной
кислоты в результате усиленного
размножения молочнокислых бактерий
или при злокачественных опухолях
желудка.
НС1 и пепсин
способны разрушать клетки эпителия
желудка. В норме это не происходит
благодаря наличию защитных факторов
слизистой оболочки, таких, как:
• образование
на поверхности слизи, содержащей
гетерополисахариды, которые не являются
субстратами пептидгидролаз;
• секреция
эпителиальными клетками ионов НСО3-,
создающих в пристеночном слое менее
агрессивную среду с рН 5,0-6,0, в которой
пепсин неактивен. Кроме того, клетки
поврежденного эпителия обладают
способностью к быстрой регенерации.
Пепсин
гидролизует пептидные
связи, образованные аминогруппой или
карбоксильной группой ароматических
аминокислот (см. табл. 9.1):
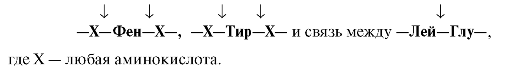 4.
4.
Переваривание белков в кишечнике происходит
под действием:
• ферментов
поджелудочной железы-трипсина,
химотрипсина, эластазы, карбоксипептидаз
А и Б;
• ферментов
эпителия тонкой кишки — аминопептидазы,
дипептидаз, трипептидаз.
Активная
форма трипсина образуется
в кишечнике при участии фермента
энтеропептидазы, выделяемого клетками
кишечника. Энтеропептидазаотщепляет
от N-конца трипсиногена гексапептид
(рис. 9.2), что приводит к изменению
конформации молекулы и формированию
активного центра трипсина.
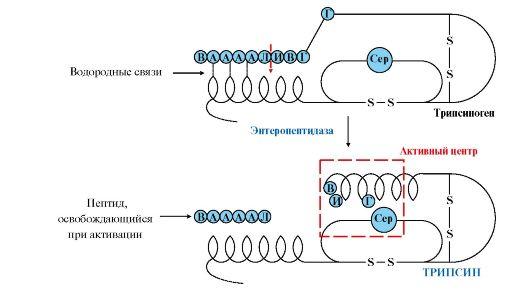 Рис.
Рис.
9.2. Механизм активации трипсиногена.
Пунктирная
стрелка — место гидролиза. Буквами
обозначены аминокислоты (А — асп, Г —
глу, В — вал, Л — лиз, И — иле)
Остальные проферменты
панкреатического сока (химотрипсиноген,
прокарбоксипептидазы А и В, проэластаза)
активируются трипсином.Активация
панкреатических пептидаз в кишечнике
происходит в виде каскада реакций.
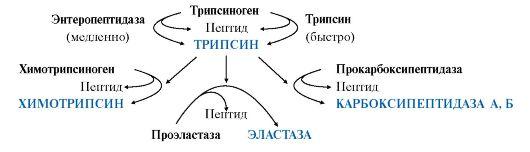 Ферменты
Ферменты
эпителия тонкой кишки синтезируются
в энтероцитах сразу в
активной форме.
• Ферменты,
участвующие в переваривании белков в
кишечнике, обладают
субстратной специфичностью к
определенным аминокислотам в
белке: Трипсин гидролизует
преимущественно пептидные связи,
образованные карбоксильными группами
катионогенных аминокислот:
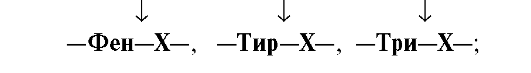
• 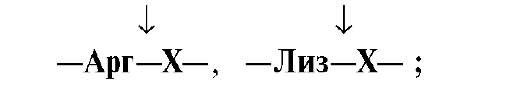 Химотрипсин —
Химотрипсин —
пептидные связи, образованные
карбоксильными группами ароматических
аминокислот:
•  Эластаза —
Эластаза —
связь между -Гли-Ала-
• Карбоксипептидазы отщепляют
С-концевые аминокислоты:
карбоксипептидаза А —
гидрофобные аминокислоты, карбоксипептидаза В
— Лиз и Арг;
• Аминопептидаза —
отщепляет N-концевые аминокислоты;
• Дипептидаза —
гидролизует дипептиды;
• Трипептидаза —
расщепляет трипептиды на отдельные
аминокислоты.
5. Конечным
результатом переваривания белков
является образование свободных
аминокислот, поступающих в клетки
слизистой оболочки кишечника,
путем вторично-активного
транспорта за
счет градиента концентрации натрия
(симпорт). Всасывание L-аминокислот
является активным, требующим затраты
энергии процессом. Транспорт их
осуществляется двумя путями:
• через
воротную систему печени;
• по
лимфатическим сосудам, сообщающимся
с кровью через грудной лимфатический
проток.
Аминокислоты
конкурируют друг с другом за специфические
участки связывания белков-переносчиков.
Так, всасывание лейцина в больших
количествах уменьшает всасывание
изолейцина и валина. В крови максимальная
концентрация аминокислот достигается
через 30-50 минут после приема белковой
пищи. Свободные аминокислоты, в отличие
от белков пищи, лишены видовой
специфичности и не обладают антигенными
свойствами.
Скорость
проникновения аминокислот через
мембраны клеток различается, что
указывает на существование транспортных
систем, обеспечивающих перенос
аминокислот через мембраны. Известно
пять специфических транспортных систем
для переноса определенной группы
близких по строению аминокислот:
• нейтральных
с короткой боковой цепью (аланин,
серин, треонин);
• нейтральных
с длинной или разветвленной боковой
цепью (валин,
лейцин, изолейцин);
• с
катионными радикалами (лизин,
аргинин);
• с
анионными радикалами (глутаминовая
и аспарагиновая кислоты);
• иминокислот (пролин,
оксипролин).
Переносчики
аминокислот первой и пятой групп, а
также переносчик метионина относятся
к числу Na+-зависимых. Независимые от
Na+ переносчики специфичны для некоторых
нейтральных аминокислот (фенилаланин,
лейцин) и аминокислот с катионными
радикалами (лизин).
Одной из
основных транспортных систем для
нейтральных аминокислот
является γ-глутамильный
цикл, который
функционирует в почках, поджелудочной
железе, печени и селезенке, в мозге и
других тканях он содержится в очень
небольших количествах (рис. 9.3).
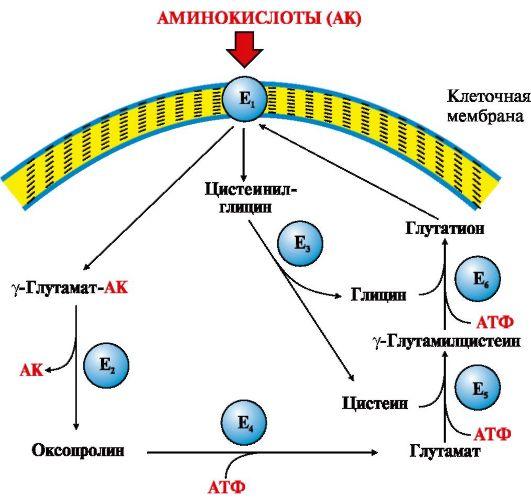 Рис.
Рис.
9.3. γ-Глутамильный цикл:
Е1 —
γ-глутамилтранспептидаза (γ-ГТ); Е2 —
γ-глутамилциклотрансфераза; Е3 —
пептидаза; Е4 —
оксопролиназа; Е5 —
γ-глутамилцистеинсинтетаза; Е6 —
глутатионсинтетаза.
Система
состоит из одного мембранного и пяти
цитоплазматических ферментов. Перенос
аминокислоты внутрь клетки осуществляется
в комплексе с глутамильным остатком
глутатиона под действием фермента
γ-ГТ. Затем аминокислота освобождается,
а γ-глутамильный остаток в несколько
стадий превращается в глутатион, который
способен присоединять следующую
молекулу аминокислоты
Ключевую
роль в работе системы играет мембранный
фермент γ-глутамилтранспептидаза
(γ-ГТ). Этот
гликопротеин катализирует перенос
γ-глутамильной группы с
глутатиона (γ-глутамилцистеинилглицин)
или другого γ-глутамильного пептида
на транспортируемую аминокислоту и
последующий перенос комплекса в клетку.
Глутатион содержится во всех тканях
животных. Для транспорта в клетку одной
молекулы аминокислоты с участием
γ-глутамильного цикла затрачивается
три молекулы АТР.
γ-ГТ в больших
количествах содержится в почках,
поджелудочной железе, печени и других
тканях. Активность фермента в сыворотке
крови в норме составляет 30-50 МЕ/л
(мкмоль/мин-мг) для мужчин и 25-35 МЕ/л для
женщин. Определение активности γ-ГТ в
сыворотке крови используется для
диагностики заболеваний печени и
сердца. γ-ГТ-тест используется также в
качестве маркера рака поджелудочной
железы, печени, предстательной железы
и для обнаружения людей из группы
раннего риска алкоголизма, для контроля
за лечением хронического алкоголизма.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
Панкреатический сок содержит ферменты, которые несут основную функцию в переваривании белков. Переваривание в кишечнике иногда называют панкреатическим перевариванием, поскольку основные ферменты образуются и секретируются поджелудочной железой. Сок поджелудочной железы имеет щелочную реакцию благодаря высокому содержанию HCO3- (около113 мэкв/л в сравнении с 24 мэкв/л в плазме). За сутки секретируется около 1500 мл панкреатического сока за сутки. Желчь и кишечные соки также нейтральны или щелочные, и все эти три секрета нейтрализуют соляную кислоту желудка, повышая pH дуоденального содержимого до 6.0-7.0 и еще более высокими становятся значения рН в нижних отделах тонкого кишечника.
Протеазы сока поджелудочной железы секретируются в неактивной форме и подвергаются координированному активированию, инициатором которого является кишечный фермент энтеропептидаза (энтерокиназа), активность которого в свою очередь повышается при попадании панкреатического сока в двенадцатиперстную кишку. Энтеропептидаза содержит 41 % углеводов, что способствует, по-видимому, защите самого фермента от гидролиза. Энтеропептидаза является структурным белком мембраны энтероцитов (щеточной каемки) и катализирует превращение трипсиногена в трипсин, запуская каскад протеолитических превращений и активирование всех панкреатических проферментов.
Трипсиноген представляет одноцепочечную молекулу и под действием энтеропептидазы теряет 6 аминокислот (гексапептид) на N концевом участке молекулы.(Вал-(Асп)4-Лиз) превращаясь в активную форму трипсин. Образующиеся молекулы трипсина могут катализировать активирование трипсиногена (аутокатализ) , участвовать в переваривании белков и активировать другие неактивные протеазы поджелудочной железы и кишечника химотрипсина, эластазы, карбоксипептидаз А и В. Врожденная недостаточность энтеропептидазы приводит к тяжелой белковой недостаточности.
Каждая из протеаз, образующихся в кишечнике обладает специфичностью к определенным пептидным связям в белках. Продукт действия одного фермента может использоваться как субстрат для другого фермента. Специфичность в действии протеиназ обеспечивает взаимодополняющий эффект их действия на белки. Продуктами переваривания белков в желудочно-кишечном тракте является смесь из аминокислот, и олигопептидов (35% — нейтральные и основные аминокислоты, 65% аминокислот остаются в составе олигопептидов)
Специфичность отдельных протеиназ поджелудочной железы и кишечника
| Эндопептидазы | |
| Трипсин | гидролизует пептидные связи, образованные карбоксильными группами основных аминокислот — лиз и арг. |
| Химотрисин | гидролизует пептидные связи, образованные карбоксильными группами ароматических аминокислот ( фен, тир, три). |
| Эластаза | гидролизует пептидные связи, образованные карбоксильными группами маленьких алифатичеких аминокислот (гли, ала, сер). |
| Экзопептидазы | |
| Карбоксипептидаза А | отщепляет нейтральные аминокислоты от С конца пептидов. |
| Карбоксипептидаза В. | отщепляет основные аминокислоты от С конца пептидов |
Дата добавления: 2014-02-18; просмотров: 482; Опубликованный материал нарушает авторские права? | Защита персональных данных | ЗАКАЗАТЬ РАБОТУ
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: На стипендию можно купить что-нибудь, но не больше… 8966 — | 7230 — или читать все…
Читайте также:
Источник
Белки, поступившие в организм с пищей, в желудочно-кишечном тракте (ЖКТ) расщепляются до аминокислот при действии группы протеолитических ферментов — пептидгидролаз по современной номенклатуре; широко известно их тривиальное название — протеазы, или протеиназы. Эти ферменты катализируют гидролитическое расщепление пептидной связи в белках, представляющее собой экзэргоничсский процесс, при котором Д
Свойства пептидгидролаз. Протеолитические ферменты животных и человека изучены достаточно хорошо, в меньшей степени исследованы растительные протеазы.
Для протеолитических ферментов характерен ряд общих свойств и особенностей.
Ферменты, расщепляющие белки, обладают относительной субстратной специфичностью, которая определяется:
- • длиной полипептидной цепи;
- • структурой радикалов аминокислотных остатков, образующих гидролизуемую пептидную связь;
- • положением связи в полипептиде.
Внутренние пептидные связи расщепляются эндопептидазами, концевые — экзопептидазами:

Известно, что скорость гидролиза протеазами денатурированных белков выше, чем нативных, поскольку при денатурации белков (например, в желудке под действием соляной кислоты при pH — 1,5—2,0) становятся доступными для протеолиза внутренние участки полипептидной цепи, ранее плотно упакованные в компактную глобулу.
Все протеолитические ферменты синтезируются в виде неактивных предшественников, называемых зимогенами или проферментами, и таким образом клетки защищены от контакта с активной формой фермента и автолиза. Превращение зимогена в активный фермент происходит путем необратимой кова-

Рис. 24.2. Схема последовательной деградации пишевых белков в желудочно-кишечном тракте
пентнои моошрикации зимогена за счет локального протеолиза, т. е. разрыва одной или нескольких пептидных связей и отщепления ограниченного числа аминокислотных остатков. Это вызывает конформационные изменения в полипептиде, достаточные для формирования пространственной структуры активного центра фермента.
Общая схема деградации белков пищи протеолитическими ферментами в пищеварительном тракте представлена на рис. 24.2.
Расщепление пищевых белков начинается с действия протеолитического фермента желудка — пепсина. Специализированные (периетальные) клетки эпителия желудка секретиру- ют соляную кислоту, создавая в желудке кислую среду (pH — 1,5—2.0). Этот фактор имеет важное значение в переваривании белков: денатурирует белки пищи, оказывает бактерицидное действие, убивая попадающие с пищей микроорганизмы, является инициирующим фактором активации пепсиногена и превращения его в активную форму. Пспсиноген превращается в пепсин после отщепления от него 42 аминокислотных остатков, вначале под действием соляной кислоты (медленно), а затем аутокаталитически (очень быстро). Молекулярная масса пепсиногена 40,4 kDa, пепсина — 32,7 kDa. Пепсин является эндонуклеазой, и его действие приводит к накоплению смеси пептидов; наиболее активно он гидролизует пептидные связи, NH-rpynna которых принадлежит ароматическим аминокислотам — тирозину, фенилаланину, триптофану. В слизистой желудка человека выделен также протеолитический фермент гастриксин, сходный по свойствам с пепсином.
Секреция соляной кислоты активируется гистамином и гормонами гаст- ринами. их образование угнетается гормоном слизистой двенадцатиперстной кишки — секретином и гормоном гипофиза — соматостатином.
Дальнейшее переваривание высокомолекулярных пептидов и белков, не расщепленных пепсином, происходит тремя эндопептидазами, вырабатываемыми поджелудочной железой в виде предшественников — трипсиногена, хи- мотрипсиногена и проэластазы.
Процесс превращения трипсиногена в трипсин происходит под действием фермента, вырабатываемого в клетках слизистой оболочки кишечника — энте- ропептидазы, а затем аутокаталитически под влиянием трипсина и сводится к отщеплению с A-конца полипептида шести аминокислотных остатков (рис. 24.3).
Трипсин обладает сравнительно узкой субстратной специфичностью, разрывая пептидные связи, в образовании которых участвуют карбоксильные группы лизина и аргинина, т. е. основных аминокислот.
В поджелудочной железе синтезируется ряд химотрипсинов (а-, р-, я-хи- мотрипсины) из двух предшественников — химотрипсиногсна А и химотрип- синогена В. Активируются зимогены в кишечнике под действием активного трипсина и химотрипсина.
Химотрипсин обладает более широкой субстратной специфичностью, чем трипсин. Он катализирует гидролиз не только пептидов, но и эфиров, амидов и других ацилпроизводных, хотя наибольшую активность он проявляет по отношению к пептидным связям, в образовании которых принимают участие карбоксильные группы ароматических аминокислот — фенилаланина, тирозина и триптофана.
В поджелудочной железе синтезируется еще одна эндопептидаза — эластаза. Название фермент получил от субстрата эластина, который он гидролизует. Эластин богат глицином и аланином, содержится в соединительной ткани. Эластаза обладает широким спектром действия, гидролизуя субстраты, не расщепляемые трипсином и химотрипсином.

Рис. 24.3. Активация протеиназ в кишечнике
В переваривании нативных белков и продуктов их гидролиза в тонком кишечнике активное участие принимают экзопептидазы. Карбоксипептидазы синтезируются в неактивном состоянии в поджелудочной железе и активируются трипсином в кишечнике. Карбокс и пептидаза А гидролизует пептидные связи С-концевых аминокислот, образованные преимущественно ароматическими аминокислотами (фенилаланин, тирозин, триптофан), а карбоксипеп- тидаза В — связи, в образовании которых участвуют С-концевые лизин и аргинин.
Аминопсптидазы вырабатываются в клетках слизистой оболочки кишечника (энтсроцитах) сразу в активной форме. Из кишечного сока выделены два типа аминопептидаз, различающиеся по субстратной специфичности — ала- нинаминопептидаза и лейцинаминопептидаза, первая из которых гидролизует пептидную связь, образованную W-концевым аланином, а вторая способна гидролизовать практически любую пептидную связь, образованную УУ-конце- вой аминокислотой.
Процесс переваривания пептидов, их расщепление до свободных аминокислот в тонком кишечнике завершают три- и дипептидазы.
При избыточном потреблении животных жиров и ряде патологий в нижних отделах кишечника возможно развитие гнилостных и бродильных процессов. При действии микрофлоры кишечника происходят превращения аминокислот, получившие название гниения белков в кишечнике. Так, в процессе глубокого распада серосодержащих аминокислот (цистина, цистеина и метионина) в кишечнике образуются сероводород H2S и меркаптан CH3SH. Диаминокислоты, в частности орнитин и лизин, подвергаются процессу дс- карбоксилирования с образованием диаминов, иногда называемых трупными ядами, поскольку они образуются также при гнилостном разложении трупов. Из орнитина образуется путресцин, а из лизина — кадаверин:

Следует отметить, что сравнительно недавно в животных тканях был открыт фермент, катализирующий декарбоксилирование орнитина. Путресцин (продукт этой реакции) наряду с 5-аденозил гомоцистеином (продуктом декар- боксилирования 5-аденизилметионина) участвует в синтезе биологически важных полиаминов — спермина и спермидина:

Полиамины, в том числе и диамин иутресцин, содержатся практически во всех тканях и входят в основном в состав ядерного хроматина. Известно их участие в регуляции клеточного деления, однако молекулярные механизмы их действия остаются не до конца выясненными.
Из фенилаланина, тирозина и триптофана при бактериальном декарбок- силировании образуются соответствующие биогенные амины: фенилэтил- амин, /7-гидроксифенилэтиламин (или тирамин) и индолилэтиламин (трипт- амин); при постепенном разрушении боковых цепей циклических аминокислот, в частности тирозина и триптофана, образуются ядовитые продукты обмена: соответственно крезол и фенол, скатол и индол:

Индол и скатол обезвреживаются в печени, предварительно окисляясь соответственно в индоксил и скатоксил, выводятся из организма в виде парных соединений, вступая в реакцию конъюгации с З-фосфоаденозин-5-фосфо- сульфатом (ФАФС) или уридиндифосфатглюкуроновой кислотой (УДФГК).
В качестве примера приведена реакция детоксикации индола, которая заканчивается образованием животного индикана, выводимого с мочой:

Источник


