Ph амилазы поджелудочной железы
Медицина / Физиология / Физиология (статья)
Физиология поджелудочной железы. Панкреатический сок. Амилаза
Статья |
9-08-2018, 12:53
|
 Поджелудочная железаПоджелудочная железа представляет собой орган бледно-желтого цвета, мягкой консистенции, длина которого составляет примерно 12-15 сантиметров, масса около 100 г; расположена поперечно в верхней части живота. Форма поджелудочной железы напоминает цилиндр с хорошо различимыми хвостом, телом и головкой. Головка поджелудочной железы находится в изгибе двенадцатиперстной кишки, тело находится за желудком, хвост направлен к селезенке (см рисунок).
Поджелудочная железаПоджелудочная железа представляет собой орган бледно-желтого цвета, мягкой консистенции, длина которого составляет примерно 12-15 сантиметров, масса около 100 г; расположена поперечно в верхней части живота. Форма поджелудочной железы напоминает цилиндр с хорошо различимыми хвостом, телом и головкой. Головка поджелудочной железы находится в изгибе двенадцатиперстной кишки, тело находится за желудком, хвост направлен к селезенке (см рисунок).
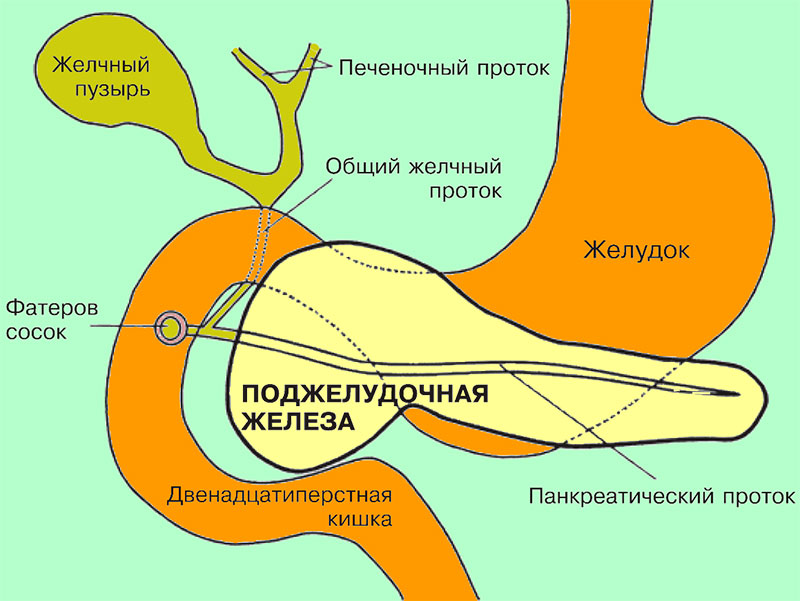
Поджелудочная железа и ее расположение по отношению к другим органам
Гистологическое строение поджелудочной железы представляет собой сложную альвеолярную структуру, состоящую из двух основных видов ткани, которые осуществляют внешнесекреторную (экзокринную) и внутрисекреторную (эндокринную) деятельность. Большая часть тканей органа выполняют экзокринную функцию. Примерно 90% поджелудочной железы занимает ацинарная ткань, в которой образуется панкреатический сок – жидкость для переваривания пищи в кишечнике.
Ацинарная ткань состоит из миллионов ацинусов – ационарных клеток, которые окружают микроскопические выводные протоки. Ацинус – функциональная единица ткани поджелудочной железы, внешне напоминающие виноградные гроздья. Мелкие выводные протоки объединяются, формируя крупные протоки, в которые из всех ацинусов собирается панкреатический сок и выводится в вирсунгов проток (панкреатический проток; лат. ductus pancreaticus) – главный (центральный) проток железы, который проходит вдоль всего органа. Вирсунгов проток выходит из головки поджелудочной железы и объединяется с общим желчным протоком возле фатерова соска (располагается в стенке двенадцатиперстной кишки). В фатеровом соске находится гладкая мышца – сфинктер Одди. Через сфинктер Одди в просвет двенадцатиперстной кишки поступают желчь и панкреатический сок.
Отметим, что примерно у 20% людей проток поджелудочной железы отдельно впадает в кишечник (на 1-2 см выше фатерова соска).
Среди ацинарной ткани расположены островки поджелудочной железы – островки Лангерганса, — группы клеток поджелудочной железы, выполняющих внутрисекреторную (эндокринную) функцию, наибольшее скопление которых находится в хвосте поджелудочной железы. Островки Лангерганса не связаны с протоками поджелудочной железы – они окружены кровеносными сосудами (капиллярами); их основная функция – продукция панкреатических гормонов. Островки Лангерганса состоят их трех основных типов клеток – α, β и δ. Каждый тип этих клеток отвечает за производство разных гормонов. В α-клетках поджелудочной железы продуцируется глюкагон, в β-клетках (эти клетки наиболее многочисленные) – инсулин, в δ-клетках – соматостатин. Эти гормоны поступают непосредственно в кровь и принимают участие в метаболизме.
Глюкагон и инсулин участвуют в регуляции углеводного обмена. Более подробно с функциями этих гормонов можно ознакомится в статье «Физиология углеводного обмена».
Панкреатический сок
Панкреатический сок – экзокринный продукт ационарной ткани поджелудочной железы, представляющий собой щелочную жидкость (pH примерно 8), в которой содержаться разные электролиты (в том числе ионы калия, хлора, натрия, бикарбоната) и пищевые ферменты. Электролиты в панкреатическом соке присутствуют в той же концентрации, что и в плазме крови (за исключением бикарбоната, концентрация которого примерно в 4 раза выше, чем в плазме, что обуславливает щелочную реакцию панкреатического сока).
В двенадцатиперстную кишку поступает примерно 1500-3000 мл панкреатического сока в сутки. Основная функция панкреатического сока заключается в ферментативном расщеплении пищи в тонкой кишке (отметим, что процесс пищеварения (ферментативного расщепления) начинается в ротовой полости, затем в желудке и двенадцатиперстной кишке). Благодаря своей щелочной среде, панкреатический сок ощелачивает (до pH 7-7,5) кислое содержимое желудка (частично переваренная пища), которое поступает из желудка в двенадцатиперстную кишку, таким образом панкреатические ферменты могут полноценно выполнять свою функцию.
В зависимости от субстрата воздействия, ферменты панкреатического сока делят на три группы:
- Амилаза – расщепляет углеводы
- Липаза – расщепляет жиры
- Протеаза – расщепляет протеины (белки)
Отметим, что амилаза и липаза секретируются в активной форме, а протеаза – в виде проферментов, которые способны расщеплять протеины только после активации (вступления в связь (реакцию) с другими веществами) в двенадцатиперстной кишке. Например, трипсин (кишечный протеолитический фермент) образуется из трипсиногена – неактивного панкреатического профермента. Таким образом, секреция протеаз в виде неактивных проферментов защищают саму поджелудочную железу от ферментативного разрушения.
Состав и объем панкреатического сока регулируется в основном гормонами. Холецистокинин (панкреозимин) – нейропептидный гормон, секретирующийся в двенадцатиперстной и тонкой кишке в ответ на поступление пищи из желудка. Основная функция холецистокинина – синтез пищевых ферментов в ацинарных клетках. Секретин – пептидный гормон, секретируемый в тонкой кишке, стимулирующий секрецию бикарбоната в ацинарных клетках.
Нервная система также участвует в регуляции образования панкреатического сока. Мысли о еде, запах и вид пищи, а также наличие ее в ротовой полости, стимулируют блуждающий нерв, который в свою очередь стимулирует секрецию панкреатического сока. Сфинктер Одди, расположенный в фатеровой (печеночно-поджелудочной) ампуле, отвечает за непосредственную регуляцию поступления панкреатического сока в просвет двенадцатиперстной кишки – при поступлении пищи сфинктер открывается.
То есть, объем, состав и выделение панкреатического сока регулируются с помощью нервно-гуморальных механизмов и зависят от текущих пищеварительных потребностей организма.
Когда панкреатический сок выполнил свою функцию, 99% содержащихся в нем жидкости и электролитов при прохождении через толстую кишку всасываются обратно в кровь.
Амилаза
Амилаза – пищеварительный фермент, входящий в состав пищеварительного сока и слюны (слюна выделяется в ротовой полости тремя парами слюнных желез). Слюнная и панкреатическая амилаза функционируют только в желудочно-кишечном тракте, расщепляя крахмал – основная форма углеводной пищи, является крупным полимером, мономером которого является глюкоза. В результате действия амилазы на крахмал образуется смесь трех видов молекул:
- Дисахарид мальтозы (состоит из двух объединенных между собой молекул глюкозы
- Декстрин (полисахарид, представляющий собой короткие цепи, состоящие примерно из восьми молекул глюкозы)
- Глюкоза
Глюкоза, которая образуется в результате расщепления крахмала амилазой, через слизистую оболочку кишечника попадает в кровь. Мальтоза и декстрин поддаются дальнейшему ферментативному расщеплению мальтазой и изомальтазой (кишечные ферменты), в результате чего образуются молекулы глюкозы, которые могут усваиваются, попадая в кровь.
Амилаза, как и другие ферменты, эффективно действует только в ограниченных пределах кислотно-щелочного баланса (pH). Оптимальный pH для действия амилазы составляет 7,1.
Процесс ферментативного расщепления крахмала амилазой, содержащейся в слюне, начинается в ротовой полости в процессе пережевывания пищи. Когда пищевой комок попадает в желудок, pH которого 2-3, действие слюнной амилазы прекращается. Если пища во рту находится недолго, слюнная амилаза расщепляет лишь незначительную часть крахмала – основная его часть поддается ферментативному расщеплению панкреатической амилазой в двенадцатиперстной и тощей кишках.
В нормальном (здоровом состоянии) незначительное количество амилазы попадает в кровь. Основное количество амилазы попадает в кровь из поджелудочной железы, из слюнных желез в кровь поступает лишь незначительная ее часть. Попадая в результате физиологического обновления клеток поджелудочной и слюнных желез в кровь, амилаза не выполняет каких-либо функций. Поскольку молекула амилазы имеет небольшие размеры, по сравнении с другими ферментами, она способна проникать через клубочки почек и относится к числу немногих ферментов, обнаруживаемых в норме в моче.
Источник
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 25 ноября 2017;
проверки требуют 3 правки.
Структура амилазы слюнных желез. Катион кальция показан жёлтым цветом, анион хлора — зелёным.
Амила́за (др.-греч. ἄμυλον — крахмал) — фермент, гликозил-гидролаза, расщепляющий крахмал до олигосахаридов, относится к ферментам пищеварения. В истории амилаза стала первым открытым ферментом, когда французский химик Ансельм Пайен описал в 1833 году диастазу[en]* — фермент (на самом деле, смесь ферментов), расщепляющий крахмал до мальтозы. Согласно другим данным, амилазу в 1814 году открыл академик петербургской Академии наук К. С. Кирхгоф. Именно амилаза приводит к появлению сладковатого вкуса при длительном пережёвывании крахмалосодержащих продуктов (например, из риса или картофеля), но без добавления сахара. Амилаза присутствует в слюне (птиалин), где начинает процесс пищеварения. Расщепляет α-1,4-гликозидную связь.
Классификация[править | править код]
По субстратной специфичности амилазы классифицируют на альфа-, бета- и гамма-амилазу.
α-Амилаза[править | править код]
α-Амилаза (1,4-α-d-глюкан-глюкагоногидролаза, гликогеназа; шифр КФ — 3.2.1.1) является кальций-зависимым ферментом. К этому типу относятся амилаза слюнных желез и амилаза поджелудочной железы[1]. Она способна гидролизовать полисахаридную цепь крахмала и других длинноцепочечных углеводов в любом месте. Таким образом, процесс гидролиза ускоряется и приводит к образованию олигосахаридов различной длины. У животных α-амилаза является основным пищеварительным ферментом. Активность α-амилазы оптимальна в нейтральной среде (pH = 6,7—7,0). Фермент обнаружен также у растений (например, в овсе), в грибах (в аскомицетах и базидиомицетах) и бактериях (Bacillus).
β-Амилаза[править | править код]
β-Амилаза (1,4-α-d-глюкан-мальтогидролаза; шифр КФ — 3.2.1.2) присутствует у бактерий, грибов и растений, но отсутствует у животных. Она отщепляет вторую с конца α-1,4-гликозидную связь, образуя, таким образом, дисахарид мальтозу. При созревании фруктов β-амилаза расщепляет плодовый крахмал на сахара́, что приводит к сладкому вкусу зрелых плодов. В семенах β-амилаза активна на стадии, предшествующей прорастанию, тогда как α-амилаза важна при непосредственно прорастании семени.
β-Амилаза пшеницы является ключевым компонентом при образовании солода. Бактериальная β-амилаза участвует в разложении внеклеточного крахмала.
γ-Амилаза[править | править код]
γ-Амилаза (1,4-α-d-гликан-глюкогидролаза, глюкан-1,4-α-глюкозидаза, амилоглюкозидаза, экзо-1,4-α-глюкозадаза, глюкоамилаза, лизосомальная α-глюкозидаза; шифр КФ — 3.2.1.3) отщепляет последнюю α-1,4-гликозидную связь, приводя к образованию глюкозы. Кроме этого, γ-амилаза способна гидролизовать α-1,6-гликозидную связь. В отличие от других амилаз, γ-амилаза наиболее активна в кислых условиях (при pH = 3).
Применение[править | править код]
Некоторые виды дрожжей способны разлагать крахмал с помощью амилазы до ди- и трисахаридов, которые потом используются в жизнедеятельности, образуя в результате этанол, углекислый газ (CO2) и другие метаболиты, которые придают хлебу специфический вкус и «поднимают» тесто. Но пекарские дрожжи (Saccharomyces cerevisiae) этого не могут, поэтому в современных хлебопекарных технологиях амилаза используется как одно из важных составляющих специальной добавки. Добавление амилазы в тесто позволяет использовать для жизнедеятельности дрожжей часть крахмала муки, ускоряя тем самым процесс брожения, и одновременно позволяет изготовителю хлеба сэкономить, уменьшив количество используемого сахара.[источник не указан 747 дней]
Бактериальная амилаза используется в стиральных порошках для разложения крахмала, присутствующего в белье.
В пищевой промышленности амилаза зарегистрирована в качестве пищевой добавки E1100 как улучшитель муки и хлеба.
Примечания[править | править код]
Ссылки[править | править код]
- Амилаза в словаре
Источник
α‑Амилаза (диастаза, 1,4‑a‑D‑глюкангидролаза, КФ 3.2.1.1.) катализирует гидролиз α‑1,4‑глюкозидных связей крахмала, гликогена и родственных им полисахаридов до мальтозы, декстринов и других полимеров. Молекулярная масса фермента около 48000 Д. В состав молекулы входит атом кальция, который не только активирует фермент, но и защищает его от действия протеиназ, активность амилазы возрастает при влиянии ионов хлора. В крови она представлена двумя изоферментами: панкреатическим — P‑тип и слюнным — S‑тип, каждый из которых делится на несколько фракций. Изофермент S‑типа составляет в целом 45‑70% (в среднем 57%), остальное приходится на долю P‑типа. Оба изофермента имеют почти идентичные каталитические и иммунологические свойства, незначительно отличаются по электрофоретической подвижности, но хорошо разделяются при гель‑фильтрации на ДЭАЭ‑сефадексе. Существует также макроамилаза, которая не выделяется почками, но может встречаться в сыворотке крови в норме (около 1 % здоровых людей) и патологии (2,5 %).
Высокая активность амилазы наблюдается в околоушной и поджелудочной железах. Вместе с тем, ее активность, хотя и намного ниже, обнаруживается в толстом и тонком кишечнике, скелетных мышцах, печени, почках, легких, фаллопиевых трубах, жировой ткани. В крови фермент связан как с белками плазмы крови, так и с форменными элементами. Активность фермента одинакова у мужчин и у женщин и не зависит от характера принимаемой пищи и времени суток.
Существующие методы изучения активности a‑амилазы в биологических жидкостях делятся на две большие группы:
1. Сахарифицирующие (редуктометрические), основанные на исследовании образующихся из крахмала сахаров по редуцирующему действию глюкозы и мальтозы.
2. Амилокластические, базирующиеся на определении остатка нерасщепленного крахмала:
- по степени интенсивности его реакции с йодом. Эти методы более чувствительны и специфичны, но точность их во многом зависит от качества крахмала и оптимизации условий определения.
- по вязкости суспензии крахмала, не отличаются высокой точностью и сейчас не применяются.
3. Методы с применением хромогенных субстратов –– основаны на использовании комплексов субстрат‑краситель, которые под действием α‑амилазы распадаются с образованием водорастворимого красителя.
4. Методы, основанные на сопряженных ферментативных реакциях:
Крахмал + Н2О Мальтоза + Мальтотриоза + Декстрин
Мальтоза + Н2О 2 Глюкоза
Глюкоза + АТФ Глюкозо‑6‑Ф + АТФ
Глюкозо‑6‑Ф+НАДФ Глюконат‑6‑Ф + НАДФН
Активность фермента устанавливается по скорости накопления НАДФН.
В качестве унифицированных утверждены два амилокластических метода: Каравея (со стойким крахмальным субстратом) и Смита‑Роэ.
Определение активности амилазы с окрашенным
субстратом по набору фирмы «Lachema»
Принцип
α‑Амилаза катализирует гидролиз нерастворимого цветного крахмального субстрата с образованием синего, растворимого в воде красителя. Количество освобожденного красителя пропорционально каталитической активности фермента.
Нормальные величины
| Сыворотка | указанный метод | 2,3‑5,8 мккат/л |
| по Каравею | 12‑32 мг/с·л | |
| по Смиту‑Рое | 4,4‑8,3 мг/с·л | |
| У новорожденных значения активности ниже в 2‑5 раз. | ||
| Моча | указанный метод | 16,6‑33,3 мккат/л |
| по Каравею или Смиту‑Рое | < 44 мг/с·л | |
| Дуоденальное содержимое | по Каравею | 1,7‑4,4 г/с·л |
Влияющие факторы
Завышение результатов наблюдается при стрессовых состояниях, при сокращении сфинктера Одди под воздействием, например, наркотических анальгетиков, сниженные результаты получаются при использовании оксалата и цитрата.
Клинико‑диагностическое значение
Повышение активности фермента происходит главным образом при заболеваниях поджелудочной железы. При остром панкреатите активность в крови и моче возрастает в 10‑30 раз. Гиперамилаземия наступает в начале заболевания, достигает максимума к 12‑24 ч, затем снижается и приходит к норме на 2‑6 день. Однако при тотальном панкреонекрозе может не отмечаться повышение активности амилазы. Возрастание активности фермента выявляется при беременности, почечной недостаточности, кишечной непроходимости, заболеваниях желчных путей, диабетическом кетоацидозе, некоторых опухолях легких и яичников, поражении слюнных желез. Выявление повышенного количества изоферментов P‑ или S‑типа не патогномонично для какого‑либо заболевания.
Низкие уровни фермента в сыворотке крови не имеют существенного значения.
Источник
Что такое панкреатическая амилаза.

Поджелудочная железа — место образования панкреатической амилазы
Процесс пищеварения — многоуровневая система, одним из элементов которой является расщепление всех составляющих пищи. В организме эту работу выполняют различные ферментные соединения. Амилаза — фермент, который одним из первых запускает пищеварительную цепочку, так как присутствует в слюне и панкреатическом соке. Кишечник, печень, мышцы и яичники содержат небольшое количество этого биологически активного вещества. Обобщённую численность фермента в организме называют альфа-амилазой.
Амилазу, входящую в состав пищеварительного сока, называют панкреатической. Панкреатическая амилаза (Р-амилаза) способствует распаду высокомолекулярных углеводов, преобразуя их в глюкозу. Основное поле её деятельности — тонкий кишечник, где обеспечена благоприятная среда для переваривания углеводов. Небольшое количество фермента циркулирует в плазме крови, нейтрализуется печенью, а из организма выводится вместе с мочой.
От действия амилазы зависит уровень усвоения углеводов и степень всасывания кишечником сложных элементов. Без этого важного фермента организм не смог бы получать необходимые ему питательные вещества, так как не в состоянии принимать сложные соединения в том виде, в котором они поступают с пищей.
Нормы уровня амилазы.

Альфа-амилаза
При обновлении клеток слюнной и поджелудочной желёз, единицы амилазы попадают в общий кровоток. У здорового человека содержание этого фермента должно быть невысоким. Незначительные отклонения могут быть при стрессах, переутомлении и нарушенном режиме питания. Кратковременные нарушения показателей сопровождают отравления. Слишком высокая или низкая концентрация ферментов свидетельствует о развитии болезни.
Врач может назначить исследование как общей, так и отдельно Р-амилазы.
| альфа-амилаза | |
|---|---|
| от 0 до 2 лет | 5-65 Ед/л; |
| от 2 до 65 лет | 25-125 Ед/л; |
| 70 лет и старше | 20-160 Ед/л; |
| Р-амилаза | |
| от 0 до 6 месяцев | 0-8 Ед/мл; |
| от 6 до 12 месяцев | 0-23 Ед/мл; |
| старше 1 года | 0-50 Ед/мл; |
Уровень амилазы в моче тоже является одним из показателей при диагностировании пациента. При естественном процессе очищения организма, границы содержания фермента в моче должны быть в пределах от 1 до 17 ед/л.
Диагностика.
Подготовка к тесту — важное условие верного результата
Показаниями для обследования количества амилазы являются:
- расстройство пищеварения (рвота, диарея, постоянная тошнота),
- снижение аппетита на фоне общего недомогания (слабость, нарушение сна),
- заболевания поджелудочной железы,
- боли в животе (синдром острого живота),
- поражение желез внешней секреции,
- воспаление слюнных желез.
В большинстве случаев диагностируют уровень содержания фермента при опасении образования воспалительных процессов в области поджелудочной железы. Повреждённые ткани железы продуцируют выброс амилазы в кровяное русло. Количество высвобождаемого биологически активного вещества может превышать норму в десятки раз. Ферменты заполняют плазму уже в первые часы болезни, достигая максимальной активности через сутки.

«Нет» жирному и острому накануне теста
Показатели циркуляции ферментов в крови очень важны, поэтому подготовиться к сдаче анализа нужно заранее.
- Избегать употребления острой пищи и жиров.
- Не употреблять алкоголь.
- Исключить переедание.
- Не курить.
- Привести своё эмоциональное состояние в равновесие.
- Сообщить доктору о возможном приёме анаболических стероидов, диуретиков, обезболивающих лекарств, гормональных контрацептивов и других медицинских препаратов.
Повышенный уровень панкреатической амилазы: причины, лечение.
Холецистит может приводить к повышению концентрации амилазы
Увеличение концентрации биологически активного вещества — верный признак деструктивного процесса в организме.
Факторы, способствующие росту активности амилазы:
- панкреатит (острый либо хронический);
- воспалительные процессы в желчном пузыре (в том числе образование камней в желчных протоках);
- эпидемический паротит;
- поражение почечной ткани;
- болезни железистых органов;
- появление новообразований, опухолей;
- воспаление отростка слепой кишки;
- диабет;
- отравление;
- травмы живота;
- прерывание беременности.
В основе лечения лежит устранение причины высокой циркуляции фермента в организме. В первую очередь необходимо отрегулировать режим питания и отказаться от применения спиртосодержащих напитков. Каждый отдельный случай требует особого подхода. Чаще всего при росте амилазы назначаются следующие терапевтические процедуры:
- Специальная диета или голодание.
- Капельницы с солевым раствором.
- Препараты, подавляющие активность энзимов.
- Наркотические анальгетики.
- Приём ферментных препаратов.
Пониженный уровень панкреатической амилазы: причины, лечение.

Вирусное поражение печени приводит к снижению амилазы
Низкая концентрация энзима не является основным показателем при исследовании. Чаще всего результат анализа служит вспомогающим фактором наряду с другими обследованиями.
Факторы, способствующие снижению активности:
- предшествующее обследованию удаление поджелудочной железы;
- разрушение тканей поджелудочной железы;
- онкологические образования в кишечнике, желудке, печени;
- гепатит в острой или хронической фазе;
- нарушение обмена веществ;
- токсикоз при беременности.
Слишком низкая активность амилазы влечёт за собой негативные изменения в углеводном обмене. Лечение, как и при повышенном уровне фермента, заключается в оптимизации рациона питания. Необходимо устранить любой алкоголь, жирную и острую пищу, кофе, шоколад.
Повысить уровень амилазы помогут:
- Диета с пониженным содержанием крахмала. Следует свести к минимуму потребление круп, мучных изделий, картофеля. Это необходимо для того, чтобы снизить нагрузку на ферменты, которых и так недостаточно в организме.
- Препараты с амилазой. Дополнительным источником энзимов служат ферментные препараты. Панкреатин, Панкреон, Мезим, Фестал, Креон — самые популярные из них.
Отклонения от нормы в показателях анализов не должны стать предпосылкой для самолечения. Следует обязательно обратиться к гастроэнтерологу или терапевту, которые назначат схему лечения.
Источник

