Поджелудочная железа эксперименты на животных
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Лазаренко Л.В.
1
Косарева П.В.
2
1 ФКОУ ВО Пермский институт ФСИН России
2 ФГБОУ ВО Пермский государственный национальный исследовательский университет
Целью исследований было провести оценку патоморфологических изменений в ткани поджелудочной железы крыс, индуцированных длительным применением карпрофена, относящегося к группе нестероидных противовоспалительных препаратов (НПВП). Для изучения реактивных изменений в ткани органа были сформированы четыре экспериментальные группы животных, которые получали разные дозировки препарата: терапевтическую, двукратную, пятикратную и десятикратную. Выявленные нарушения указывали на токсическое действие препарата, наиболее характерными признаками были гемодинамические нарушения, белковая дистрофия и склеротические изменения (фиброз), которые имели дозозависимый эффект. При увеличении дозы препарата нарастала выраженность некротических процессов в ткани, которые сопровождались появлением двуядерных клеток. Обнаруженная жировая дистрофия экзокриноцитов может быть связана с развитием оксидативного стресса. При небольших дозировках карпрофена морфологическая картина соответствовала серозно-инфильтративной (отечной) форме панкреатопатии, при высоких – наблюдался геморрагический или негеморрагический панкреонекроз (мелкоочаговый, крупноочаговый, субтотальный). Видимых нарушений структуры эндокринных островков обнаружено не было, тем не менее можно предполагать, что развитие гемодинамических и склеротических процессов в паренхиме оказывает действие на состояние эндокринных клеток. Полученные данные требуют более детального исследования, базирующегося на изучении патогенеза поражения поджелудочной железы при приеме НПВП.
карпрофен
нпвп-панкреатопатия
гистопатологические изменения
1. Кемельман Е.Л. Оценка частоты возникновения гастроэнтерологических осложнений при назначении собакам карпрофена в комбинации с омепразолом / Е.Л. Кемельман, К.С. Варенов, А.А. Архипова // Российский ветеринарный журнал. 2015. № 1. С. 16-19.
2. Forsyth S.F., Guilford W.G., Haslett S.J., Godfrey J. Endoscopy of the gastroduodenal mucosa after carprofen, meloxicam and ketoprofen administration in dogs // JSAP. 1998. № 39 (9). P. 421-424.
3. Monteiro-Steagall B.P., Steagall P.V., Lascelles B.D. Systematic review of nonsteroidal anti-inflammatory drug-induced adverse effects in dogs // Journal of Veterinary Internal Medicine. 2013. № 27. P. 1011-1019.
4. Сравнительная оценка безопасности применения нестероидных противовоспалительных средств при лечении собак с нарушениями опорно-двигательной функции конечностей / Л.С. Барсегян [и др.]. // Российский ветеринарный журнал. 2015. № 6. С. 18-21.
5. Dоbrоnte Z., Toldy E., Mаrk L., Sarang K., Lakner L. Effects of rectal indomethacin in the prevention of post-ERCP acute pancreatitis // Orvosi Hetilap. 2012. № 25. P. 990-996.
6. Lee S.C., Dalia S.M. Drug-induced chronic pancreatitis // Med Health R I. 2012. № 1. P. 19-20.
7. Mark R. Jones, O. Morgan Hall, Adam M. Kaye, Alan David Kaye. Drug-Induced Acute Pancreatitis: A Review // The Ochsner Journal. 2015. № 15. P. 45-51.
8. Pezzilli R., Morselli-Labate A.M., Corinaldesi R. NSAIDs and Acute Pancreatitis: A Systematic Review // Pharmaceuticals. 2010. № 3. P. 558-571.
9. Патоморфологические изменения ткани поджелудочной железы крыс при длительном приеме нимесулида / Л.В. Лазаренко [и др.] // Пермский медицинский журнал. 2016. № 4. С. 78-81 .
Нестероидные противовоспалительные препараты (НПВП) широко используются в клинической ветеринарной практике, чаще всего они назначаются при заболеваниях опорно-двигательного аппарата, как правило, длительными курсами. Ассортимент НПВП ветеринарного назначения достаточно разнообразен, но чаще, чем другие НПВП, при лечении животных назначается карпрофен [1]. Препарат является селективным ингибитором ЦОГ-2, предназначен для домашних животных.
Карпрофен считается одним из наиболее безопасных НПВП [2], однако его использование связано с определенным риском побочных эффектов со стороны желудочно-кишечного тракта [2-4]. Имеются сведения о гепатотоксическом действии карпрофена [1; 4]. Информация о негативном действии препарата на поджелудочную железу отсутствует. Между тем в научной литературе встречаются сообщения о том, что НПВП могут быть причиной развития острого и хронического панкреатита [5-7]. На сегодняшний день патогенез НПВП-панкреатопатии не изучен, одной из гипотез является возможность индуцирования препаратами данной группы оксидативного стресса в клетках железы [8].
Таким образом, сведения о поражении поджелудочной железы у людей и животных, связанные с приемом НПВП, крайне немногочисленны, тем не менее этот вопрос представляет несомненный интерес.
Цель исследований. Оценить характер поражения ткани поджелудочной железы у экспериментальных животных при моделировании НПВП-панкреатопатии с использованием различных дозировок карпрофена.
Материалы и методы исследования. Моделирование НПВП-индуцированного поражения поджелудочной железы у нелинейных белых крыс (самцы и самки) c массой тела 200-250 г осуществляли путем перорального введения карпрофена (препарат Римадил Р, Pfizer Animal Health, США) в течение 21 дня. Было сформировано четыре экспериментальные группы животных, получавших препарат в следующих дозировках: 4 мг/кг (терапевтическая доза, рекомендованная производителем, n=26); 8 мг/кг (n=28), 20 мг/кг (n=22), 40 мг/кг (n=24). Препарат давали на фоне обычного пищевого режима один раз в день за час до кормления.
По окончании исследований животных выводили из эксперимента путем перерезки спинного мозга под эфирным наркозом с соблюдением правил эвтаназии. После наступления биологической смерти животного для проведения гистологического исследования забирали печень и поджелудочную железу. Все эксперименты выполнены в соответствии с «Правилами лабораторной практики в Российской Федерации» (утвержденные Приказом Министерства здравоохранения РФ № 708н от 23 августа 2010 г.) и «Европейской конвенцией о защите позвоночных животных, используемых для экспериментов или в иных научных целях» от 18 марта 1986 г.
Гистологическое исследование выполнено стандартными методиками. Срезы окрашивали гематоксилином и эозином.
Результаты, полученные при проведении гистологического исследования образцов тканей от животных экспериментальных групп, сравнивали с результатами, полученными при исследовании биоматериала, полученного от животных контрольной группы (интактные животные, n=21). Для проведения статистического анализа использован критерий Стьюдента.
Результаты исследования и их обсуждение. У животных контрольной группы (интактных) гистологическая картина ткани поджелудочной железы соответствовала видовой норме. Экзокринная часть поджелудочной железы была представлена панкреатическими дольками, образованными многочисленными панкреатическими ацинусами с секреторными отделами, визуализировались выводные протоки: вставочные, внутридольковые, междольковые. В междольковых перегородках из соединительной ткани хорошо выявлялись кровеносные сосуды и немногочисленные междольковые выводные протоки. Эндокринная часть была представлена островками округлой формы, образованными эндокриноцитами, недифференцируемыми по типам при обычных методах гистологического окрашивания, в островках отчетливо визуализировались кровеносные капилляры синусоидного типа (рис. 1).
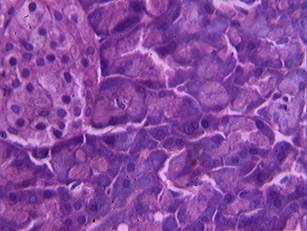
Рис. 1. Экзокринные ацинусы, хорошо визуализируются зимогенные гранулы в экзокриноцитах; эндокринный островок (интактные животные).
Окраска гематоксилином и эозином, х 600
Для полного представления о действии карпрофена на поджелудочную железу были сформированы четыре экспериментальные группы животных, которые получали разные дозировки препарата. Во время эксперимента в группах, получавших пяти- и десятикратную дозу, отмечалась гибель животных. При просмотре гистологических препаратов ткани железы, полученной от животных всех групп, наблюдались изменения, характерные для токсического поражения.
У животных, получавших терапевтическую дозу (4 мг/кг), наблюдалось выраженное полнокровие кровеносных сосудов поджелудочной железы в 61,5% случаев, у пяти животных (19,2%) отмечался умеренный отек межацинарной соединительной ткани. У большей части животных группы в паренхиме железы выявлялись ограниченные участки белковой (вакуольной) (57,7%) и жировой (61,5%) дистрофии экзокриноцитов, нарушающие структуру ацинусов (рис. 2).
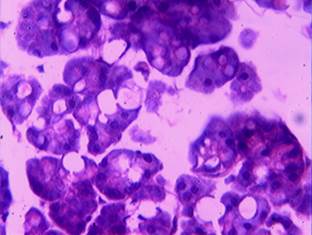
Рис. 2. Участок вакуольной и жировой дистрофии экзокриноцитов в поджелудочной железе (терапевтическая доза). Окраска гематоксилином и эозином, х 600
У пяти животных (19,2%) обнаружен фиброз междольковой соединительной ткани. В 38,5% случаев отклонений от гистологической нормы ткани поджелудочной железы у животных этой группы выявлено не было.
В ткани железы всех животных, получавших дозу, в два раза превышающую терапевтическую (8 мг/кг), отмечалось полнокровие кровеносных сосудов (100%). У 75% животных группы в паренхиме железы выявлена вакуольная дистрофия, а также отек межацинарной и междольковой соединительной ткани. Некроз экзокриноцитов с нарушением структуры ацинусов наблюдался у двадцати животных (71,4%), в местах некроза отмечались реактивные процессы в ткани железы – появление двуядерных клеток (рис. 3).
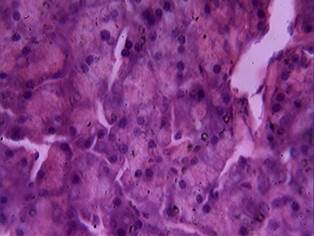
Рис. 3. Белковая (вакуольная) дистрофия экзокриноцитов, участки некроза и появление двуядерных клеток (доза 8 мг/кг). Окраска гематоксилином и эозином, х 600
У пятнадцати животных (53,6%) выявляли фиброз междольковой соединительной ткани.
У животных, получавших карпрофен в пятикратной дозировке (20 мг/кг), при гистологическом исследовании, помимо полнокровия крупных сосудов (100% случаев), в ткани выявлялись выраженный отек межацинарной и междольковой соединительной ткани, обширные участки вакуольной дистрофии экзокриноцитов и обширные по площади участки некроза с нарушением структуры ацинусов. По периферии зон некроза выявляли большое количество двуядерных клеток. Также у всех животных группы наблюдалось формирование склероза (фиброза) междольковой соединительной ткани (рис. 4).
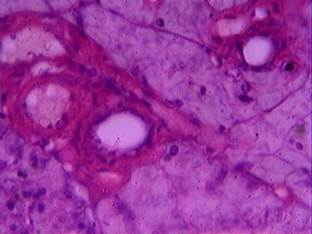
Рис. 4. Тотальный некроз паренхимы поджелудочной железы, фиброз междольковой соединительной ткани (доза 20 мг/кг). Окраска гематоксилином и эозином, х 600
У животных, получавших десятикратную дозировку карпрофена (40 мг/кг) при гистологическом исследовании паренхимы железы в 100% случаев выявлялись обширные участки вакуольной дистрофии экзокриноцитов и обширные по площади участки некроза с нарушением структуры ацинусов, появление двуядерных клеток и фиброзные изменения соединительной ткани. У половины животных отмечались массивные кровоизлияния в паренхиму железы, полнокровие не только крупных сосудов, но и гемокапилляров. Также у животных данной группы в небольшом количестве обнаружены тучные клетки, расположенные в соединительной и жировой ткани, окружающей железу (рис. 5).
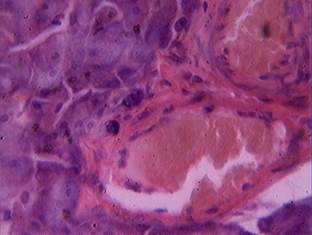
Рис. 5. Дегранулированные тучные клетки в междольковой соединительной ткани поджелудочной железы (доза 40 мг/кг). Окраска гематоксилином и эозином, х 600
В целом патоморфологические изменения в паренхиме поджелудочной железы животных опытных групп выглядели следующим образом (таблица).
Гистопатологические изменения в паренхиме поджелудочной железы у животных экспериментальных групп
Признак | Доза 4 мг/кг, % животных в группе | Доза 8 мг/кг, % животных в группе | Доза 20 мг/кг, % животных в группе | Доза 40 мг/кг, % животных в группе |
Полнокровие сосудов | 61,5 | 100* | 100* | 100* |
Вакуольная дистрофия | 57,7 | 75 | 100* | 100* |
Нарушение структуры ацинусов | 57,7 | 71,4* | 100* | 100* |
Фиброз междольковой соединительной ткани | 19,2 | 53,6* | 100* | 100* |
Отек межацинарной и междольковой соединительной ткани | 19,2 | 75* | 100* | 100* |
Жировая дистрофия | 61,5 | – | – | – |
Некрозы | – | 71,4* | 100* | 100* |
Двуядерные клетки | – | 71,4* | 100* | 100* |
Кровоизлияния в паренхиму железы | – | – | – | 50* |
Тучные клетки | – | – | – | 66,7* |
*p<0,05 по отношению к терапевтической дозе (4 мг/кг).
Таким образом, при длительном применении животным карпрофена в ткани поджелудочной железы наблюдались изменения, характерные для токсического поражения: белковая и жировая дистрофия экзокриноцитов, некрозы, реактивная гипертрофия в зонах некроза с появлением двуядерных клеток. При использовании высоких доз препарата отмечался выраженный отек не только межацинарной, но и междольковой соединительной ткани, а также кровоизлияния в паренхиму железы в местах обширных некрозов, то есть изменения соответствовали острому воспалению. При небольших дозировках карпрофена морфологическая картина соответствовала серозно-инфильтративной (отечной) форме, при высоких – наблюдался геморрагический или негеморрагический панкреонекроз: мелкоочаговый, крупноочаговый, субтотальный.
Обнаруженные нарушения структуры ткани мы связываем с действием карпрофена, поскольку похожая картина наблюдалась в экспериментах с применением нимесулида [9]. Гистопатологические изменения в паренхиме поджелудочной железы наблюдались уже при использовании терапевтической дозы препарата. Наиболее характерными признаками были гемодинамические нарушения, белковая дистрофия и склеротические изменения, которые имели дозозависимый эффект. При увеличении дозы препарата нарастала выраженность некротических процессов в ткани, которые сопровождались появлением двуядерных клеток, что связано с нарушениями митотических процессов. Обнаруженная у отдельных животных жировая дистрофия экзокриноцитов может указывать на развитие оксидативного стресса, обусловленного длительным применением препарата.
Видимых нарушений структуры эндокринных островков мы не обнаружили, тем не менее развитие гемодинамических и склеротических процессов в паренхиме, вероятно, оказывало действие на состояние эндокринных клеток. Полученные данные требуют более детального исследования, базирующегося на изучении патогенеза поражения поджелудочной железы при приеме НПВП.
Заключение. Выявленные нарушения в ткани поджелудочной железы у животных, длительное время получавших карпрофен в разных дозировках, указывают на токсическое действие препарата. Наиболее характерные выявленные признаки: гемодинамические нарушения, белковая дистрофия и склеротические изменения (фиброз), которые имели дозозависимый эффект. При небольших дозировках карпрофена морфологическая картина соответствовала серозно-инфильтративной (отечной) форме панкреатопатии, при высоких – наблюдался геморрагический или негеморрагический панкреонекроз (мелкоочаговый, крупноочаговый, субтотальный).
Библиографическая ссылка
Лазаренко Л.В., Косарева П.В. ИЗМЕНЕНИЯ ТКАНИ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ, ИНДУЦИРОВАННЫЕ ПРИЕМОМ КАРПРОФЕНА У ЭКСПЕРИМЕНТАЛЬНЫХ ЖИВОТНЫХ // Современные проблемы науки и образования. – 2017. – № 6.;
URL: https://science-education.ru/ru/article/view?id=27329 (дата обращения: 25.10.2019).

Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник
Учёные впервые доказали на практике, что органы, выращенные в организме особей другого вида, могут не только успешно прижиться после пересадки, но и вылечить такое тяжёлое заболевание как диабет. Новое исследование, опубликованное в журнале Nature, является важной вехой на пути к медицине будущего.
Сегодня множество пациентов с самыми разными заболеваниями стоят в очереди на трансплантацию донорских органов. Дефицит вызван тем, что лишь в трёх случаях из тысячи люди умирают таким образом, что их органы могут быть использованы для пересадки. Но в обозримом будущем ситуация может в корне измениться, и любой человек сможет на заказ вырастить необходимый орган из собственных клеток.
Исследования в этой области активно ведутся в научных центрах по всему миру. Учёные давно научились выращивать полностью функционирующие органы и ткани в пробирках с использованием перепрограммированных стволовых клеток. Но, когда речь идёт о больших органах со сложной трёхмерной структурой и собственными запасами крови, получить их в лабораторных условиях невероятно сложно. И тогда в качестве живых инкубаторов используют животных.
В настоящее время большинство подобных экспериментов проводится на мышах и крысах, в телах которых уже выращивали миниатюрные копии человеческих почек, вилочковую и поджелудочную железы.
В одной из предыдущих работ биологи получали поджелудочную железу крысы в теле мыши, а затем успешно пересаживали её крысам, больным диабетом. Но в тот раз вылечить животных не получилось, потому что железы оказались меньшего размера и содержали слишком мало панкреатических островков, где производится инсулин и другие гормоны.
На этот раз команда из Стэнфордского и Токийского университетов, работающая под руководством Хиромицу Накаучи (Hiromitsu Nakauchi), решила перевернуть эксперимент с ног на голову и выращивать мышиные железы в организме крыс.
Для этого они изменили гены крыс таким образом, чтобы у их потомства не формировалась собственная поджелудочная железа. Через несколько дней после зачатия в крошечные эмбрионы крыс вводили стволовые клетки мышей. В итоге крысята ничем не отличались от своих обыкновенных сородичей за исключением того, что их поджелудочные железы по большей части состояли из мышиных клеток. Таких животных называют химерами.
Крысы взрослели, исследователи умерщвляли их и аккуратно удаляли из их тел поджелудочную железу, которую затем пересаживали мышам, страдающим от диабета. Чтобы полностью исключить влияние крысиного наследия на результаты эксперимента, учёные ограничились лишь кратким пятидневным курсом иммунодепрессантов, которые вводили животным после пересадки, чтобы предотвратить отторжение новых тканей. После того как искусственное угнетение иммунной системы прекращалось, организм мышей очень быстро очищался от клеток крыс.
В течение года после операции уровень глюкозы в крови больных мышей приходил в норму.
«Мы обнаружили, что у мышей с диабетом уровень глюкозы нормализовался после трансплантации всего лишь 100 панкреатических островков, – говорит Накаучи в пресс-релизе Стэнфорда. – Кроме того, после пересадки животные-реципиенты нуждались лишь в пятидневном лечении иммуносупрессивными препаратами, что гораздо короче, чем существующие курсы при пересадке органов».
Авторы работы также отмечают, что в ходе их экспериментов у крыс не наблюдалось никаких признаков образования опухолей или других отклонений, которые ранее становились проблемой при использовании чужеродных плюрипотентных стволовых клеток в организме животного.
Уже сейчас исследователи ведут работу и над выращиванием в организме крысы других мышиных органов – печени, почек и лёгких.
Разумеется, для реального производства почек или печени человека будут использованы не мыши – лучше всего для этой цели подходят свиньи и овцы, так как их органы по размеру сходны с человеческими. Об этой технологии и прорывах в её использовании корреспонденты «Вести.Наука» расскажут в следующем материале.
Источник