Поджелудочная железа схема синтез гликогена
Гормонами поджелудочной железы являются инсулин и глюкагон.
Глюкагон
Строение
Представляет собой полипептид, включающий 29 аминокислот с молекулярной массой 3,5 кДа и периодом полураспада 3-6 мин.
Синтез
Осуществляется в клетках поджелудочной железы и в клетках тонкого кишечника.
Регуляция синтеза и секреции
Активируют: гипогликемия, адреналин.
Уменьшают: глюкоза, жирные кислоты.
Механизм действия
Аденилатциклазный активирующий.
Мишени и эффекты
Конечным эффектом является повышение концентрации глюкозы и жирных кислот в крови.
Жировая ткань
- повышает активность внутриклеточной гормон-чувствительной ТАГ-липазы и, соответственно, стимулирует липолиз.
Печень
- активация глюконеогенеза и гликогенолиза,
- за счет повышенного поступления жирных кислот из жировой ткани усиливает кетогенез.
Патология
Гиперфункция
Глюкагонома – редко встречающееся новообразование из группы нейроэндокринных опухолей. У больных отмечается гипергликемия и поражение кожи и слизистых оболочек.
Инсулин
Дополнительная, более подробная информация, об инсулине находится на следующей странице.
Строение
Представляет собой полипептид из 51 аминокислоты, массой 5,7 кД, состоящий из двух цепей А и В, связанных между собой дисульфидными мостиками.
Синтез
Синтезируется в клетках поджелудочной железы в виде проинсулина, в этом виде он упаковывается в секреторные гранулы и уже здесь образуется инсулин и С-пептид.
Регуляция синтеза и секреции
Активируют синтез и секрецию:
- глюкоза крови – главный регулятор, пороговая концентрация для секреции инсулина – 5,5 ммоль/л,
- жирные кислоты и аминокислоты,
- влияния n.vagus – находится под контролем гипоталамуса, активность которого определяется концентрацией глюкозы крови,
- гормоны ЖКТ: холецистокинин, секретин, гастрин, энтероглюкагон, желудочный ингибирующий полипептид,
- хроническое воздействие гормона роста, глюкокортикоидов, эстрогенов, прогестинов.
Уменьшают: влияние симпато-адреналовой системы.
Механизм действия
Осуществляется через рецепторы с тирозинкиназной активностью (подробно).
Мишени и эффекты
Основным эффектом является снижение концентрации глюкозы в крови благодаря усилению транспорта глюкозы внутрь миоцитов и адипоцитов и активации внутриклеточных реакций утилизации глюкозы:
- активируя фосфодиэстеразу, которая разрушает вторичный мессенджер цАМФ, инсулин прерывает эффекты адреналина и глюкагона на печень и жировую ткань.
- в мышцах и жировой ткани стимулирует транспорт глюкозы в клетки (активация Глют-4),
- в печени и мышцах ускоряет синтез гликогена (активация гликогенсинтазы).
- в печени, мышцах и адипоцитах инсулин стимулирует гликолиз, активируя фосфофруктокиназу и пируваткиназу.
- полученный в гликолизе пируват превращается в ацетил-SКоА под влиянием активированного инсулином пируватдегидрогеназного комплекса, и далее используется для синтеза жирных кислот. Превращение ацетил-SКоА в малонил-SКоА, первый субстрат синтеза жирных кислот, также стимулируется инсулином (ацетил-SКоА-карбоксилаза).
- в мышцах усиливает транспорт нейтральных аминокислот в миоциты и стимулирует трансляцию (рибосомальный синтез белков).
Ряд эффектов инсулина заключается в изменении транскрипции генов и скорости трансляции ферментов, отвечающих за обмен веществ, за рост и деление клеток.
Благодаря этому индуцируется синтез ферментов метаболизма
- углеводов в печени (глюкокиназа, пируваткиназа, глюкозо-6-фосфатдегидрогеназа),
- липидов в печени (АТФ-цитрат-лиаза, ацетил-SКоА-карбоксилаза, синтаза жирных кислот, цитозольная малатдегидрогеназа) и адипоцитах (ГАФ-дегидрогеназа, пальмитатсинтаза, липопротеинлипаза).
и происходит репрессия фосфоенолпируват-карбоксикиназы (подавление глюконеогенеза).
Инактивация инсулина
Инактивация инсулина начинается после интернализации инсулин-рецепторного комплекса и образования эндосомы, в которой и происходит деградация инсулина. Участвуют две ферментные системы:
- Глутатион-инсулин-трансгидрогеназа, которая восстанавливает дисульфидные связи между цепями А и В, в результате чего гормон распадается.
- Инсулиназа (инсулин-протеиназа), гидролизующая инсулин до аминокислот.
Период полужизни инсулина не превышает 5-6 минут. Происходит деградация в основном в печени и почках, но и другие ткани принимают в этом участие. Также в почках инсулин может фильтроваться, захватываться эпителиоцитами проксимальных канальцев и разрушаться до аминокислот.
Патология
Гипофункция
Инсулинзависимый и инсулиннезависимый сахарный диабет. Для диагностики этих патологий в клинике активно используют нагрузочные пробы и определение концентрации инсулина и С-пептида.
Источник
Мобилизация гликогена (гликогенолиз)
Резервы гликогена используются по-разному в зависимости от функциональных особенностей клетки.
Гликоген печени расщепляется при снижении концентрации глюкозы в крови, прежде всего между приемами пищи. Через 12-18 часов голодания запасы гликогена в печени полностью истощаются.
В мышцах количество гликогена снижается обычно только во время физической нагрузки – длительной и/или напряженной. Гликоген здесь используется для обеспечения глюкозой работы самих миоцитов. Таким образом, мышцы, как впрочем и остальные органы, используют гликоген только для собственных нужд.
Мобилизация (распад) гликогена или гликогенолиз активируется при недостатке свободной глюкозы в клетке, а значит и в крови (голодание, мышечная работа). При этом уровень глюкозы крови «целенаправленно» поддерживает только печень, в которой имеется глюкозо-6-фосфатаза, гидролизующая фосфатный эфир глюкозы. Образуемая в гепатоците свободная глюкоза выходит через плазматическую мембрану в кровь.
В гликогенолизе непосредственно участвуют три фермента:
1. Фосфорилаза гликогена (кофермент пиридоксальфосфат) – расщепляет α-1,4-гликозидные связи с образованием глюкозо-1-фосфата. Фермент работает до тех пор, пока до точки ветвления (α1,6-связи) не останется 4 остатка глюкозы.
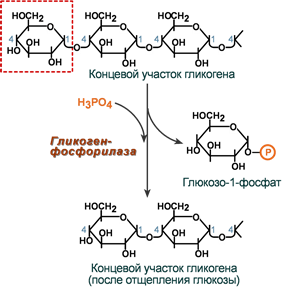
Роль фосфорилазы при мобилизации гликогена
2. α(1,4)-α(1,4)-Глюкантрансфераза – фермент, переносящий фрагмент из трех остатков глюкозы на другую цепь с образованием новой α1,4-гликозидной связи. При этом на прежнем месте остается один остаток глюкозы и «открытая» доступная α1,6-гликозидная связь.
3. Амило-α1,6-глюкозидаза, («деветвящий» фермент) – гидролизует α1,6-гликозидную связь с высвобождением свободной (нефосфорилированной) глюкозы. В результате образуется цепь без ветвлений, вновь служащая субстратом для фосфорилазы.
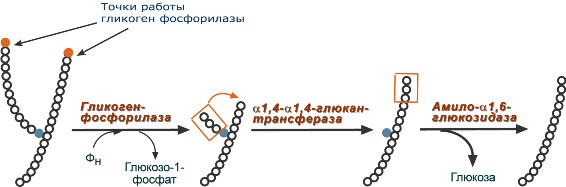
Роль ферментов в расщеплении гликогена
Синтез гликогена
Гликоген способен синтезироваться почти во всех тканях, но наибольшие запасы гликогена находятся в печени и скелетных мышцах. Накопление гликогена в мышцах отмечается в период восстановления после нагрузки, особенно при приеме богатой углеводами пищи. В печени синтез гликогена происходит только после еды, при гипергликемии. Это объясняется особенностями печеночной гексокиназы (глюкокиназы), которая имеет низкое сродство к глюкозе и может работать только при ее высоких концентрациях, при нормальных концентрациях глюкозы в крови ее захват печенью не производится.
Непосредственно синтез гликогена осуществляют следующие ферменты:
1. Фосфоглюкомутаза – превращает глюкозо-6-фосфат в глюкозо-1-фосфат;
2. Глюкозо-1-фосфат-уридилтрансфераза – фермент, осуществляющий ключевую реакцию синтеза. Необратимость этой реакции обеспечивается гидролизом образующегося дифосфата;

Реакции синтеза УДФ-глюкозы
3. Гликогенсинтаза – образует α1,4-гликозидные связи и удлиняет гликогеновую цепочку, присоединяя активированный С1 УДФ-глюкозы к С4 концевого остатка гликогена;
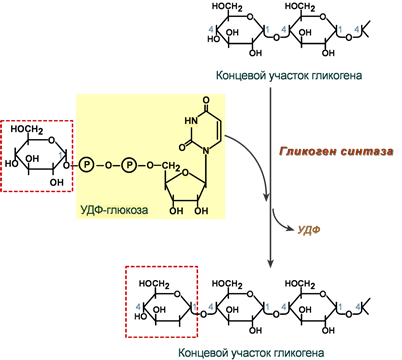
Химизм реакции гликогенсинтазы
4. Амило-α1,4-α1,6-гликозилтрансфераза,»гликоген-ветвящий» фермент – переносит фрагмент с минимальной длиной в 6 остатков глюкозы на соседнюю цепь с образованием α1,6-гликозидной связи.
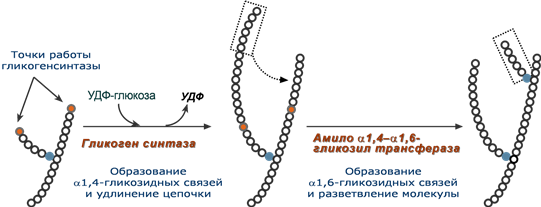
Роль гликогенсинтазы и гликозилтрансферазы в синтезе гликогена
Источник
Поджелудочная железа – важная составляющая пищеварительной системы человека. Она является главным поставщиком ферментов, без которых невозможно полноценное переваривание белков, жиров и углеводов. Но выделением панкреатического сока ее деятельность не ограничивается. Особые структуры железы – островки Лангерганса, которые выполняют эндокринную функцию, секретируя инсулин, глюкагон, соматостатин, панкреатический полипептид, гастрин и грелин. Гормоны поджелудочной железы участвуют во всех видах обмена, нарушение их выработки ведет к развитию серьезных заболеваний.
 Гормоны поджелудочной железы регулируют функции пищеварительной системы и обмен веществ
Гормоны поджелудочной железы регулируют функции пищеварительной системы и обмен веществ
Эндокринная часть поджелудочной железы
Клетки поджелудочной железы, синтезирующие гормональноактивные вещества, называются инсулоцитами. Они расположены в железе скоплениями – островками Лангерганса. Общая масса островков составляет всего 2% от веса органа. По строению различают несколько типов инсулоцитов: альфа, бета, дельта, РР и эпсилон. Каждая разновидность клеток способна образовывать и секретировать определенный вид гормонов.
Какие гормоны вырабатывает поджелудочная железа
Перечень панкреатических гормонов обширный. Одни описаны очень подробно, а свойства других изучены еще недостаточно. К первым относится инсулин, считающийся самым изученным гормоном. К представителям биологически активных веществ, исследованных недостаточно, можно отнести панкреатический полипептид.
Инсулин
Особые клетки (бета-клетки) островков Лангерганса поджелудочной железы синтезируют гормон пептидной природы, получивший название инсулин. Спектр действия инсулина широк, но основное его назначение – понижение уровня глюкозы в плазме крови. Влияние на обмен углеводов реализуется благодаря способности инсулина:
- облегчать поступление глюкозы в клетку путем повышения проницаемости мембран;
- стимулировать усвоение глюкозы клетками;
- активировать образование в печени и мышечной ткани гликогена, являющегося основной формой хранения глюкозы;
- подавлять процесс гликогенолиза – расщепления гликогена до глюкозы;
- тормозить глюконеогенез – синтезирование глюкозы из белков и жиров.
Но не только метаболизм углеводов является сферой приложения гормона. Инсулин способен влиять на белковый и жировой обмен через:
- стимуляцию синтеза триглицеридов и жирных кислот;
- облегчение поступления глюкозы в адипоциты (жировые клетки);
- активизацию липогенеза – синтеза жиров из глюкозы;
- торможение липолиза – расщепления жиров;
- угнетение процессов распада белка;
- повышение проницаемости клеточных мембран для аминокислот;
- стимуляцию синтеза белка.
Инсулин обеспечивает ткани запасами потенциальных источников энергии. Его анаболический эффект приводит к увеличению депо белка и липидов в клетке и определяет роль в регуляции процессов роста и развития. Кроме того, инсулин влияет на водно-солевой обмен: облегчает поступление калия в печень и мышцы, способствует удержанию воды в организме.
Главным стимулом образования и секреции инсулина является рост уровня глюкозы в сыворотке крови. К увеличению синтеза инсулина также приводят гормоны:
- холецистокинин;
- глюкагон;
- глюкозозависимый инсулинотропный полипептид;
- эстрогены;
- кортикотропин.
Поражение бета-клеток ведет к нехватке или отсутствию инсулина – развивается сахарный диабет 1-го типа. Кроме генетической предрасположенности, в возникновении этой формы заболевания играют роль вирусные инфекции, стрессовые воздействия, погрешности питания. Инсулинорезистентность (невосприимчивостью тканей к гормону) лежит в основе диабета 2-го типа.
 Выработка инсулина зависит, главным образом, от уровня глюкозы в крови
Выработка инсулина зависит, главным образом, от уровня глюкозы в крови
Глюкагон
Пептид, производимый альфа-клетками островков поджелудочной железы, называется глюкагоном. Его действие на человеческий организм противоположно действию инсулина и заключается в повышении уровня сахара в крови. Основная задача – поддержание стабильного уровня глюкозы в плазме между приемами пищи, выполняется за счет:
- расщепления гликогена в печени до глюкозы;
- синтеза глюкозы из белков и жиров;
- угнетения процессов окисления глюкозы;
- стимуляции расщепления жиров;
- образования кетоновых тел из жирных кислот в клетках печени.
Глюкагон повышает сократительную способность сердечной мышцы, не влияя на ее возбудимость. Результатом является рост давления, силы и частоты сердечных сокращений. В стрессовых ситуациях и при физических нагрузках глюкагон облегчает скелетным мышцам доступ к энергетическим запасам и улучшает их кровоснабжение благодаря усилению работы сердца.
Глюкагон стимулирует высвобождение инсулина. При инсулиновой недостаточности содержание глюкагона всегда повышено.
Соматостатин
Пептидный гормон соматостатин, вырабатываемый дельта-клетками островков Лангерганса, существует в виде двух биологически активных форм. Он подавляет синтез многих гормонов, нейромедиаторов и пептидов.
Соматостатин, кроме того, замедляет всасывание глюкозы в кишечнике, снижает секрецию соляной кислоты, моторику желудка и секрецию желчи. Синтез соматостатина возрастает при высоких концентрациях глюкозы, аминокислот и жирных кислот в крови.
Читайте также:
Как сохранить здоровье поджелудочной железы: 5 советов
6 признаков гипогликемии
Враги фигуры: 9 продуктов, усиливающих аппетит
Гастрин
Гастрин – пептидный гормон, кроме поджелудочной железы вырабатывается клетками слизистой оболочки желудка. По количеству аминокислот, входящих в его состав, различают несколько форм гастрина: гастрин-14, гастрин-17, гастрин-34. Поджелудочная железа секретирует в основном последний. Гастрин участвует в желудочной фазе пищеварения и создает условия для последующей кишечной фазы посредством:
- увеличения секреции соляной кислоты;
- стимуляции выработки протеолитического фермента – пепсина;
- активизации выделения бикарбонатов и слизи внутренней оболочкой желудка;
- усиления моторики желудка и кишечника;
- стимуляции секреции кишечных, панкреатических гормонов и ферментов;
- усиления кровоснабжения и активации восстановления слизистой оболочки желудка.
Стимулируют выработку гастрина, на который влияет растяжение желудка при приеме пищи, продукты переваривания белков, алкоголь, кофе, гастрин-высвобождающий пептид, выделяемый нервными отростками в стенке желудка. Уровень гастрина растет при синдроме Золлингера – Эллисона (опухоль островкового аппарата поджелудочной железы), стрессе, приеме нестероидных противовоспалительных препаратов.
Определяют уровень гастрина при дифференциальной диагностике язвенной болезни и болезни Аддисона – Бирмера. Это заболевание еще называют пернициозной анемией. При нем нарушение кроветворения и симптомы анемии вызваны не дефицитом железа, что встречается чаще, а нехваткой витамина В12 и фолиевой кислоты.
Грелин
Грелин продуцируют эпсилон-клетки поджелудочной железы и специальные клетки слизистой оболочки желудка. Гормон вызывает чувство голода. Он взаимодействует с центрами головного мозга, стимулируя секрецию нейропептида Y, ответственного за возбуждение аппетита. Концентрация грелина перед приемом пищи растет, а после – снижается. Функции грелина разнообразны:
- стимулирует секрецию соматотропина – гормона роста;
- усиливает выделение слюны и готовит пищеварительную систему к приему пищи;
- усиливает сократимость желудка;
- регулирует секреторную активность поджелудочной железы;
- повышает уровень глюкозы, липидов и холестерола в крови;
- регулирует массу тела;
- обостряет чувствительность к пищевым запахам.
Грелин координирует энергетические потребности организма и участвует в регуляции состояния психики: депрессивные и стрессовые ситуации повышают аппетит. Кроме того, он оказывает действие на память, способность к обучению, процессы сна и бодрствования. Уровень грелина увеличивается при голодании, похудении, низкой калорийности пищи и уменьшении содержания глюкозы в крови. При ожирении, сахарном диабете 2-го типа отмечается снижение концентрации грелина.
 Грелин — гормон, отвечающий за чувство голода
Грелин — гормон, отвечающий за чувство голода
Панкреатический полипептид
Панкреатический полипептид является продуктом синтеза РР-клеток поджелудочной железы. Его относят к регуляторам пищевого режима. Действие панкреатического полипептида на процессы пищеварения следующее:
- угнетает внешнесекреторную активность поджелудочной железы;
- сокращает выработку панкреатических ферментов;
- ослабляет перистальтику желчного пузыря;
- тормозит глюконеогенез в печени;
- усиливает пролиферацию слизистой оболочки тонкой кишки.
Секреции панкреатического полипептида способствует богатая белком пища, голодание, физические нагрузки, резкое падение уровня сахара крови. Снижают выделяемое количество полипептида соматостатин и глюкоза, введенная внутривенно.
Вывод
Нормальное функционирование организма требует слаженной работы всех эндокринных органов. Врожденные и приобретенные заболевания поджелудочной железы ведут к нарушению секреции панкреатических гормонов. Понимание их роли в системе нейрогуморальной регуляции помогает успешно решать диагностические и лечебные задачи.
Видео
Предлагаем к просмотру видеоролик по теме статьи.
Нашли ошибку в тексте? Выделите ее и нажмите Ctrl + Enter.
Источник
Эндокринная часть поджелудочной железы представлена островками Лангерганса, состоящими из клеток разного типа: α-клетки образуют глюкагон, β-клетки – инсулин, d-клетки – соматостатин, а также гормоны-стимуляторы эндокринной секреции (для желудка – панкреагастрин, для поджелудочной железы – секретин).
Глюкагон – полипептид, стимулирующий глюконеогенез и гликогенолиз, усиливает липолиз и кетогенез, вызывает секрецию инсулина. До 3% гормона (энтероглюкагон) вырабатывается α‑клетками желудка и тонкой кишки. В плазме гормон представлен 4 фракциями. Для определения глюкагона разработаны биологические методы (биоптаты железы) in vivo и in vitro и радиоиммунологические (плазма) с применением суспензии «уголь-декстран» или метода двойных антител.
Инсулин – полипептид содержится в β‑клетках в виде проинсулина, который перед секрецией расщепляется на инсулин и С‑пептид, выделяющийся в кровь в эквимолярных количествах. С‑пептид неактивен. Инсулин принято считать главным гормоном поджелудочной железы, поскольку это единственный фактор, снижающий уровень глюкозы в крови; оказывает анаболическое влияние на все органы и ткани. Инсулин активирует доставку глюкозы тканям, накопление макроэргов в клетках, гликолиз, синтез гликогена, липогенез, регулирует обмен белка и нуклеиновых кислот. Для определения содержания инсулина в крови разработан ряд методов: биологические (с использованием жировых клеток, изолированной диафрагмы); радиорецепторные; иммуноферментные (гормон конъюгирован с β‑Д‑галактозидазой); радиоиммунные; иммунометрические. В клинике практически используют последние два.
Определение С-пептида позволяет оценить работу β‑клеток: в присутствии экзогенного инсулина, при наличии антител к инсулину, при тесте с введением глюкагона (оценка секреторной способности железы).
Соматостатин – небольшой пептид, секретируется не только дефинитивными клетками поджелудочной железы, но также принадлежит семейству гипоталамических рилизинг-факторов. Соматостатин обладает широким спектром ингибирующих эффектов на эндокринные функции: в гипофизе тормозит секрецию тиреотропина, пролактина, снижает секрецию инсулина и особенно глюкагона поджелудочной железой, а также гормонов желудочно-кишечного тракта. Определяется методом радиоиммунного анализа. В клинике используется в комплексной диагностике расстройств эндокринной функции поджелудочной, щитовидной, половых желез, а также при общих нарушениях анаболических процессов и процессов роста.
Более полную информацию о соматотропной функции гипофиза получают, используя нагрузочные тесты стимуляции аргинином, глюкагоном, L-ДОФА, инсулином, тест угнетения глюкозой.
Нормальные величины
| Инсулин | 15-180 нмоль/л или 6-24 мМЕ/л | |
| старше 60 лет | 6-35 мМЕ/л | |
| Глюкагон | 30-120 нг/л | |
| С–пептид | сыворотка | 0,26-0,63 нмоль/л |
| в моче | 14,8-28,3 нмоль/сут | |
| Соматостатин | 0-10 нг/мл | |
Клинико-диагностическое значение
Глюкагон
Накопление глюкагона отмечается при гипергликемии у больных сахарным диабетом, глюкагономе, хронической почечной недостаточности, при стрессах различной этиологии, травмах, акромегалии, циррозе печени. Уменьшение концентрации — при муковисцидозе, хроническом панкреатите.
Инсулин
Повышение содержания инсулина отмечено при сахарном диабете II типа, заболеваниях печени, акромегалии, инсулиноме, синдроме Кушинга, ожирении. Недостаток гормона наблюдается при юношеском диабете, гипопитуитаризме.
С-пептид
Увеличение уровня С-пептида выявляется при инсулиноме и хронической почечной недостаточности. Снижение — сахарный диабет I типа и поздние стадии сахарного диабета II типа.
Источник