При выбросе поджелудочной железой в плазму крови инсулина
Продолжаем теоретически подковываться по теме гормонального баланса в организме. На очереди – знакомство с гормонами поджелудочной железы и их функциями в углеводном обмене и поддержании нормального уровня веса.
В организме за нормальное усвоение углеводов отвечают два гормона, вырабатываемые поджелудочной железой – глюкагон и инсулин. Глюкагон отвечает за высвобождение и уровень сахара в крови, а инсулин – за доставку этого сахара в клетки и распределение и хранение запасов углеводов.
ГОРМОНЫ ПОДЖЕЛУДКИ И ВЕС
Эти два гормона действуют в связке, четко распределяя свои обязанности: когда уровень сахара понижен, глюкакон подавляет чувств голода и выпускает часть сахара в кровь, накопленную в печени. Инсулин «перехватывает эстафетную палочку» и очищает кровь от сахара и поставляет его клеткам. Таким образом эта «команда» равномерно снабжает организм питанием и энергией и не допускает преобразование поступившей глюкозы в жир.
Для поддержания этого инсулино-глюкагонового баланса необходимо правильное питание, иначе наступит сбой, который приведет к неприятным последствиям для здоровья.
При постоянном превышении и преимущественно углеводной пище уровень сахара в крови будет высоким и печень направит его в жировые отложения, а нехватка глюкозы при белковой пище значительно ухудшит самочувствие и психоэмоциональное состояние.
ИНСУЛИН И ВЛИЯНИЕ НА ВЕС
Чтобы организм получал энергию из потребляемой пищи (глюкозы), поджелудочная железа вырабатывает инсулин постоянно. После каждого приема пищи и повышения уровня сахара в крови начинается секреция инсулина, который связывает глюкозу и поставляет ее в печень (где глюкоза резервируется в виде гликогена), в мышцы и в жировую ткань.
При нормальной выработке инсулина уровень сахара в крови также остается на оптимальном уровне. При повышенных физических нагрузках, когда требуется больше энергии, инсулин сначала расходует запасы гликогена в мышцах и печени, затем начинает брать энергию из жира.
Однако, если гликогена слишком много, а нагрузки мало – жир не сжигается, до него очередь просто не доходит.
Сбой в выработке инсулина называется инсулиновой резистентностью. Очень упрощенно это можно описать так: после повышения уровня сахара в крови (после еды), инсулин начинает выполнять свою основную работу – доносит глюкозу до клеток, «стучится» к ним в дверь, клетки «открывают» дверь, забирают глюкозу и используют ее в качестве энергии. При инсулинорезистентности клетки «не слышат» стук, они устойчивы к инсулину. Поджелудочная железа «понимает», что инсулина мало, надо «стучать громче», и вырабатывает еще большее количество инсулина.
Но постоянно работать на пределе она не может, и в какой-то момент она начинает вырабатывать меньше инсулина – уровень глюкозы в крови начинает расти и оставаться высоким. Начинает развиваться сахарный диабет и все его неприятные последствия.
В группе риска по развитию инсулинорезистентности:
- Люди с избыточным весом.
- Объем талии у мужчин более 96-102 см, у женщин — более 84-89 см.
- Люди старше 40 лет.
- У близких родственников есть сахарный диабет 2 типа, высокое кровяное давление или артеросклероз.
- В прошлом у женщины был гестационный сахарный диабет.
- Люди с высоким кровяным давлением, высоким уровнем триглицеридов в крови, низким уровнем холестерина ЛПВП, атеросклерозом (или другие составляющие метаболического синдрома).
- Синдром поликистозных яичников.
ПРИЗНАКИ ПОВЫШЕННОГО ИНСУЛИНА
Если уровень инсулина в крови постоянно повышен, то начинается процесс накапливания жировых отложений и торможение расщепления жира. Вы не сможете похудеть за счёт сжигания жира, так как в организме постоянно будут сжигаться только углеводы, которые поступили с пищей. До сжигания жира из запасных депо дело не дойдёт, так как уровень инсулина в крови не снижается на протяжении 8-12 часов. Вы становитесь углеводозависимым и присутствует постоянная тяга к сладкому.
Итак, обратите внимание на следующие признаки:
- Вам постоянно хочется есть, причем обильно и часто.
- У вас повышен аппетит.
- Вам постоянно хочется сладкого, особенно шоколада.
- Вы двигательно пассивны и мысль о спорте вызывает отторжение.
- У вас повышается давление.
КАК НОРМАЛИЗОВАТЬ УРОВЕНЬ ИНСУЛИНА ЕСТЕСТВЕННЫМ ПУТЕМ
- Начинать день с правильного завтрака.
- Для поддержания уровня глюкозы в течение дня питаться сложными углеводами.
- Есть больше продуктов, богатых клетчаткой (овощи, отруби, злаки).
- Не переедать, ввести дробное частое питание небольшими порциями (250-300 гр.)
- Отказаться от перекусов сладостями, шоколадом, булками, печеньем.
- Ввести регулярные умеренные физические нагрузки, например, прогулки пешком.
- Не наедаться перед сном, ужинать преимущественно белковыми продуктами.
- Исключить из рациона сахаросодержащие продукты.
Замечательным природным регулятором, способным мягко снижать выработку инсулина и снижать приступы голода, является авокадо.
ГОРМОН ГЛЮКАГОН И ВЛИЯНИЕ НА ВЕС
Глюкагон — еще один гормон поджелудочной железы, который в отличие от инсулина является полезным для похудения, поскольку повышает глюкозу в крови, снижает аппетит и вызывает расщепление жиров.
Также глюкагон резко повышает уровень глюкозы при выбрасывании адреналина, чтобы увеличить энергию организма, поддержать скелетные мышцы и увечить поступление к ним кислорода.
Норма глюкагона в крови у взрослых колеблется в пределах 20–100 пг/мл. Отклонение от нормы говорит возможных заболеваниях поджелудочной железы, печени, почек, а также сильной стрессовой ситуации для организма при физическом или психоэмоциональном напряжении.
ФАКТОРЫ, ВЛИЯЮЩИЕ НА ВЫРАБОТКУ ГЛЮКАГОНА
- Снижение концентрации глюкозы в крови.
- Повышение количества аминокислот, в частности аланина и аргинина.
- Интенсивные тренировки (чем выше нагрузка, тем больше уровень гормона).
Чтобы повысить уровень глюкагона, нужно отказаться от дробного питания, при котором его выработка тормозится и он перестает участвовать в сжигании жиров.
При более длительных перерывах между приемами пищи (например, трехразовом питании без сильного голодания) этот гормон может расщепить большое количество жировых запасов.
Также повысить уровень глюкагона можно регулярными занятиями спортом – гормон начинает вырабатываться после получаса активной физической нагрузки.
При необходимости снижать вес или при трудностях с достижением желаемого веса – обратите внимание на эти важные гормоны.
← ПОНРАВИЛАСЬ СТАТЬЯ? НАЖМИТЕ ЛАЙК ← ←
Источник
Поджелудочная железа
Поджелудочная железа — относительно большой продолговатый орган, расположенный горизонтально в верхней части брюшной полости.
Поджелудочная железа является железой смешанной секреции, т.е., обладает внешнесекреторной (экзокринной) функцией — выделяет сок (комплекс пищеварительных ферментов) в двенадцатиперстную кишку и внутрисекреторной (эндокринной) функцией — выделяет гормоны в кровь.
Эндокринная ткань поджелудочной железы — островки Лангерганса — составляет около 3% общей массы. В них различают α-клетки, синтезирующие гормон глюкагон, и β-клетки, синтезирующие инсулин. Кроме них поджелудочная железа выделяет в кровь ряд гормоноподобных веществ.
Инсулин — основной гормон поджелудочной железы, повышающий проницаемость клеточных мембран для глюкозы, благодаря чему глюкоза переходит из крови внутрь клеток. Инсулин способствует синтезу гликогена из глюкозы и тормозит его распад.
Радиоиммунологическим методом определяется так называемый иммунореактивный инсулин (ИРИ).
Нормальная концентрация в сыворотке крови — 6-24 мкЕД/мл.
Основным стимулом для секреции инсулина является повышение концентрации глюкозы в крови. При проведении перорального теста толерантности к глюкозе концентрация инсулина изменяется следующим образом: через 30 мин — 25-231 мкЕД/мл, 60 мин — 18-276 мкЕД/мл, 120 мин — 16-166 мкЕД/мл, 180 мин — 4-38 мкЕД/мл.
При этой пробе концентрация инсулина выше нормы у некоторых больных с реактивной гипогликемией, с поражением печени, синдромом Кушинга; ниже нормы — при сахарном диабете, гипофункции надпочечников. Наиболее существенное повышение ИРИ отмечается при инсулиноме — гормонопродуцирующей опухоли поджелудочной железы из β-клеток. При соотношении показателей инсулина (в мкЕД/мл) и глюкозы (в мг/дл) больше 0,25 вероятно наличие инсулиномы.
Определение инсулина применяется также для подтверждения диагноза диабета у людей с пограничными нарушениями толерантности к глюкозе. Сахарный диабет I типа (инсулинзависимый) характеризуется понижением уровня инсулина, сахарный диабет II типа (инсулиннезависимый) — нормальным или повышенным уровнем.
С-пептид — фрагмент молекулы проинсулина, при отщеплении которого образуется инсулин. Инсулин и С-пептид секретируются в кровь в пропорциональных количествах. Так как лечебные препараты инсулина не содержат С-пептида, его определение позволяет точно оценить функцию β-клеток и количество собственного инсулина у больных сахарным диабетом, получающих инсулин.
Нормальная концентрация в сыворотке крови — 0,5-3,0 нг/мл.
После нагрузки глюкозой отмечается 5-6-кратное увеличение уровня С-пептида, которое сохраняется значительно дольше, чем уровень инсулина.
Косвенным показателем уровня инсулина в организме является концентрация глюкозы в крови.
Глюкагон — пептидный гормон, противоположный по физиологическим эффектам инсулину, увеличивает концентрацию глюкозы в крови за счет стимуляции распада гликогена в печени, повышает основной обмен, потребление кислорода. Обеспечивает контроль за поддержанием постоянства уровня глюкозы в крови — низкая концентрация глюкозы вызывает выброс глюкагона, а гипергликемия снижает его количество. Определяется радиоиммунологическим методом.
Нормальная концентрация в плазме — 30-120 пг/мл.
Значительное увеличение количества глюкагона — признак опухоли, из α-клеток — глюкагономы. Снижение концентрации может свидетельствовать об уменьшении массы поджелудочной железы, отмечается у больных муковисцидозом, хроническим панкреатитом, после удаления поджелудочной железы. У больных сахарным диабетом угнетения выделения глюкагона при гипергликемии не происходит, а даже отмечается его повышение.
Источник
Эндокринолог Елена Шведкина о редкой патологии поджелудочной железы опухолевой природы
Синдром Харриса — это спонтанные приступы гипогликемии, вызванные повышенной нерегулируемой секрецией инсулина. В литературе встречаем синонимы: органический гиперинсулинизм, гипогликемический синдром, инсулинома, эндогенный гиперинсулинизм и гипогликемическая болезнь. Синдром впервые описал в 1924 г. американский врач Сил Харрис Harris Seale (1870–1957) [1]. В этом же году параллельно с ним это сделал отечественный хирург Владимир Оппель, но в медицинских кругах синдрому было присвоено имя Харриса.
Обнаружению и дальнейшему исследованию данной патологии предшествовали несколько важных научных открытий. Первое — открытие Паулем Лангергансом в 1869 г. островков в поджелудочной железе, ответственных за выработку инсулина. Эти островки были названы островками Лангерганса. Второе — революционное исследование, а именно выделение инсулина, проведенное в Канаде Фредериком Бантингом и Чарлзом Бестом в 1922 г., и появление информации о клинических признаках передозировки инсулина.
В дальнейшем была установлена взаимосвязь между избыточным уровнем инсулина и развитием симптомов гипогликемии [2]. Всё это позволило вскоре выявить основную причину развития гиперинсулинизма и гипогликемий — опухоли бета-клеток островка Лангерганса, секретирующие избыточное количество инсулина. Подобные опухоли были названы инсулиномами (от лат. insulin — «пептидный гормон, вырабатываемый бета-клетками островков Лангерганса» и лат. oma — «опухоль», «образование»).
Этиология и патогенез
Развитие синдрома Харриса может быть обусловлено:
- доброкачественной или злокачественной опухолью бета-клеток островка Лангенгарса (инсулиномы)
- диффузным аденоматозом или диффузной гиперплазией островкового аппарата поджелудочной железы [3].
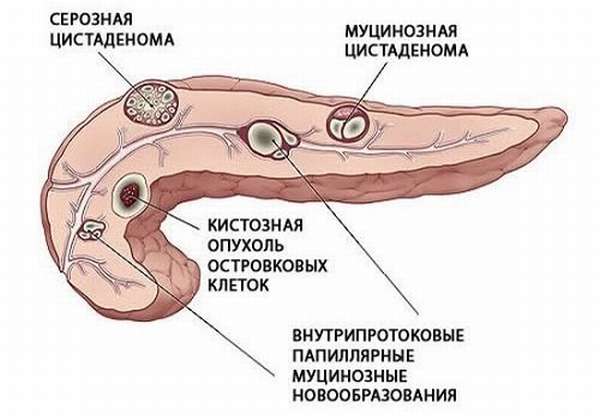
Инсулинома — одна из наиболее часто встречающихся нейроэндокринных опухолей поджелудочной железы. Она составляет почти 80 % от всех известных гормональных новообразований поджелудочной железы. Встречаются инсулиномы нечасто — 2–4 случая на 1 миллион населения в год. Инсулинсекретирующая опухоль описана во всех возрастных группах — от новорожденных до престарелых, тем не менее чаще она проявляется в наиболее трудоспособном возрасте — от 30 до 55 лет. Среди общего числа больных дети составляют около 5 %. У женщин инсулинома встречается в 2 раза чаще, чем у мужчин. У большинства больных инсулинома бывает доброкачественной (80–90 %), у 10–20 % имеет признаки злокачественного роста [1]. Инсулиномы могут быть как спорадическими (обычно одиночными) опухолями, так и множественными (наследственно обусловленными). Чаще инсулиномы локализуются в поджелудочной железе, но в 1–2 % случаев могут развиваться в воротах селезёнки, печени или в стенке двенадцатиперстной кишки [4].
Глюкоза — важнейший источник энергии для жизнедеятельности клеток, в частности клеток мозга. Внутри клеток свободная глюкоза практически отсутствует, накапливаясь в виде гликогена. Глюкоза входит в молекулы нуклеотидов и нуклеиновых кислот. Глюкоза необходима для синтеза некоторых аминокислот, синтеза и окисления липидов, полисахаридов. Концентрация глюкозы в норме в крови человека поддерживается в относительно узких пределах — 2,8–7,8 ммоль/л, вне зависимости от пола и возраста, несмотря на большие различия в питании и физической активности. Это постоянство обеспечивает ткани мозга достаточным количеством глюкозы, единственного метаболического топлива, которое они могут использовать в обычных условиях [5].
Инсулин — анаболический гормон, усиливающий синтез углеводов, белков, жиров и нуклеиновых кислот. Он влияет на углеводный обмен: увеличивает транспорт глюкозы из крови в клетки инсулинзависимых тканей (жировую, мышечную, печеночную), стимулирует синтез гликогена в печени и подавляет его расщепление, а также подавляет синтез глюкозы (гликонеогенез). Закономерно инсулин снижает уровень глюкозы в крови. Гиперинсулинизм вызывает многочисленные нарушения в гомеостазе и прежде всего в функциях центральной нервной системы, поскольку мозг не имеет запасов углеводов, в нем не происходит синтеза глюкозы, а расход ее велик и постоянен (до 20 % от циркулирующей в крови). Гипогликемия также влияет на кардиоваскулярную и гастроинтестинальную деятельность [4]. У здоровых людей угнетение выработки инсулина после всасывания глюкозы в кровь начинается при концентрации 4,2–4 ммоль/л, а при дальнейшем снижении концентрации глюкозы сопровождается выбросом контринсулярных гормонов.
Клинические проявления
Симптомы инсулином обусловлены гипогликемией, которая стимулирует секрецию катехоламинов — адреналина и норадреналина, и влечет за собой дефицит глюкозы в головном мозге, что равносильно снижению потребления кислорода нервными клетками [6].
Клиническая картина включает две группы симптомов — острой и хронической гипогликемии. Период острой гипогликемии развивается в результате срыва механизмов адаптации центральной нервной и эндокринной систем. Основные симптомы этого периода: слабость, потливость, чувство голода, тошнота, рвота, раздражительность, ухудшение зрения, помутнение в глазах, онемение губ и языка, сердцебиение, мышечная дрожь, боли в области сердца, судорожные подергивания мышц и даже настоящие судороги. Недостаток глюкозы в головном мозге (нейрогликопения) обусловливает психическое возбуждение, галлюцинации, бред, ретроградную амнезию, агрессивность, негативизм, дезориентацию в лицах, во времени, в пространстве, болтливость, нецензурность выражений. Происходит как бы выключение коры головного мозга, «буйство подкорки». Далеко зашедшая гипогликемия приводит к развитию гипогликемической комы. Наиболее часто острая гипогликемия развивается рано утром (в связи с ночным периодом голодания), больной или «не может проснуться», или просыпается с трудом, при этом обнаруживается вышеизложенная клиника. Глубокая кома может привести к необратимым изменениям ЦНС (децеребрации) и смерти.
Период хронической гипогликемии (межприступный период) характеризуется симптомами хронического повреждения ЦНС: головные боли, снижение памяти, умственной работоспособности, постоянное чувство голода (больные часто едят, особенно много употребляют углеводов и прибавляют в весе), патологические рефлексы Бабинского, неадекватное поведение [7].
Дифференциальный диагноз
Симптомы гипогликемии отличаются полиморфизмом и неспецифичностью. Наличие нервно-психических нарушений и малая распространённость заболевания часто приводят к диагностическим ошибкам. Как правило, требуется дифдиагностика с такими состояниями, как эпилепсия, кататония, гебефрения, неврастения, истерия, мигрень, психоз, алкогольная болезнь, опухоли головного мозга, нейровегетативная дистония с гипогликемическими состояниями. Однако для синдрома Харриса патогномоничной является триада Уиппла:
- возникновение приступов гипогликемии после длительного голодания или физической нагрузки
- снижение содержания глюкозы крови во время приступа ниже 1,7 ммоль/л у детей до двух лет и ниже 2,2 ммоль/л — старше двух лет
- купирование гипогликемического приступа внутривенным введением глюкозы или пероральным приемом растворов глюкозы [4].
Диагностика
На первом этапе золотой стандарт диагностики синдрома Харриса — не слишком гуманная проба с голоданием в течение 72 часов. Она считается положительной при развитии триады Уиппла. Начало голодания отмечают как время последнего приема пищи. Уровень глюкозы в крови оценивают через 3 часа после последнего приема пищи, затем через каждые 6 часов, а при снижении уровня глюкозы в крови ниже 3,4 ммоль/л интервал между ее исследованиями сокращают до 30–60 мин. Скорость секреции инсулина при инсулиноме не угнетается при снижении уровня глюкозы в крови.
Кроме того, при инсулиноме инсулин/гликемический индекс (отношение уровня инсулина к уровню глюкозы) превышает 1,0, а в норме составляет не более 0,3. Также при инсулиноме резко повышена концентрация С-пептида.
Второй этап диагностики инсулиномы — лоцирование опухоли. Используют УЗИ, компьютерную томографию, магниторезонансную томографию, эндоскопическое УЗИ, сцинтиграфию, ангиографию, интраоперационное УЗИ. Наиболее информативны в диагностике инсулином эндоскопическое ультразвуковое исследование (эндо-УЗИ) и забор крови из печеночных вен после внутриартериальной стимуляции поджелудочной железы кальцием. С помощью современных методов исследования удается на дооперационном этапе у многих пациентов установить локализацию опухоли, ее размер, стадию и темпы прогрессирования, выявить метастазы.
Лечение и прогноз
Лечение инсулиномы в большинстве случаев хирургическое: энуклеация опухоли, дистальная резекция поджелудочной железы при соответствующей локализации. Консервативная терапия проводится в случае нерезектабельной опухоли и ее метастазов, а также при отказе пациента от оперативного лечения. Пятилетняя выживаемость среди радикально прооперированных пациентов — 90 %, при обнаружении метастазов — 20 % [8].
Источники
- Клиническая эндокринология: руководство (3‑е изд.)/Под ред. Н. Т. Старковой. — СПб: Питер, 2002. — 576 с.
- MedUniver
- MedUniver
- Эндокринология. Том 2. Заболевания поджелудочной железы, паращитовидных и половых желез. Под ред. С. Б. Шустова. — СПб: СпецЛит, 2011. — 432 с.
- Балаболкин М. И., Клебанова Е. М., Креминская В. М. Дифференциальная диагностика и лечение эндокринных заболеваний (руководство). М.: «Медицина», 2002. — 751c.
- Dizon A. M. et al. Neuroglycopenic and other symptoms in patients with insulinoma // Am. J. Med. 1999, p. 307.
- Окороков А. Н. Диагностика болезней внутренних органов. Том 2. — М. Мед. лит., 2008–576 с.
- Калинин А. П. и соавт. Инсулинома. Медицинская газета, 2007, № 45, с. 8–9
Источник