Развитие поджелудочной железы анатомия
Эмбриональное развитие поджелудочной железы
Поджелудочная железа развивается из отдельных зачатков — вентрального и дорсального, — образующихся из соединения эмбриональных передней кишки со средней. Дорсальный зачаток увеличивается влево и формирует основную массу зрелой железы.
Вентральный зачаток, тесно связанный с развивающимся общим желчным протоком, первоначально отходит от двенадцатиперстной кишки. Он соединяется с дорсальной системой только на седьмой неделе внутриутробного развития, после ротации позади эмбриональной двенадцатиперстной кишки, и расположен каудально от дорсального зачатка.
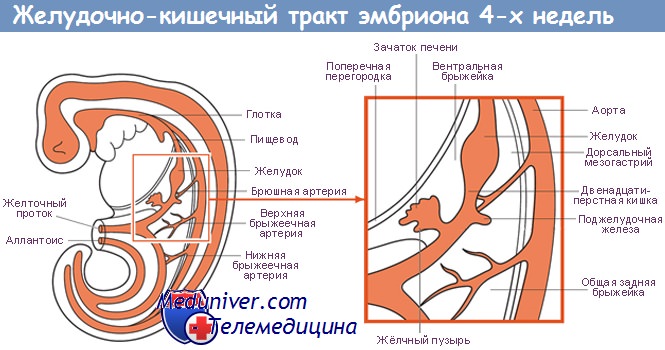
Обе части первичной поджелудочной железы содержат аксиальные протоки: дорсальный проток развивается из стенки двенадцатиперстной кишки, а вентральный — из общего желчного протока. При их слиянии вентральный проток (вирзунгов) продолжается дорсальным протоком (санториниев), образуя главный панкреатический проток.
Таким образом, общий желчный и панкреатический протоки открываются в двенадцатиперстную кишку на большом сосочке, тогда как часть дорсального протока внутри головки поджелудочной железы становится более или менее рудиментарной и открывается в двенадцатиперстную кишку проксимально от большого сосочка на небольшом добавочном или малом сосочке.
Полное отсутствие слияния систем двух протоков приводит к развитию разделенной поджелудочной железы. Такая аномалия встречается приблизительно у 5% людей и может быть предрасполагающим фактором панкреатита. Также возможно неполное слияние, при котором санториниев проток остается главным.
Недостаточный поворот тела вентрального зачатка по оси с устьем его протока может привести к развитию кольцевидной поджелудочной железы, окружающей вторую часть двенадцатиперстной кишки, что может вызвать обструкцию двенадцатиперстной кишки.
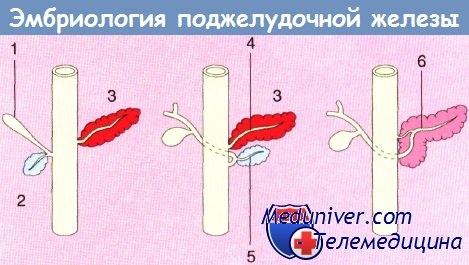
Схема, показывающая анатомию развивающейся поджелудочной железы:
1 — билиарный зачаток; 2 — вентральный;
3 — дорсальный; 4 — санториниев проток;
5 — вирзунгов проток; 6 — главный панкреатический проток.
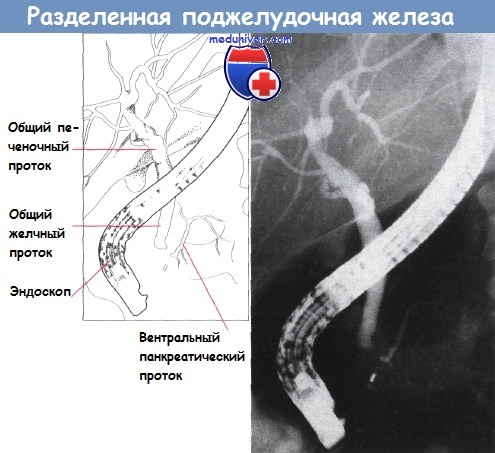
Разделенная поджелудочная железа. Определяются протоки в вентральной части железы.
Видно их отсутствие справа от позвоночника.
Хорошо заметно близкое расположение к поджелудочной железе общего желчного протока.
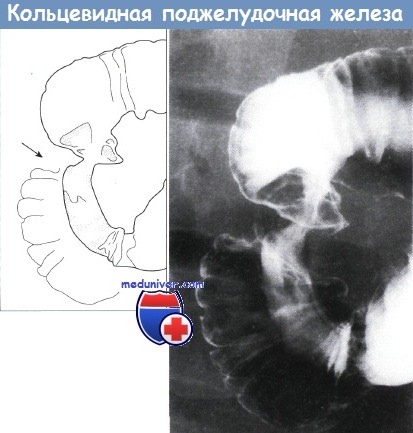
Верхний отдел желудочно-кишечного тракта, кольцевидная поджелудочная железа.
Наблюдается очаговое циркулярное ровное сужение середины второй части двенадцатиперстной кишки.
Дуоденальные складки и слизистая оболочка в остальном нормальные. Рентгенограмма с двойным контрастированием.
— Также рекомендуем «Острый панкреатит — диагностика»
Оглавление темы «Заболевания желудочно-кишечного тракта»:
- Сифилис заднего прохода — диагностика
- Гонорея прямой кишки — диагностика
- Предраковые состояния анальной области — диагностика
- Злокачественные опухоли анального канала — диагностика
- Врожденные аноректальные аномалии — диагностика
- Поджелудочная железа в норме — анатомия, методы обследования
- Эмбриональное развитие поджелудочной железы
- Острый панкреатит — диагностика
- Хронический панкреатит — диагностика
- Наследственный панкреатит — диагностика
Источник
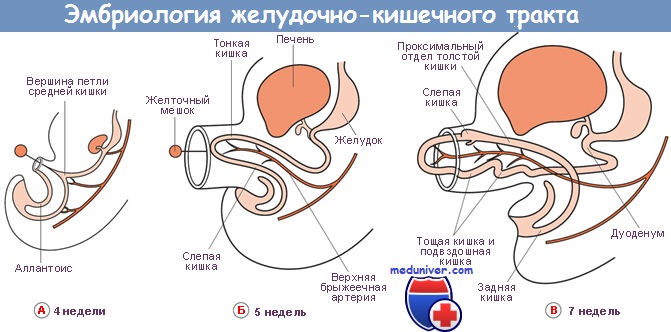
ПЖ в эмбриогенезе формируется из двух зачатков кишечной энтодермы — дорсального и вентрального — и из мезенхимы. Дорсальный зачаток развивается раньше вентрального: он появляется на 3-й неделе эмбриогенеза из печёночного дивертикула и первичной кишечной трубки, в то время как вентральный — только на 4—5-й неделе из развивающейся ДПК (из протокового отрезка средней кишки).
Иногда появляются сразу два вентральных панкреатических зачатка. Возможностью образования двойного вентрального зачатка и последующего его аномального развития объясняется механизм формирования кольцевидной ПЖ, что рядом авторов рассматривается как атавизм.
Основные процессы дифференпировки морфологических структур ПЖ происходят в период с середины 6-й до 12-й недели внутриутробного развития. В середине 5-й недели гестации ПЖ и ДПК входят в состав единого мезенхимального комплекса, отграниченного от полости тела. Этот тканевой комплекс соединен вентральной брыжейкой с желудком, а дорсальной — с задней стенкой полости тела. Формирующаяся ПЖ на этой стадии развития представлена системой ветвящихся трубочек, расположенных в толще мезенхимы. На 5-й неделе эмбрионального развития уже определяются два изолированных друг от друга отдела ПЖ, один из которых (вентральная часть) располагается в едином тканевом комплексе с ДПК, а другой (дорсальная часть) — лежит свободно в толще дорсальной брыжейки.
На 6-й неделе эмбрионального развития вентральная часть ПЖ по-прежнему плотно прилежит к ДПК, располагаясь с ней в едином тканевом комплексе. В середине 7-й недели эмбрионального развития начинается слияние вентрального и дорсального отделов ПЖ. Вентральный зачаток при этом вращается по часовой стрелке позади ДПК и срастается с дорсальным зачатком.
После слияния панкреатических зачатков происходят последовательные изменения формы органа. Так, в зависимости от гестационного возраста эмбриона, ПЖ по форме напоминает запятую, затем имеет форму вопросительного знака, приобретает булавовидную, а затем S-образную форму. Начиная с 8-й недели развития железа напоминает «лежащую» латинскую букву «S».
С середины 11-й-начала 12-й недели впервые можно говорить о формировании крючковидного отростка, который огибает формирующиеся верхние брыжеечные сосуды. Из вентрального зачатка формируются крючковидный отросток и нижние 2/3 головки ПЖ, затем из дорсального зачатка развиваются шейка, тело, хвост и верхняя часть головки органа.
Из протока вентрального зачатка, срастающегося с дорсальным зачатком, развивается главный панкреатический (вирсунгов) проток (ГПП), который служит основным дренажом ПЖ (см. рис. 1-1, CD). Проксимальный проток дорсального зачатка, известный как добавочный (санториниев) проток ПЖ, обычно сохраняется и открывается в ДПК через малый сосочек.
Во 2-й половине внутриутробного развития появляются дольки ПЖ и соединительнотканные междольковые перегородки. В этот период определяется топография синтеза белков: цитоплазматическая локализация, а также увеличение темпов синтеза. На 6-м месяце в ациноцитах видны секреторные гранулы, содержащие белки с амило- и липолитической активностью. Дифференцировка клеток ацинусов и протоков завершается к концу беременности.
Во время роста и вращения ДПК (см. рис. 1-1, показано стрелкой, CD) вентральный зачаток ПЖ перемещается к дорсальному, и впоследствии они срастаются. Первоначально общий жёлчный проток прикрепляется к вентральной части ДПК и сдвигается вокруг её дорсальной части, в то время как сама ДПК вращается. ГПП формируется в результате сращения дистальной части дорсального панкреатического протока и всего вентрального панкреатического протока.

Рис.1-1.Эмбриогенез поджелудочной железы: а–г — схематическое изображение последовательных этапов развития поджелудочной железы с 5-й по 8-ю неделю эмбрионального развития; д–ж — схематические изображения поперечных срезов через двенадцатиперстную кишку и развивающуюся поджелудочную железу
Таким образом, к 12-й неделе внутриутробного развития в ПЖ определяются основные структурные образования в зачатковой форме, или на той или иной стадии формирования. Их последующая дифференцировка обеспечивает весь диапазон функционирования не только в пренатальном, но и в постнатальном онтогенезе. Эндокринные участки железы (островки) развиваются как зачатки из начальных отрезков переднего и заднего протоков между 10-й и 14-й неделями гестации. После 16-й недели эндокринная часть ПЖ отделяется от протоков, приобретает собственное кровоснабжение и становится независимой от протоковой системы железы.
Нервная и сосудистая системы ПЖ начинают формироваться на 6—7-й неделе внутриутробного развития.
Формирование кровеносной системы заканчивается одновременно с дифференцировкой апинарных клеток к 7-му месяцу гестации. Формирование иннервации заканчивается в постнатальном и детском периоде. Морфофункциональное развитие ПЖ завершается только в возрасте 18—20 лет. После 40—50-летнего возраста намечаются гипотрофические изменения органа, связанные со склеротической трансформацией его кровеносных сосудов.
Аномалии при повороте или сращении зачатков развивающейся ПЖ могут приводить к специфическим врождённым аномалиям, таким как агенезия (аплазия) ПЖ, удвоение и как частный его случай — расщеплённая ПЖ (pancreas divisum), эктопическая ткань селезёнки в ПЖ, кольцевидная (pancreas annulare), добавочная ПЖ (pancreas aberrans), аномальное, панкреатобилпарное соустье, холедохоцеле и др.
Маев И.В., Кучерявый Ю.А.
Источник
Поджелудочная железа сочетает в себе экзокринную и эндокринную функции. По данным различных авторов, островки Лангерганса, отвечающие за эндокринную функцию, обнаруживаются уже у 44-миллиметрового человеческого эмбриона. Около 70-75% клеток островков являются (3-клетками, вырабатывающими инсулин, остальные 25-30% — а-клетки, продуцирующие глюкагон. Интенсивное развитие поджелудочной железы во внутриутробной жизни начинается с 6,5 мес и продолжается 1-й период жизни ребенка. У плода [3-клетки появляются несколько раньше (с 12-й недели) а-клеток. К концу 1 -го года масса поджелудочной железы превышает таковую у новорожденного в 4 раза. Второй скачок в развитии поджелудочной железы наблюдается в 5-6-летнем возрасте. К 13-15 годам поджелудочная железа по массе и размерам не отличается от таковой у взрослого человека. Полного развития она достигает к 25^40 годам.
Считают, что у человека процесс новообразования островков не заканчивается в эмбриональном развитии, а продолжается и после рождения. В течение 1-го года жизни повышается количество островковой ткани за счет увеличения числа островков, а в детском и юношеском возрасте островковая ткань продолжает увеличиваться за счет гипертрофии. Поджелудочная железа у доношенных новорожденных в среднем весит 2,84 г (у взрослых мужчин 71,9-73,6 г, у женщин — 69,1 г).
Инсулин в крови плода обнаруживается на 12-й неделе. В отличие от взрослых, секреция инсулина слабо зависит от концентрации глюкозы в крови плода. Глюкоза хорошо проходит через плаценту, поэтому содержание ее в крови в значительной степени зависит от гомеостаза глюкозы в материнском организме. Секреция инсулина у плода имеет большое значение для прироста массы тела. Это важный анаболический гормон, способствующий синтезу белков и жиров в организме плода. Инсулин плода регулирует транспорт аминокислот через клеточные мембраны. Гипергликемия в материнском организме (при сахарном диабете) сопровождается увеличением содержания глюкозы в крови плода, и, как правило, дети рождаются с избыточной массой тела. Рецепторы к инсулину созревают в последние недели антенатального и первые недели постнатального периода. Сначала они образуются в печени, затем — в мышцах. В первые дни после рождения секреция инсулина снижена в связи с физиологической гипогликемией. Через несколько дней содержание инсулина в крови возрастает, но регуляция его секреции еще не совершенна. При нагрузке глюкозой выделение инсулина у новорожденных увеличивается слабее и с большим латентным периодом, чем у старших детей и взрослых. У детей отмечаются индивидуальные особенности секреции инсулина. Так, при нагрузке глюкозой может наблюдаться наряду с нормальным усилением секреции инсулина как избыточная, так и недостаточная.
Глюкагон повышает уровень сахара в крови в результате распада гликогена в печени и расщепления жиров, что способствует сохранению энергетического гомеостаза при дефиците питательных веществ. Между действием глюкагона и инсулина в обеспечении клеток глюкозой существует синергизм. Глюкагон активирует гликоге-нолиз (распад гликогена), а инсулин обеспечивает использование полученной при этом глюкозы, открывая «ворота» в клетку. Действие его особенно важно для функционирования центральной нервной системы.
Гипофункция инсулярного аппарата вызывает резкое нарушение углеводного обмена — развитие сахарного диабета, приводящее к резкому истощению, нарушению роста, отставанию в умственном развитии, возникновению обменной катаракты (помутнению хрусталика), диабетической нефропатии и другим сосудистым нарушениям.
Сахарный диабет может возникнуть в любом возрасте. Как правило, у детей развивается диабет I типа, связанный с дефицитом продукции и секреции инсулина, а у взрослых и пожилых — диабет II типа, обусловленный понижением чувствительности клеточных рецепторов к инсулину, хотя его продукция может не нарушаться. По сведениям разных авторов, дети составляют от 3,5 до 8% среди больных сахарным диабетом. Начало сахарного диабета у детей бурное, с быстрым развитием симптомов и тяжелым течением. У них отмечается резкое снижение вкусовой чувствительности к сладкому, соленому и кислому, а иногда извращение вкуса на соленое и кислое. При современных методах лечения смертность, обусловленная сахарным диабетом, составляет в детском возрасте 0,3-0,4 человека на 100 000 населения.
Источник
Поджелудочная железа относится к железам, сочетающей в себе экзокринную и эндокринную функции. По данным различных авторов, островки Лангерганса, отвечающие за эндокринную функцию, обнаруживаются уже у 44-миллиметрового человеческого эмбриона. Интенсивное развитие поджелудочной железы во внутриутробной жизни начинается с 6,5 мес и продолжается первый период жизни ребенка. У плода |3-клетки появляются несколько раньше (с 12-й недели) а-клеток. К концу первого года масса поджелудочной железы превышает таковую у новорожденного в 4 раза. Второй скачок в развитии поджелудочной железы наблюдается в 5—6-летнем возрасте. К 13—15 годам поджелудочная железа по массе и размерам не отличается от таковой у взрослого человека. Полного развития она достигает к 25—40 годам.
Считают, что у человека процесс новообразования островков не заканчивается в эмбриональном развитии, а продолжается и после рождения. В течение 1-го года жизни повышается количество островковой ткани за счет увеличения числа островков, а в детском и юношеском возрасте островковая ткань продолжает увеличиваться за счет гипертрофии клеток. Поджелудочная железа у доношенных новорожденных в среднем весит 2,84 г (у взрослых мужчин 71,9— 73,6 г, у женщин — 69,1 г).
Островковая ткань продуцирует два гормона—инсулин и глюкагон.
Инсулин в крови плода обнаруживается на 12-й неделе. В отличие от взрослых, секреция инсулина слабо зависит от концентрации глюкозы в крови плода. Глюкоза хорошо проходит через плаценту, поэтому содержание ее в крови в значительной степени зависит от гомеостаза глюкозы в материнском организме. Секреция инсулина у плода имеет большое значение для прироста массы тела. Это важный анаболический гормон, способствующий синтезу белков и жиров в организме плода. Инсулин плода регулирует транспорт аминокислот через клеточные мембраны. Гипергликемия в материнском организме (при сахарном диабете) сопровождается увеличением содержания глюкозы в крови плода, и, как правило, дети рождаются с избыточной массой тела. Рецепторы к инсулину созревают в последние недели антенатального и первые недели постнатального периода. Сначала они образуются в печени, затем—в мышцах. В первые дни после рождения секреция инсулина снижена в связи с физиологической гипогликемией. Через несколько дней содержание инсулина в крови возрастает, но регуляция его секреции еще не совершенна. При нагрузке глюкозой выделение инсулина у новорожденных увеличивается слабее и с большим латентным периодом, чем у старших детей и взрослых. У детей отмечаются индивидуальные особенности секреции инсулина. Так, при нагрузке глюкозой может наблюдаться наряду с нормальным усилением секреции инсулина как избыточное, так и недостаточное его выделение.
Глюкагон повышает уровень сахара в крови путем распада гликогена в печени и расщепления жиров, что способствует сохранению энергетического гомеостаза при дефиците питательных веществ. Между действием глюкагона и инсулина в обеспечении клеток глюкозой существует синергизм. Глюкагон активирует гликогенолиз, а инсулин обеспечивает использование полученной при этом глюкозы, открывая «ворота» в клетку. Действие его особенно важно для функционирования ЦНС.
Гипофункция инсулярного аппарата вызывает резкое нарушение углеводного обмена — развитие сахарного диабета, приводящее к резкому истощению, нарушению роста, отставанию в умственном развитии, и нередко возникновению обменной катаракты (помутнению хрусталика), диабетической нефропатии и другим сосудистым нарушениям.
Сахарный диабет может возникнуть в любом возрасте. Как правило, у детей развивается диабет 1-го типа, связанный с дефицитом продукции и секреции инсулина, а у взрослых и пожилых — диабет 2-го типа, обусловленный понижением чувствительности клеточных рецепторов к инсулину, хотя его продукция может не нарушаться. По сведениям разных авторов, дети составляют от 3,5 до 8% среди больных сахарным диабетом. Начало сахарного диабета у детей бурное, с быстрым развитием симптомов и тяжелым течением. У них отмечается резкое снижение вкусовой чувствительности к сладкому, соленому и кислому, а иногда извращение вкуса на соленое и кислое. При современных методах лечения смертность, обусловленная сахарным диабетом, составляет в детском возрасте 0,3—0,4 человека на 100 тыс. населения.
Источник
Поджелудочная железа относится к железам, сочетающим в себе экзокринную и эндокринную функции. Поданным различных авторов, островки Лангерганса, отвечающие за эндокринную функцию, обнаруживаются уже у 44-миллиметрового человеческого эмбриона. Интенсивное развитие поджелудочной железы во внутриутробной жизни начинается с 6,5 месяцев и продолжается первый период жизни ребенка. К концу первого года жизни масса поджелудочной железы превышает таковую у новорожденного в 4 раза. Второй скачок в развитии поджелудочной железы наблюдается в пяти-шестилетнем возрасте. К 13—15 годам поджелудочная железа по массе и размерам не отличается от таковой у взрослого человека. Полного развития она достигает к 25—40 годам.
Островковая ткань продуцирует два гормона — инсулин и глю- кагон.
Инсулин в крови плода обнаруживается на 12-й неделе. В отличие от взрослых, секреция инсулина слабо зависит от концентрации глюкозы в крови плода. Глюкоза хорошо проходит через плаценту, поэтому содержание ее в крови в значительной степени зависит от гомеостаза глюкозы в материнском организме. Секреция инсулина у плода имеет большое значение для прироста массы тела. Это важный анаболический гормон, способствующий синтезу белков и жиров в организме плода. Инсулин плода регулирует транспорт аминокислот через клеточные мембраны. Гипергликемия в материнском организме (при сахарном диабете) сопровождается увеличением содержания глюкозы в крови плода, и, как правило, дети рождаются с избыточной массой тела. Рецепторы к инсулину созревают в последние недели антенатального и первые недели постнатального периода. Сначала они образуются в печени, затем — в мышцах. В первые дни после рождения секреция инсулина снижена в связи с физиологической гипогликемией. Через несколько дней содержание инсулина в крови возрастает, но регуляция его секреции еще не совершенна. При нагрузке глюкозой выделение инсулина у новорожденных увеличивается слабее и с большим латентным периодом, чем у старших детей и взрослых. У детей отмечаются индивидуальные особенности секреции инсулина. Так, при нагрузке глюкозой может наблюдаться наряду с нормальным усилением секре- цииинсулина как избыточная, так и недостаточная.
Глюкагон повышает уровень сахара в крови путем распада гликогена в печени и расщепления жиров, что способствует сохранению энергетического гомеостаза при дефиците питательных веществ. Между действием глюкагона и инсулина в обеспечении клеток глюкозой существует синергизм. Глюкагон активирует гликогенолиз (распад гликогена), а инсулин обеспечивает использование полученной при этом глюкозы, открывая «ворота» в клетку. Действие его особенно важно для функционирования ЦНС.
Гипофункция инсулярного аппарата вызывает резкое нарушение углеводного обмена — развитие сахарного диабета, приводящее к истощению, нарушению роста, отставанию в умственном развитии, нередко возникновению обменной катаракты (помутнению хрусталика), диабетической нефропатии и другим сосудистым нарушениям.
Сахарный диабет может возникнуть в любом возрасте. Как правило, у детей развивается диабет I типа, связанный с дефицитом продукции и секреции инсулина, а у взрослых и пожилых — диабет II типа, обусловленный понижением чувствительности клеточных рецепторов к инсулину, хотя его продукция может не нарушаться. По сведениям разных авторов, дети составляют от 3,5 до 8% среди больных сахарным диабетом. Начало сахарного диабета у детей бурное, с быстрым развитием симптомов и тяжелым течением. У них отмечается резкое снижение вкусовой чувствительности к сладкому, соленому и кислому, а иногда извращение вкуса на соленое и кислое. При современных методах лечения смертность, обусловленная сахарным диабетом, составляет в детском возрасте 0,3—0,4 человека на 100 тыс. населения.
Источник

