Рецепторы клеток поджелудочной железы
Поджелудочная железа (лат. páncreas) – это орган в брюшной полости размером с ладонь, расположенный между желудком и позвоночником.
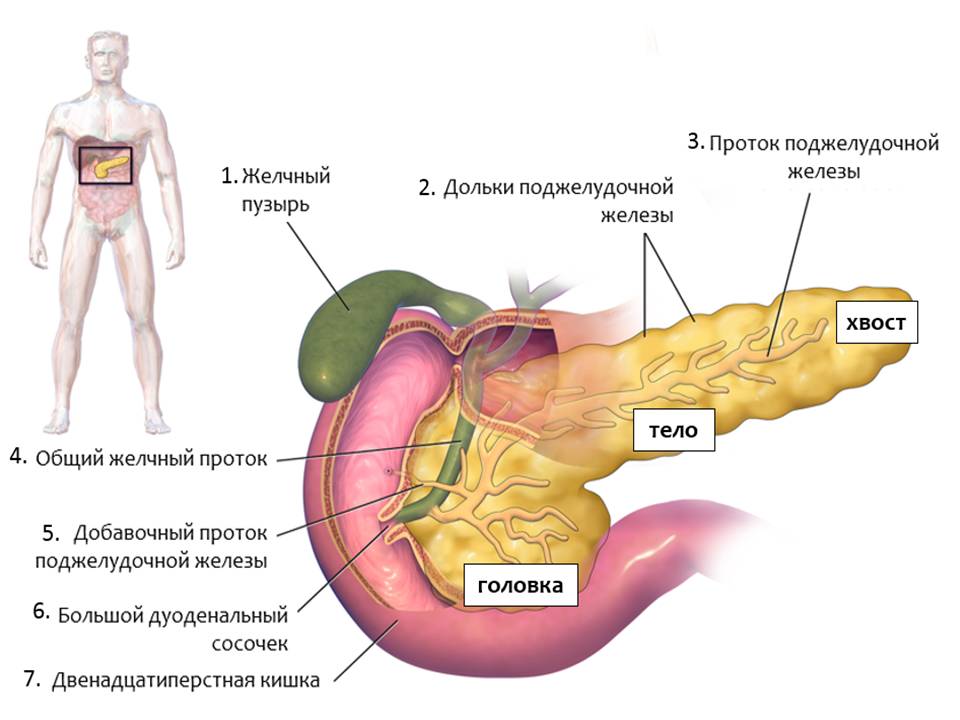
Рис. 1. Строение поджелудочной железы. Адапт. из Wikipedia
- Желчный пузырь
- Дольки поджелудочной железы
- Проток поджелудочной железы
- Общий желчный проток
- Добавочный проток поджелудочной железы
- Большой дуоденальный сосочек
- Двенадцатиперстная кишка
В поджелудочной железе выделяют три отдела: головку, тело, хвост (рис.1). Все отделы поджелудочной железы выполняют одинаковые функции, а именно:
- производят ферменты, которые помогают переваривать пищу;
- производят гормоны, такие как инсулин и глюкагон, которые контролируют уровень глюкозы крови.
Пищеварительные ферменты из поджелудочной железы попадают в кишечник через проток поджелудочной железы [3]. Проток поджелудочной железы[3] соединяется с общим желчным протоком [4], по которому идет желчь из желчного пузыря [1] и печени, и они впадают в двенадцатиперстную кишку[7] в области большого дуоденального сосочка[6]. Эта функция поджелудочной железы также называется экзокринная, то есть направленная наружу. Основная масса поджелудочной железы выполняет эту функцию.
Вторая функция поджелудочной железы – эндокринная функция, то есть направленная внутрь – это производство гормонов, контролирующих уровень глюкозы крови. Выполняют эту функцию отдельные группы клеток, их называют островки поджелудочной железы или островки Лангерганса. Во всей поджелудочной железе около 1 миллиона островков, что составляет 1-2% от общей массы поджелудочной железы. Они располагаются диффузно во всем объеме поджелудочной железы. В отличии от ферментов, которые синтезируются в проток поджелудочной железы и стекают в кишечник, клетки островков Лангерганса продуцируют гормоны непосредственно в кровь, а именно в мелкие кровеносные сосуды, проходящие через поджелудочную железу.
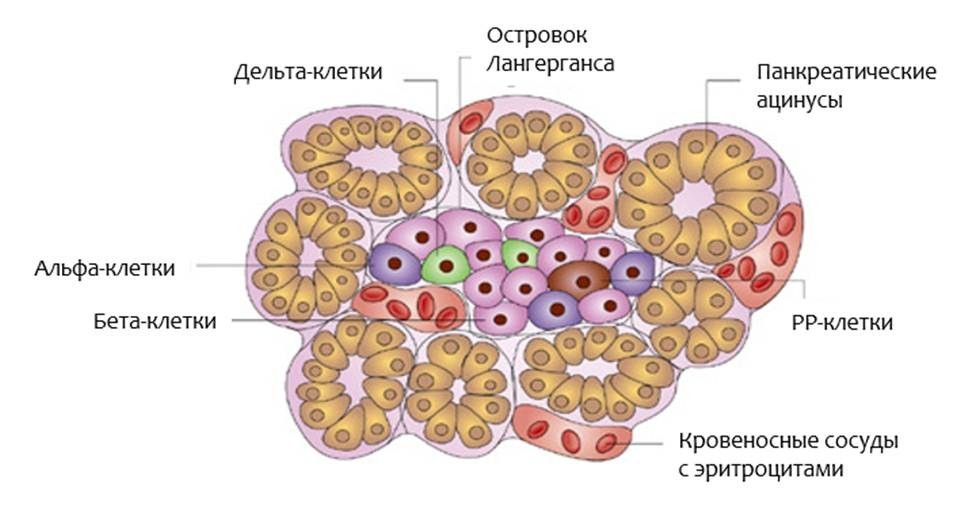
Рис.2. Островок Лангерганса. Адапт. из Anatomy, Physiology, and Pathology of the Digestive System. Introduction to Medical Science — Duke University TIP
Если вы посмотрите на островок Лангерганса через микроскоп (рис.2), вы найдете в нем:
- Бета-клетки, которые производят инсулин
- Альфа-клетки, которые производят глюкагон
- Дельта-клетки, которые производят соматостатин
- РР-клетки, которые производят панкреатический полипептид (функция которого до сих пор не ясна)
Бета-клетки содержат своего рода «встроенный» глюкометр. Если уровень глюкозы крови повышается, то они выпускают инсулин. Если уровень глюкозы крови снижается, то секреция инсулина прекращается. Если уровень глюкозы падает ниже нормального уровня, то альфа-клетки высвобождают глюкагон. Другие гормоны, вырабатывающиеся клетками островков Лангерганса, нужны для того, чтобы островковые клетки взаимодействовали друг с другом. Островки Лангерганса являются очень маленькими, примерно 0,1 мм в диаметре. Все островки взрослого человека содержат приблизительно 200 единиц инсулина. Объем их всех в сочетании не больше, чем кончик пальца. Инсулин является гормоном, который помогает организму усваивать и использовать глюкозу и другие питательные вещества. Он как «ключ, открывающий двери» для глюкозы внутрь клетки. Без инсулина, уровень глюкозы крови повышается (подробнее об инсулине в разделе Инсулин и его значение для организма).
Роль поджелудочной железы в развитии сахарного диабета
Для того чтобы разобраться в этом вопросе, рассмотрим каждый тип сахарного диабета отдельно.
Сахарный диабет 1 типа
При сахарном диабете 1 типа происходит гибель бета-клеток, следовательно, поджелудочная железа не производит или производит незначительное количество инсулина. Сахарный диабет 1 типа обычно развивается, когда иммунная система разрушает бета-клетки поджелудочной железы. Это называется аутоиммунный ответ. Собственная иммунная система воспринимает бета-клетки как инородные объекты, такие как бактерии или вирусы, и начинает их атаковать и разрушать. Когда более 90% бета-клеток разрушаются (этот процесс занимает от нескольких месяцев до максимум нескольких лет), организм начинает ощущать нехватку инсулина, и уровень глюкозы крови повышается. Тогда у человека появляются «большие» симптомы сахарного диабета, такие как жажда, учащенное мочеиспускание, похудание. Раньше этот тип сахарного диабета называли инсулин-зависимый сахарный диабет. Это значит, что для лечения необходим инсулин сразу, как только поставили диагноз.
На данный момент остается неизвестным, почему возникает этот аутоиммунный ответ. Генетически человеку может передаться склонность к аутоиммунным заболеваниям (сахарный диабет 1 типа является только одним из многих аутоиммунных заболеваний), но вот что именно служит пусковым механизмом, триггером сахарного диабета 1 типа, пока что недостаточно ясно. (Подробней об этом вы можете узнать в разделе Причины сахарного диабета 1 типа).
Сахарный диабет 2 типа
При сахарном диабете 2 типа способность поджелудочной железы вырабатывать инсулин не исчезает полностью. Но организм становится все более устойчивым (резистентным) к инсулину. То есть создается ситуация, когда нормальный уровень инсулина крови не может «открыть глюкозе дверь в клетку». Следовательно, если организм не реагирует на нормальный уровень инсулина крови, то поджелудочной железе приходится вырабатывать все больше и больше инсулина. И если на этот процесс никак не повлиять, то это приведет к истощению поджелудочной железы и абсолютной недостаточности инсулина.
Причины сахарного диабета 2 типа – это комплекс генетических факторов и условий окружающей среды. Генетически человек наследует группу генов предрасположенности к сахарному диабету 2 типа, и чаще всего у человека с СД 2 типа есть родственники с СД 2 типа. Также некоторые этнические группы имеют более высокую предрасположенность к этому заболеванию. Но разовьётся сахарный диабет 2 типа или нет зависит от самого человека, от его образа жизни. На это влияет характер питания, уровень физической активности и т.д. (Подробней об этом вы можете узнать в разделе Причины сахарного диабета 2 типа).
Таблетки, используемые для лечения сахарного диабета 2 типа, не содержат инсулин, они действуют либо путем увеличения чувствительности организма к инсулину, либо путем увеличения секреции инсулина из поджелудочной железы. Диета и снижение избыточного веса (если он есть), также являются основными компонентами лечения сахарного диабета 2 типа. Редко, когда инъекции инсулина необходимым на ранних стадиях сахарного диабета 2 типа. Но при истощении поджелудочной железы инсулинотерапия может стать необходимым компонентом лечения сахарного диабета 2 типа.
Гестационный сахарный диабет
Эта форма диабета возникает во время беременности и в большинстве случаев проходит после рождения ребенка.
В течение всей беременности плацента вырабатывает гормоны, которые препятствуют нормальной работе инсулина (они повышают резистентность к инсулину). Как правило, поджелудочная железа может просто увеличить количество производимого инсулина, и у женщины будет нормальный уровень глюкозы крови. Иногда, однако, поджелудочная железа не может компенсировать потребность организма в инсулине, и тогда у женщины повышается уровень глюкозы крови и развивается гестационный сахарный диабет.
Все беременные женщины должны быть обследованы на наличие гестационного сахарного диабета. Важно распознавать и лечить гестационный сахарный диабет как можно скорее, чтобы свести к минимуму риск осложнений у ребенка. (Подробней об этом вы можете узнать в разделе Гестационный сахарный диабет).
Источник
Секреция ПЖ находится под контролем нервных и гуморальных механизмов. Начальную секрецию ПЖ вызывают вид, запах пищи и другие раздражители (условнорефлекторные сигналы), а также жевание и глотание (безусловнорефлекторные сигналы). При этом нервные сигналы, формирующиеся в рецепторах полости рта и глотки, достигают продолговатого мозга, и затем эфферентные влияния по волокнам блуждающего нерва поступают к железе и вызывают её секрецию.
У человека с фистулой ГПП выделение панкреатического сока начинается через 2—3 мин после того, как он увидел пищу или услышат о ней. Это пример условнорефлекторного пути возбуждения панкреатической секреции. Симпатические волокна, иннервирующие ПЖ, тормозят её секреторную активность и в то же время изменяют реактивность железы по отношению к другим воздействиям, усиливая синтез органических веществ.
Торможение панкреатической секреции происходит при раздражении многих чувствительных нервов, при болевых реакциях, во время сна, при напряжённой физической и умственной работе.
Для стимуляции панкреатической секреции прямые нервные влияния имеют меньшее значение, нежели гуморальные. Ведущее значение в гуморальной регуляции секреции ПЖ принадлежит желудочно-кишечным гормонам.
Большинство регуляторов секреции ферментов ПЖ действуют на рецепторы мембраны ацинарных клеток, расположенные на их базолатеральной поверхности. Выделяют рецепторы ХК, бомбезина, ацетилхолина, субстанции Р, ВИП, секретина.
Стимуляторы панкреатической секреции. ВИП и секретин стимулируют панкреатическую секрецию, активируя аденилатциклазу. Как и в других типах клеток, аденилатциклаза способствует образованию циклического аденозинмонофосфата, в результате чего протеинкиназа А, усиливающая секрецию панкреатического сока, богатого бикарбонатами, переходит в активную форму. Другие стимуляторы поджелудочной секреции (ХК, ацетилхолин, гастрин-рилизинг пептид, субстанция Р) действуют на специфические рецепторы, во внутриклеточной передаче сигнала от которых задействованы альтернативные вторичные мессенджеры.
Эти вещества повышают внутриклеточное содержание циклического гуанозинмонофосфата, что приводит к увеличению внутриклеточного содержания инозитолтрифосфата, диацилглицерола, арахидоновой кислоты и кальция. Эти промежуточные вещества-посредники активируют различные протеинкиназы, в результате этого повышается секреция ферментов. Данные, полученные в опытах на животных, свидетельствуют, что действие комбинации агонистов на различные мембранные рецепторы может вызывать синергический, но не суммарный (аддитивный) эффект. Например, ХК увеличивает секрецию бикарбонатов, стимулированную секретином, но секретин не повышает секреторный ответ на действие ХК.
Ингибиторы секреции поджелудочной железы. Различные вещества, ответственные за подавление панкреатической секреции, действуют по принципу отрицательной обратной связи во время и после приёма пищи.
Панкреатический полипептид (ПП) представляет собой пептидный гормон, образующийся в островках Лангерганса и подавляющий панкреатическую секрецию воды, бикарбонатов и ферментов. Концентрация ПП в плазме крови возрастает после мнимого кормления, после приёма пищи, после экспериментального закисления среды ДПК, а также при стимуляции блуждающего нерва, при действии ХК, секретина, ВИП. ПП может выступать как антагонист мускариновых рецепторов и способен ингибировать выделение ацетилхолина из постганглионарных нейронов ПЖ; его конечный эффект проявляется на уровне ацинарных клеток.
Пептид YY высвобождается в дистальной части подвздошной кишки и и толстой кишке в ответ на поступление пищи смешанного характера, по жиры, находящиеся в просвете кишки, в большей степени способны стимулировать его секрецию. Пептид YY уменьшает чувствительность ПЖ к действию секретина и ХК, возможно, за счёт уменьшения секреции ацетилхолина и норадреналина и ингибирования выделения ХК слизистой оболочкой ДПК.
Соматостатин ингибирует секрецию секретина слизистой оболочкой ДПК, а также уменьшает чувствительность к секретину рецепторных полей. Единственный эффект соматостатина — снижение секреции ферментов и бикарбонатов ПЖ. Соматостатин синтезируют клетки слизистой оболочки желудка и кишечника, а также D-клетки островков Лангерганса. Его активность составляет только около 25% от активности гипоталамического соматостатина. Но только соматостатин, продуцируемый слизистой оболочкой тонкой кишки, оказывает угнетающее действие на секрецию ПЖ.
Выделение соматостатина происходит при участии автономной нервной системы в ответ на поступление жиров и аминокислот с пищей.
Соматостатин блокирует панкреатическую секрецию несколькими способами. Во-первых, он действует путём угнетения продукции стимулирующих пептидов (ХК). Во-вторых, посредством угнетающего воздействия на ЦНС и регулируя работу интрапанкреатических ганглиев, соматостатин ингибирует поступление ацетилхолина в пресинаптическую щель и, возможно, ингибирует выработку инсулина. Хотя рецепторы к соматостатину найдены также в ацинарных клетках, эти рецепторы скорее способствуют увеличению секреции, чем блокируют её.
Другие ингибиторы, представленные среди гормонов эндокринных клеток островков Лангерганса, включают панкреатический глюкагон и панкреастатин, а также нейропептиды: кальцнтонин-генерирующий пептид и энкефалины (табл. 1-3). Панкреатический глюкагон ингибирует секрецию ПЖ, стимулированную ХК, секретином или пищей; угнетает секрецию бикарбонатов, воды и ферментов. Панкреастатин ингибирует панкреатическую секрецию, тормозя высвобождение ацетилхолина эфферентными окончаниями блуждающего нерва. Кальцитонин-генерирующий пептид может проявлять свою активность через стимуляцию выделения соматостатина. Энкефалины и подобные им опиоиды снижают выделение секретина слизистой оболочкой ДПК и могут также ингибировать высвобождение ацетилхолина.
Таблица 1-3. Ингибиторные нейромодуляторы

Маев И.В., Кучерявый Ю.А.
Опубликовал Константин Моканов
Источник
Эндокринная часть поджелудочной железы представлена группами «светлых» клеток », расположенных среди экзокринной ткани, которые называются островками поджелудочной железы, или островками Лангерганса. Масса этой ткани в поджелудочной железе не превышает 1-2%. Больше содержит ее хвостовой отдел железы. Островки, особенно их центральная часть, хорошо оснащенные капиллярами. Иннервация поджелудочной железы осуществляется ветвями симпатичных, блуждающего и спинальных нервов. Непосредственно в островках заканчиваются постганглионарные симпатические и парасимпатические волокна. В островках поджелудочной железы выделяют три основных типа клеток (бета-, альфа-и дельта-), которые различаются по характеру секреторных гранул и видом производимых гормонов. Основную массу островков Лангерганса составляют бета-клетки.
Гормоны островков поджелудочной железы. В бета-клетках синтезируется гормон инсулин (в форме проинсулина), в альфа-клетках — глюкагон, в дельта-клетках — соматостатин. Кроме того, из экстрактов ткани поджелудочной железы выделены гормоны ваготонин, цеятропнеин, бомбезин и липокаин.
Инсулин — белковый гормон, в состав которого входит цинк. Он является первым гормоном и первым белком, синтезированным искусственно.
Инсулин участвует в регуляции углеводного, белкового и липидного обмена. Под его воздействием уменьшается концентрация сахара в крови — возникает гипогликемия. Это связано с тем, что инсулин повышает проницаемость клеточных мембран для глюкозы, усиливая поступление глюкозы внутрь клетки (за исключением клеток головного мозга), способствует превращению глюкозы в гликоген в печени и мышцах, снижает глюконеогенез (образование глюкозы из аминокислот) . Кроме влияния на углеводный обмен, инсулин стимулирует синтез белка из аминокислот и их активный транспорт в клетки. Он также участвует в регуляции жирового обмена, способствуя образованию высших жирных кислот из продуктов углеводного обмена (липогенеза), а также усиливая способность жировой ткани и клеток печени к захвату свободных жирных кислот и накопление их в форме триглицеридов (липидогенез).
В механизме действия инсулина на углеводный обмен важную роль
играют специфические рецепторы, расположенные на плазматической мембране клеток-мишеней. Взаимодействие инсулина с рецепторами реализуется через подавление аденилатциклазы и активации тирозинкиназы, которая способствует проникновению инсулина в клетку и повышению активности гексокиназы (первая стадия гликолиза). Кроме этого, активизируется пентозный шунт с последующим образованием НАД (НАДФ)-никотинамидных коферментов, которые нужны для осуществления липогенеза.
Глюкагон усиливает гликогенолиз в печени и повышает уровень глюкозы в крови за счет активации цАМФ. В этом глюкагон является антагонистом инсулина и синергистов адреналина. Глюкагон способствует глюконеогенеза, ускоряет окисление жирных кислот в печени.
Ваготонин повышает тонус блуждающих нервов, их активность. иХентропнеин возбуждает дыхательный центр, способствует расслаблению гладких мышц бронхов, вследствие чего их просвет увеличивается. Кроме того, центропнеин повышает способность гемоглобина эритроцитов связывать кислород и улучшает его транспорт. Липокаин участвует в мобилизации жира из депо. Бомбезин стимулирует выделение пепсина желудком и отвечает за насыщение организма.
Регуляция секреции инсулина и глюкагона. Регуляция секреции инсулина зависит от содержания глюкозы в крови. Повышение его в крови (гипергликемия) приводит к увеличению поступления инсулина в кровь, снижение (гипогликемия)-к снижению сиродукции и поступления этого гормона в сосудистое русло.
Как «измеряется» уровень глюкозы в крови? Установлено, что изменение уровня глюкозы в крови воспринимается специализированными клетками — глюкорецепторы поджелудочной железы, каротидного синуса, паравентрикулярного ядер гипоталамуса. При повышении уровня глюкозы в крови происходит активизация рецепторов — клеток поджелудочной железы, которые отвечают на этот стимул повышением синтеза и выделением инсулина в кровь. Описанный эффект происходит лишь при окислении глюкозы в бета-клитийи и активации аденилатциклазы, повышении уровня Са2 + в цитозоле при наличии кальмодулина и активизации полифосфоинозитиднои системы.
В случае снижения уровня глюкозы в крови раздражаются рецепторы альфа-клеток железы, хцо приводит к синтезу и секреции глюкагона, повышение уровня сахара. Эта реакция происходит только при предварительном окислении глюкозы и повышенной концентрации Са2 + в альфа-клетках железы.
Глюкорецепторы каротидного синуса реагируют на повышение, так и на снижение уровня сахара в крови. Информация от них передается дорсальным ядрам блуждающего нерва, расположенных в продолговатом мозге. От нервных клеток ядра импульсы волокнами блуждающего нерва распространяются на ганглиев, которые локализуются в ткани поджелудочной железы, а затем в бета-клеток островков поджелудочной железы. Предшественник инсулина, который образуется в них (проинсулин), переносится в клеточный комплекс Гольджи, где происходит цАМФ-зависимый процесс — превращения проинсулина в инсулин. Под влиянием инсулина глюкоза содержится в печени, мышцах, превращается в гликоген, и уровень сахара в крови восстанавливается до нормальных величин. Если уровень глюкозы в крови снижается, то происходит торможение активности нервных клеток паравентрикулярного ядер гипоталамуса и как следствие этого — снижение секреции инсулина. Установлено влияние различных отделов нервной системы на секрецию инсулина. Первые результаты в этом направлении получены в клинике.
Хорошо известно, что сахарный диабет развивается после психической травмы. Доказано, что условнорефлекторные раздражители, сигнализирующие о поступлении сахара, гипнотическое внушение о введении сахара обусловливают снижение гликемии (вследствие повышенной секреции инсулина). Вегетативная нервная система (парасимпатическая и симпатическая) также имеет значение для регуляции эндокринной функции поджелудочной железы.
Стимуляция блуждающего нерва сопровождается гипогликемией вследствие повышения секреции инсулина. Возбуждение симпатической нервной системы и введение адреналина (или норадреналина) приводит к повышению уровня сахара в крови.
В регуляции секреции инсулина участвует ряд гормонов. Так секрецию инсулина стимулируют гормон роста (соматотропин) аденогипофиза, гормоны щитовидной железы, ЖКТ (кишечный глюкагон, секретин, холецистокинин и др.)., Простагландин Е и. Основан в дельта-клетках островкового аппарата и гипоталамусе, соматотропин тормозит секрецию инсулина.
Регуляция секреции глюкагона также осуществляется через стимуляцию глюкорецепторы в переднем гипоталамусе, которые реагируют на изменение уровня глюкозы в крови. Так, при его повышении происходит торможение секреции глюкагона, а при снижении — ее увеличение. На образование глюкагона в альфа-клетках влияют и соматотропин аденогипофиза, который повышает активность альфа-клеток. Соматостатин, наоборот, тормозит образование и выделение глюкагона.
При уменьшении концентрации глюкозы в крови ниже 1,78 ммоль / л (норма-4 ,44-6, 66 ммоль / л) появляются характерные симптомы, а именно: чрезмерное потоотделение, тахикардия, сильный голод и возбуждение. Если уровень глюкозы продолжает снижаться, то развивается гипогликемическая кома, которая сопровождается потерей сознания и может быстро привести смерть. Непосредственной причиной ее является недостаточное обеспечение клеток мозга глюкозой, которая является для них единственным энергетическим источником. В этих случаях эффективным средством лечения является введение глюкозы.
В случае инсулярной недостаточности островкового аппарата поджелудочной железы развивается сахарный диабет. Основными проявлениями этого заболевания являются гипергликемия, глюкозурия (появление сахара в моче), повышение количества (до 10 л в сутки) выделяемой мочи (полиурия), жажда и чрезмерный аппетит. Причиной увеличения содержания сахара в крови у больных сахарным диабетом является утрата способности печени откладывать глюкозу в виде гликогена, а клеток других органов — утилизировать ее. Если болезнь развивается в молодом возрасте, то она обусловлена обычно снижением числа бета-клеток островкового аппарата. У взрослых секреция инсулина может быть пригниченую (особенно в начальной стадии заболевания) вследствие устойчивости (резистентности) к инсулину, которая связана с недостаточностью рецепторов инсулина на клетках-мишенях, или образованием комплекса белок — инсулин, который является неактивной формой гормона.
Источник


