Регуляция поджелудочной железы инсулин
Гормонами поджелудочной железы являются инсулин и глюкагон.
Глюкагон
Строение
Представляет собой полипептид, включающий 29 аминокислот с молекулярной массой 3,5 кДа и периодом полураспада 3-6 мин.
Синтез
Осуществляется в клетках поджелудочной железы и в клетках тонкого кишечника.
Регуляция синтеза и секреции
Активируют: гипогликемия, адреналин.
Уменьшают: глюкоза, жирные кислоты.
Механизм действия
Аденилатциклазный активирующий.
Мишени и эффекты
Конечным эффектом является повышение концентрации глюкозы и жирных кислот в крови.
Жировая ткань
- повышает активность внутриклеточной гормон-чувствительной ТАГ-липазы и, соответственно, стимулирует липолиз.
Печень
- активация глюконеогенеза и гликогенолиза,
- за счет повышенного поступления жирных кислот из жировой ткани усиливает кетогенез.
Патология
Гиперфункция
Глюкагонома – редко встречающееся новообразование из группы нейроэндокринных опухолей. У больных отмечается гипергликемия и поражение кожи и слизистых оболочек.
Инсулин
Дополнительная, более подробная информация, об инсулине находится на следующей странице.
Строение
Представляет собой полипептид из 51 аминокислоты, массой 5,7 кД, состоящий из двух цепей А и В, связанных между собой дисульфидными мостиками.
Синтез
Синтезируется в клетках поджелудочной железы в виде проинсулина, в этом виде он упаковывается в секреторные гранулы и уже здесь образуется инсулин и С-пептид.
Регуляция синтеза и секреции
Активируют синтез и секрецию:
- глюкоза крови – главный регулятор, пороговая концентрация для секреции инсулина – 5,5 ммоль/л,
- жирные кислоты и аминокислоты,
- влияния n.vagus – находится под контролем гипоталамуса, активность которого определяется концентрацией глюкозы крови,
- гормоны ЖКТ: холецистокинин, секретин, гастрин, энтероглюкагон, желудочный ингибирующий полипептид,
- хроническое воздействие гормона роста, глюкокортикоидов, эстрогенов, прогестинов.
Уменьшают: влияние симпато-адреналовой системы.
Механизм действия
Осуществляется через рецепторы с тирозинкиназной активностью (подробно).
Мишени и эффекты
Основным эффектом является снижение концентрации глюкозы в крови благодаря усилению транспорта глюкозы внутрь миоцитов и адипоцитов и активации внутриклеточных реакций утилизации глюкозы:
- активируя фосфодиэстеразу, которая разрушает вторичный мессенджер цАМФ, инсулин прерывает эффекты адреналина и глюкагона на печень и жировую ткань.
- в мышцах и жировой ткани стимулирует транспорт глюкозы в клетки (активация Глют-4),
- в печени и мышцах ускоряет синтез гликогена (активация гликогенсинтазы).
- в печени, мышцах и адипоцитах инсулин стимулирует гликолиз, активируя фосфофруктокиназу и пируваткиназу.
- полученный в гликолизе пируват превращается в ацетил-SКоА под влиянием активированного инсулином пируватдегидрогеназного комплекса, и далее используется для синтеза жирных кислот. Превращение ацетил-SКоА в малонил-SКоА, первый субстрат синтеза жирных кислот, также стимулируется инсулином (ацетил-SКоА-карбоксилаза).
- в мышцах усиливает транспорт нейтральных аминокислот в миоциты и стимулирует трансляцию (рибосомальный синтез белков).
Ряд эффектов инсулина заключается в изменении транскрипции генов и скорости трансляции ферментов, отвечающих за обмен веществ, за рост и деление клеток.
Благодаря этому индуцируется синтез ферментов метаболизма
- углеводов в печени (глюкокиназа, пируваткиназа, глюкозо-6-фосфатдегидрогеназа),
- липидов в печени (АТФ-цитрат-лиаза, ацетил-SКоА-карбоксилаза, синтаза жирных кислот, цитозольная малатдегидрогеназа) и адипоцитах (ГАФ-дегидрогеназа, пальмитатсинтаза, липопротеинлипаза).
и происходит репрессия фосфоенолпируват-карбоксикиназы (подавление глюконеогенеза).
Инактивация инсулина
Инактивация инсулина начинается после интернализации инсулин-рецепторного комплекса и образования эндосомы, в которой и происходит деградация инсулина. Участвуют две ферментные системы:
- Глутатион-инсулин-трансгидрогеназа, которая восстанавливает дисульфидные связи между цепями А и В, в результате чего гормон распадается.
- Инсулиназа (инсулин-протеиназа), гидролизующая инсулин до аминокислот.
Период полужизни инсулина не превышает 5-6 минут. Происходит деградация в основном в печени и почках, но и другие ткани принимают в этом участие. Также в почках инсулин может фильтроваться, захватываться эпителиоцитами проксимальных канальцев и разрушаться до аминокислот.
Патология
Гипофункция
Инсулинзависимый и инсулиннезависимый сахарный диабет. Для диагностики этих патологий в клинике активно используют нагрузочные пробы и определение концентрации инсулина и С-пептида.
Источник
Для нормального функционирования человеческому организму постоянно нужна глюкоза. Это и есть та жизненная сила, которая обеспечивает клетки энергией. На нужном уровне глюкозу держит гормон поджелудочной железы — инсулин. Только он помогает клеткам впитывать ее для своих энергетических нужд из крови. Инсулин вырабатывается в поджелудочной железе 24 часа в сутки, но наибольшее количество гормона поступает в кровь после еды. Нарушения работы поджелудочной по продуцированию инсулина приводят к диабету.
Гормональная функция поджелудочной железы
Поджелудочная железа вырабатывает инсулин. Без него невозможен обмен веществ в организме. За синтез гормона отвечают бета-клетки. В них содержатся:
- митохондрии — своеобразные энергетические станции;
- рибосомы, где, собственно, и происходит начальное формирование белка инсулина из аминокислот.
Далее «заготовка» поступает в сеть каналов аппарата Гольджи. Там завершается сборка молекул. По такой общей схеме бета-клетки вырабатывают инсулин.
Гормон, который вырабатывает поджелудочная железа, выделяется в кровоток в ответ на повышение уровня глюкозы. Глюкоза, не усвоенная сразу, связывается в молекулы гликогена в мышцах, печени и подкожной жировой клетчатке. Организм расходует эти запасы, если с момента последнего приема пищи прошло много времени, или после активной физической нагрузки.
Гликоген снова расщепляется на молекулы глюкозы, и в клетки поступает необходимая для жизнедеятельности энергия. Когда запасы мышц и печени истощены, организм приступает к использованию жира, который расщепляется на глицерин и жирные кислоты. И наоборот, если энергетические депо мышц и печени заполнены до отказа (при переизбытке простых углеводов), стартует преобразование глюкозы в жир.
Гликоген синтезируется почти во всех тканях организма, но наибольшие его запасы хранятся именно в печени и мышцах. После активной спортивной тренировки или другой сопоставимой с ней нагрузки гликоген в мышечной ткани быстро расходуется. Его запасы восстанавливаются в периоды отдыха и после приема богатой углеводами пищи. Гликоген в печени начинает снова преобразовываться в глюкозу, если организм не получает пищу на протяжении длительного времени.
В обмене веществ участвует также глюкагон, который является антагонистом инсулина. Именно этот гормон дает сигнал клеткам печени из своих запасов поставлять глюкозу в кровь. Он синтезируется альфа-клетками островков Лангерганса, которые содержит поджелудочная железа.
Кроме инсулина, поджелудочная железа вырабатывает ферменты, которые необходимы для нормального пищеварения.
Как происходит регуляция уровня глюкозы
Бета-клетки реагируют на содержание глюкозы в крови. При повышении уровня глюкозы бета-клетки стимулируют выработку инсулина. К количеству глюкозы особенно чувствительны инсулинозависимые мышечная и жировая ткани. На них приходится порядка двух третей клеточной массы в человеческом теле.
Если инсулин — это гормон поджелудочной железы, выполняющий функцию снижения уровня глюкозы в крови, то все остальные гормоны выполняют противоположную функцию, увеличивая его.
Гормональное регулирование также осуществляют:
- глюкагон;
- адреналин;
- глюкокортикоиды;
- соматотропин.
Помимо важнейшей задачи по снижению уровня сахара, действие инсулина на организм следующее:
- Повышает проницаемость клеток для проникновения в них глюкозы.
- Способствует усвоению белков.
- Обеспечивает синтез жирных кислот в печени.
- Помогает регенерационным процессам.
- Помогает усвоению микроэлементов.
- Препятствует попаданию жирных кислот в кровоток.
Норма инсулина в крови
Этот важный для обменных процессов гормон поджелудочная железа продуцирует постоянно. Однако наибольшее его количество выделяется после каждого очередного приема пищи. Нормы инсулина в крови разнятся в зависимости от возраста и пола:
- дети — 3-20 мкЕд/мл;
- люди преклонного возраста — 6-30 мкЕд/мл;
- мужчины и женщины — 3-25 мкЕд/мл;
- беременные женщины — 6-26 мкЕд/мл.
Если поджелудочная железа выделяет недостаточно гормона, это свидетельствует о нарушении ее работы. При определении уровня гормона и сопоставлении его с предельными показатели в первую очередь нужно ориентироваться на референтные значения (точные данные), используемые в конкретной лаборатории, где проводится исследование.
Изменение выработки инсулина — причины, симптомы и последствия
Процесс выработки гормона нарушается при наличии тех или иных заболеваний поджелудочной железы. В частности, панкреатит приводит к изменению тканей органа. В результате воспаления клетки, отвечающие за выработку ферментов и гормонов, гибнут, и их замещает соединительная ткань.
Если вы заметили у себя симптомы изменения уровня инсулина в крови, обязательно посетите врача.
В результате возникает не только внешнесекреторная недостаточность (проблемы с выработкой пищевых ферментов). Поджелудочная железа и инсулин оказывается неспособна вырабатывать в нужном количестве.
Однако не у всех пациентов патология развивается именно в такой последовательности. Бывает так, что пациенты, которым уже поставили диагноз «диабет второго типа», начинают страдать панкреатитом.
Почему появляется избыточная секреция
Повышенную выработку могут провоцировать различные факторы:
- нерегулярное и несбалансированное питание, изобилующее простыми углеводами;
- повышенные физические и психические нагрузки;
- ожирение;
- дефицит витамина Е и хрома.
Уровень гормона может подняться из-за болезней поджелудочной железы (речь идет о нарушении эндокринной функции органа), печени и опухолей в брюшной полости, а также при наступлении беременности. Низкие показатели могут говорить как о банальном физическом истощении (сильной усталости), так и о начале диабета.
Почему поджелудочная железа не вырабатывает инсулин
За нехваткой инсулина стоит гибель синтезирующих его бета-клеток из-за атак собственной иммунной системы. При недостатке гормона поджелудочной железы инсулина клетки не имеют возможности впитывать глюкозу, а уровень сахара в крови продолжает оставаться гораздо выше допустимых норм.
Лечение нарушений
До настоящего времени медицина не имеет однозначного ответа на вопрос, как заставить поджелудочную железу вырабатывать инсулин. Исследования в данной области продолжаются, и одно из перспективных направлений — трансплантация бета-клеток. Широкого распространения процедура пока не получила из-за высокой стоимости и сложностей с получением донорского материала.
Свою версию по этому поводу предложили ученые из Калифорнийского университета в Сан-Франциско. Согласно результатам исследования, некоторые случаи диабета связаны с тем, что бета-клетки начинают испытывать дефицит кислорода и теряют способность вырабатывать инсулин.
На этом принципе может базироваться инновационный метод борьбы с диабетом. Однако достаточных для его использования результатов ученые пока не представили. Поэтому крайне важно строго следовать разработанной лечащим врачом индивидуальной схеме инсулиновой терапии.
Диабет
Если происходит сбой работы поджелудочной железы, однозначно нарушается нормальный процесс выработки инсулина. Стопроцентной защиты от диабета первого типа не существует, поскольку огромное значение в его развитии играет генетическая предрасположенность. А вот профилактике инсулинонезависимого диабета (второго типа) можно и нужно следовать. Развивается заболевание из-за переизбытка углеводов в пищевом рационе и гиподинамии, то есть малоподвижного образа жизни.
По каким причинам происходит дефицит инсулина при диабете
Дефицит инсулина возникает, если речь идет о диабете 1 типа. При втором типе заболевания гормона более, чем достаточно, но клетки слабо реагируют на него и в результате не получают глюкозу в достаточном количестве. Аутоиммунный диабет возникает из-за атак со стороны иммунной системы бета-клеток поджелудочной и связан с наследственным фактором.
Первый тип чаще всего возникает у молодых людей. Редко его диагностируют у пожилых, которые из-за лишнего веса, неправильного питания и сопутствующих заболеваний в основном страдают вторым типом болезни. У этой группы пациентов дефицит инсулина может возникнуть, если заболевание из-за длительного некорректного лечения перейдет в первую форму.
Инсулиновая терапия
Инсулинозависимый диабет предполагает использование индивидуальной схемы приема инсулина, которую расписывает врач-эндокринолог. Когда и сколько инсулина колоть, определяют на основании результатов исследования, проведенного пациентом самостоятельно. Как минимум на протяжении недели он должен фиксировать, как изменяется уровень сахара в крови. Важнейшие показатели — уровни глюкозы перед сном и утром после пробуждения.
Ознакомившись с результатами исследования и сопутствующих обстоятельств (особенности питания пациента, образ жизни и физическая активность), лечащий врач примет решение, потребуется ли использовать продленный инсулин для поддержания уровня глюкозы натощак и следует ли колоть быстрый инсулин перед приемом пищи. Подобранная врачом схема инсулинотерапии дополняется корректно сбалансированной диетой.
Как избежать сахарного диабета при болезнях поджелудочной
При хронических заболеваниях поджелудочной железы высок риск развития сахарного диабета, но он все же не составляет 100%. При адекватном и своевременном лечении основного заболевания осложнений в виде диабета вполне можно избежать. Часто проблема заключается в игнорировании симптомов.
О неблагополучии поджелудочная железа сигнализирует регулярно возникающими болями. Если другие симптомы отсутствуют, боли купируют и считают, что проблема решена. А работа органа уже нарушена, и процесс может медленно прогрессировать. Спустя несколько лет к болевому синдрому добавляются другие неприятные симптомы. Мучает изжога, периодически возникает вздутие живота.
Если патологический процесс зашел слишком далеко, пациент теряет аппетит, его может часто беспокоить диарея. Симптомы являются следствием инсулиновых выбросов бета-клеток. При любых подобных симптомах крайне важно обратиться к врачу и после обследования пройти курс лечения. Только так можно предупредить развитие диабета второго типа.
При игнорировании симптомов клетки поджелудочной железы продолжают гибнуть. При дефиците инсулина уровень глюкозы в крови держится выше нормы. Развивается диабет, поджелудочная продолжает разрушаться. При одновременном лечении панкреатита и сахарного диабета стоят два важные задачи: восстановить углеводный обмен и наладить выработку пищеварительных ферментов.
Источник
Строение
Инсулин представляет собой белок, состоящий из двух пептидных цепей А (21 аминокислота) и В (30 аминокислот), связанных между собой дисульфидными мостиками. Всего в зрелом инсулине человека присутствует 51 аминокислота и его молекулярная масса равна 5,7 кДа.
Синтез
Инсулин синтезируется в β-клетках поджелудочной железы в виде препроинсулина, на N-конце которого находится концевая сигнальная последовательность из 23 аминокислот, служащая проводником всей молекулы в полость эндоплазматической сети. Здесь концевая последовательность сразу отщепляется и проинсулин транспортируется в аппарат Гольджи.
На данном этапе в молекуле проинсулина присутствуют А-цепь, В-цепь и С-пептид (англ. connecting – связующий). В аппарате Гольджи проинсулин упаковывается в секреторные гранулы вместе с ферментами, необходимыми для «созревания» гормона . По мере перемещения гранул к плазматической мембране образуются дисульфидные мостики, вырезается связующий С-пептид (31 аминокислота) и формируется готовая молекула инсулина. В готовых гранулах инсулин находится в кристаллическом состоянии в виде гексамера, образуемого с участием двух ионов Zn2+.
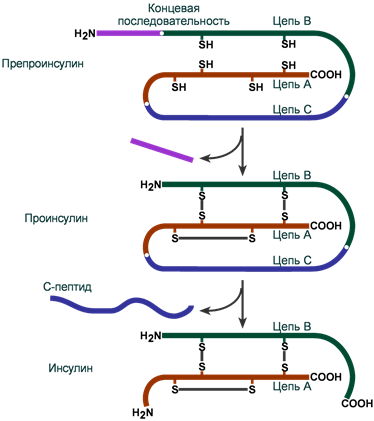
Схема синтеза инсулина
Около 15% молекул проинсулина поступает в кровоток. Проинсулин обладает более слабой активностью (около 1:10), но большим периодом полувыведения (около 3:1), по сравнению с инсулином. Поэтому повышение его уровня может вызывать гипогликемические состояния, что наблюдается при инсулиномах.
Регуляция синтеза и секреции
Секреция инсулина происходит постоянно, и около 50% инсулина, высвобождаемого из β-клеток, никак не связано с приемом пищи или иными влияниями. В течение суток поджелудочная железа выделяет примерно 1/5 от запасов имеющегося в ней инсулина.
Главным стимулятором секреции инсулина является повышение концентрации глюкозы в крови выше 5,5 ммоль/л, максимума секреция достигает при 17-28 ммоль/л. Особенностью этой стимуляции является двухфазное усиление секреции инсулина:
- первая фаза длится 5-10 минут и концентрация гормона может 10-кратно возрастать, после чего его количество понижается,
- вторая фаза начинается примерно через 15 минут от начала гипергликемии и продолжается на протяжении всего ее периода, приводя к увеличению уровня гормона в 15-25 раз.
Чем дольше в крови сохраняется высокая концентрация глюкозы, тем большее число β-клеток подключается к секреции инсулина.
Индукция синтеза инсулина происходит от момента проникновения глюкозы в клетку до трансляции инсулиновой мРНК. Она регулируется повышением транскрипции гена инсулина, повышением стабильности инсулиновой мРНК и увеличением трансляции инсулиновой мРНК.
Активация секреции инсулина
1. После проникновения глюкозы в β-клетки (через ГлюТ-1 и ГлюТ-2) она фосфорилируется гексокиназой IV (глюкокиназа, обладает низким сродством к глюкозе),
2. Далее глюкоза аэробно окисляется, при этом скорость окисления глюкозы линейно зависит от ее количества,
3. В результате нарабатывается АТФ, количество которого также прямо зависит от концентрации глюкозы в крови,
4. Накопление АТФ стимулирует закрытие ионных K+-каналов, что приводит к деполяризации мембраны,
5. Деполяризация мембраны приводит к открытию потенциал-зависимых Ca2+-каналов и притоку ионов Ca2+ в клетку,
6. Поступающие ионы Ca2+ активируют фосфолипазу C и запускают кальций-фосфолипидный механизм проведения сигнала с образованием ДАГ и инозитол-трифосфата (ИФ3),
7. Появление ИФ3 в цитозоле открывает Ca2+-каналы в эндоплазматической сети, что ускоряет накопление ионов Ca2+ в цитозоле,
8. Резкое увеличение концентрации в клетке ионов Ca2+ приводит к перемещению секреторных гранул к плазматической мембране, их слиянию с ней и экзоцитозу кристаллов зрелого инсулина наружу,
9. Далее происходит распад кристаллов, отделение ионов Zn2+ и выход молекул активного инсулина в кровоток.
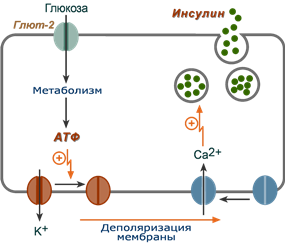
Схема внутриклеточной регуляции синтеза инсулина при участии глюкозы
Описанный ведущий механизм может корректироваться в ту или иную сторону под действием ряда других факторов, таких как аминокислоты, жирные кислоты, гормоны ЖКТ и другие гормоны, нервная регуляция.
Из аминокислот на секрецию гормона наиболее значительно влияют лизин и аргинин. Но сами по себе они почти не стимулируют секрецию, их эффект зависит от наличия гипергликемии, т.е. аминокислоты только потенциируют действие глюкозы.
Свободные жирные кислоты также являются факторами, стимулирующими секрецию инсулина, но тоже только в присутствии глюкозы. При гипогликемии они оказывают обратный эффект, подавляя экспрессию гена инсулина.
Логичной является положительная чувствительность секреции инсулина к действию гормонов желудочно-кишечного тракта – инкретинов (энтероглюкагона и глюкозозависимого инсулинотропного полипептида), холецистокинина, секретина, гастрина, желудочного ингибирующего полипептида.
Клинически важным и в какой-то мере опасным является усиление секреции инсулина при длительном воздействии соматотропного гормона, АКТГ и глюкокортикоидов, эстрогенов, прогестинов. При этом возрастает риск истощения β-клеток, уменьшение синтеза инсулина и возникновение инсулинзависимого сахарного диабета. Такое может наблюдаться при использовании указанных гормонов в терапии или при патологиях, связанных с их гиперфункцией.
Нервная регуляция β-клеток поджелудочной железы включает адренергическую и холинергическую регуляцию. Любые стрессы (эмоциональные и/или физические нагрузки, гипоксия, переохлаждение, травмы, ожоги) повышают активность симпатической нервной системы и подавляют секрецию инсулина за счет активации α2-адренорецепторов. С другой стороны, стимуляция β2-адренорецепторов приводит к усилению секреции.
Также выделение инсулина повышается n.vagus, в свою очередь находящегося под контролем гипоталамуса, чувствительного к концентрации глюкозы крови.
Мишени
Рецепторы инсулина находятся практически на всех клетках организма, кроме нервных, но в разном количестве. Нервные клетки не имеют рецепторов к инсулину, т.к. последний просто не проникает через гематоэнцефалический барьер.
Наибольшая концентрация рецепторов наблюдается на мембране гепатоцитов (100-200 тыс на клетку) и адипоцитов (около 50 тыс на клетку), клетка скелетной мышцы имеет около 10 тысяч рецепторов, а эритроциты — только 40 рецепторов на клетку.
Механизм действия
После связывания инсулина с рецептором активируется ферментативный домен рецептора. Так как он обладает тирозинкиназной активностью, то фосфорилирует внутриклеточные белки — субстраты инсулинового рецептора. Дальнейшее развитие событий обусловлено двумя направлениями: MAP-киназный путь и ФИ-3-киназный механизмы действия (подробно).
При активации фосфатидилинозитол-3-киназного механизма результатом являются быстрые эффекты – активация ГлюТ-4 и поступление глюкозы в клетку, изменение активности «метаболических» ферментов – ТАГ-липазы, гликогенсинтазы, гликогенфосфорилазы, киназы гликогенфосфорилазы, ацетил-SКоА-карбоксилазы и других.
При реализации MAP-киназного механизма (англ. MAP — mitogen-activated protein) регулируются медленные эффекты – пролиферация и дифференцировка клеток, процессы апоптоза и антиапоптоза.
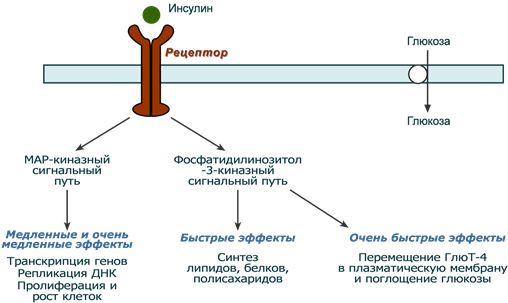
Два механизма действия инсулина
Скорость эффектов действия инсулина
Биологические эффекты инсулина подразделяются по скорости развития:
Очень быстрые эффекты (секунды)
Эти эффекты связаны с изменением трансмембранных транспортов:
1. Активации Na+/K+-АТФазы, что вызывает выход ионов Na+ и вход в клетку ионов K+, что ведет к гиперполяризации мембран чувствительных к инсулину клеток (кроме гепатоцитов).
2. Активация Na+/H+-обменника на цитоплазматической мембране многих клеток и выход из клетки ионов H+ в обмен на ионы Na+. Такое влияние имеет значение в патогенезе артериальной гипертензии при сахарном диабете 2 типа.
3. Угнетение мембранной Ca2+-АТФазы приводит к задержке ионов Ca2+ в цитозоле клетки.
4. Выход на мембрану миоцитов и адипоцитов переносчиков глюкозы ГлюТ-4 и увеличение в 20-50 раз объема транспорта глюкозы в клетку.
Быстрые эффекты (минуты)
Быстрые эффекты заключаются в изменении скоростей фосфорилирования и дефосфорилирования метаболических ферментов и регуляторных белков.
Печень
- торможение эффектов адреналина и глюкагона (фосфодиэстераза),
- ускорение гликогеногенеза (гликогенсинтаза),
- активация гликолиза (фосфофруктокиназа, пируваткиназа),
- превращение пирувата в ацетил-SКоА (ПВК-дегидрогеназа),
- усиление синтеза жирных кислот (ацетил-SКоА-карбоксилаза),
- формирование ЛПОНП,
- повышение синтеза холестерина (ГМГ-SКоА-редуктаза),
Мышцы
- торможение эффектов адреналина (фосфодиэстераза),
- стимулирует транспорт глюкозы в клетки (активация ГлюТ-4),
- стимуляция гликогеногенеза (гликогенсинтаза),
- активация гликолиза (фосфофруктокиназа, пируваткиназа),
- превращение пирувата в ацетил-SКоА (ПВК-дегидрогеназа),
- усиливает транспорт нейтральных аминокислот в мышцы,
- стимулирует трансляцию (рибосомальный синтез белков).
Жировая ткань
- стимулирует транспорт глюкозы в клетки (активация Глют-4),
- активирует запасание жирных кислот в тканях (липопротеинлипаза),
- активация гликолиза (фосфофруктокиназа, пируваткиназа),
- усиление синтеза жирных кислот (активация ацетил-SКоА-карбоксилазы),
- создание возможности для запасания ТАГ (инактивация гормон-чувствительной-липазы).
Медленные эффекты (минуты-часы)
Медленные эффекты заключаются в изменении скорости транскрипции генов белков, отвечающих за обмен веществ, за рост и деление клеток, например:
1. Индукция синтеза ферментов в печени
- глюкокиназы и пируваткиназы (гликолиз),
- АТФ-цитрат-лиазы, ацетил-SКоА-карбоксилазы, синтазы жирных кислот, цитозольной малатдегидрогеназы (синтез жирных кислот),
- глюкозо-6-фосфатдегидрогеназы (пентозофосфатный путь),
2. Индукция в адипоцитах синтеза глицеральдегидфосфат-дегидрогеназы и синтазы жирных кислот.
3. Репрессия синтеза мРНК, например, для ФЕП-карбоксикиназы (глюконеогенез).
4. Обеспечивает процессы трансляции, повышая фосфорилирование по серину рибосомального белка S6.
Очень медленные эффекты (часы-сутки)
Очень медленные эффекты реализуют митогенез и размножение клеток. Например, к этим эффектам относится
1. Повышение в печени синтеза соматомедина, зависимого от гормона роста.
2. Увеличение роста и пролиферации клеток в синергизме с соматомединами.
3. Переход клетки из G1-фазы в S-фазу клеточного цикла.
Именно группой медленных эффектов объясняется «парадокс» наличия инсулинорезистентности адипоцитов (при сахарном диабете 2 типа) и одновременное увеличение массы жировой ткани и запасание в ней липидов под влиянием гипергликемии и инсулина.
Инактивация инсулина
Удаление инсулина из циркуляции происходит после его связывания с рецептором и последующей интернализации (эндоцитоза) гормон-рецепторного комплекса, в основном в печени и мышцах. После поглощения комплекс разрушается и белковые молекулы лизируются до свободных аминокислот. В печени захватывается и разрушается до 50% инсулина при первом прохождении крови, оттекающей от поджелудочной железы. В почках инсулин фильтруется в первичную мочу и, после реабсорбции в проксимальных канальцах, разрушается.
Патология
Гипофункция
Инсулинзависимый и инсулиннезависимый сахарный диабет. Для диагностики этих патологий в клинике активно используют нагрузочные пробы и определение концентрации инсулина и С-пептида.
Источник

