Секвестрэктомия поджелудочной железы это
Секвестры
образуются в результате тромбоза
артериального или венозного стволов.
Они могут быть различными по протяженности
— от небольших участков до тотального
поражения практически всей железы.
Секвестрированию подвергается также
парапанкреатическая клетчатка.
В
зависимости от сроков выполнения
секвестрэктомии могут быть ранними —
через месяц и более от начала заболевания
и поздними — до года с момента заболевания.
При ранних секвестрэктомиях капсулы
практически не бывает. Секвестры,
как правило, инфицированы. При поздних
секвестрэктомиях всегда имеется плотная
фиброзная капсула, в полости которой
свободно лежат секвестры поджелудочной
железы.
Показания
к операции: гнойная
интоксикация, гипертермия, отсутствие
эффекта от антибиотикотерапии. Диагностика
облегчается применением УЗИ и КТ.
Доступ:
верхнесрединная
лапаротомия, но возможны (в зависимости
от локализации) поперечный, левый косой
разрезы.
Техника
операции. По
вскрытии брюшной полости и сальниковой
сумки в области поджелудочной железы
обнаруживают при ранних операциях
участки некротизированной ткани, которые
легко отделяются от окружающих воспаленных
тканей тупым путем — пальцем или
тупфе-ром. Кровотечения, как правило,
не бывает. Только при попытке удалить
секвестры, интимно связанные с селезеночной
веной или артерией, может возникнуть
сильное кровотечение.
При
операциях в поздние сроки по вскрытии
сальниковой сумки обнаруживают
плотную фиброзную капсулу. После
рассечения передней стенки капсулы
извлекают свободно лежащие секвестры,
различные по размерам. Полость
секвестральной коробки не содержит
гноя, тогда как при ранних секвестрэктомиях
отмечается также гнойная инфильтрация
окружающих тканей.
Полость
секвестральной коробки должна быть
тщательно промыта раствором антисептиков
и дренирована. Следует дренировать все
карма- i
ны и отделы секвестральной полости при
помощи термопластической трубки или
дренажно-поролоновой системы. В первые
сутки необходима активная аспирация,
а в последующие — диализ. Дренажи
предпочтительнее выводить в поясничных
областях.
При
поздних секвестрэктомиях прогноз более
благоприятный, чел при ранних, когда
гнойный процесс не имеет отграничений.
При
всех типах операций в случае гнойных
процессов возможны следующие
осложнения: кровотечения из сосудов
забрюшинной клетчатки, формирование
панкреатического свища, перфорация
полого органа.
Результаты.
Вскрытие
и дренирование хорошо отграниченной
гнойной псевдокисты дает хорошие
результаты. Так, по данным В.Л. Гагуши-на
(1988), из 28 оперированных по данному поводу
больных умер только один. Некрэктомия
и секвестрэктомия дают послеоперационную
летальность в пределах 30%. По данным
А.В. Пугаева (2000), летальность составила
14,8%.
Прогноз
определяется
размером некротизированяых участков.
При единичных участках некроза и хорошем
их отграничении (секвестраль-ная капсула)
прогноз благоприятный. Неограниченные
гнойники, требующие повторных
вмешательств, в прогностическом плане
неблагоприятны.
По
данным литературы, секвестрэктомии
выполняются 44% больных, оперируемых по
поводу различных гнойных осложнений
панкреонекроза.
Источник
Показания, этапы и техника некрэктомии поджелудочной железы при панкреатите
а) Показания для некрэктомии поджелудочной железы. Абсолютные показания: наличие инфицированного некроза или ухудшение клинического состояния (органная недостаточность) несмотря на максимальную консервативную терапию панкреонекроза.
б) Предоперационная подготовка:
— Предоперационные исследования: компьютерная томография, ультразвуковое исследование, возможна чрескожная пункция (микробиологическое исследование).
— Подготовка пациента: назогастральный зонд, интенсивное замещение объема жидкости.
в) Специфические риски, информированное согласие пациента:
— Эрозия сосуда и смежных органов (желудок, тонкая и толстая кишка) с кровотечением или формированием свища (более 50% случаев)
— Необходимость холецистэктомии/Т-образного дренажа или спленэктомии (более 30% случаев)
— Многократные лапаротомии/лапаростома
г) Обезболивание. Общее обезболивание (интубация).
д) Положение пациента. Лежа на спине.
е) Оперативный доступ при некрэктомии поджелудочной железы. Верхняя поперечная лапаротомия.
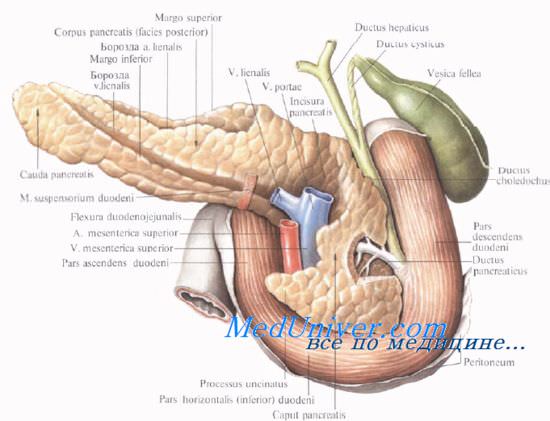
Анатомия и топография поджелудочной железы
ж) Этапы некрэктомии поджелудочной железы:
— Разрез кожи
— Вскрытие сальниковой сумки
— Идентификация некротических изменений
— Некрэктомия
— Лаваж сальниковой сумки
— Закрытие сальниковой сумки
з) Анатомические особенности, серьезные риски, оперативные приемы:
— Избегайте формальной резекции поджелудочной железы в острой ситуации.
— Тщательно обследуйте все некротизированные области и выполните консервативную тупую хирургическую обработку.
— При значительных некротических изменениях за пределами сальниковой сумки сочетайте лаваж сумки с плановыми ревизиями (временное закрытие брюшной полости рассасывающейся сеткой, покрытой адгезивной пленкой).
Предупреждение: не пропустите образование пролежней органов вследствие длительного стояния дренажей, особенно пролежней толстой кишки (используйте мягкие дренажи, например из силикона).
и) Мэры при специфических осложнениях:
— Для тампонирования диффузного кровотечения из области некрэктомии могут потребоваться брюшные салфетки, они должны быть оставлены на 24-48 часов.
— Кишечный свищ следует лечить хирургически. Если панкреатический свищ хорошо дренируется, придерживайтесь выжидательной тактики; выполняйте ревизию только после полного восстановления пациента. Высока вероятность самопроизвольного закрытия.
к) Послеоперационный уход после некрэктомии поджелудочной железы:
— Медицинский уход: удаляйте промывной катетер только после возвращения лабораторных данных к норме и при чистом отделяемом по дренажу. Прекращайте плановые ревизии, когда воспалительный некротический процесс в брюшной полости стихает, и клиническая ситуация стабилизируется.
После прекращения поступления отделяемого по дренажам они могут быть удалены; при повторном формировании ограниченных скоплений жидкости или абсцессов применяйте чрескожное дренирование.
— Возобновление питания: питание возобновляется при значительной нормализации лабораторных показателей и функции кишечника.
— Функция кишечника: назначьте поддерживающее лечение и, возможно, легкие пероральные слабительные средства. — Активизация: как только позволит общая ситуация. — Физиотерапия: дыхательные упражнения и общая физиотерапия.
— Период нетрудоспособности: возможно несколько месяцев.
л) Этапы и техника некрэктомии поджелудочной железы:
1. Разрез кожи
2. Вскрытие сальниковой сумки
3. Идентификация некротических изменений
4. Некрэктомия
5. Лаваж сальниковой сумки
6. Закрытие сальниковой сумки
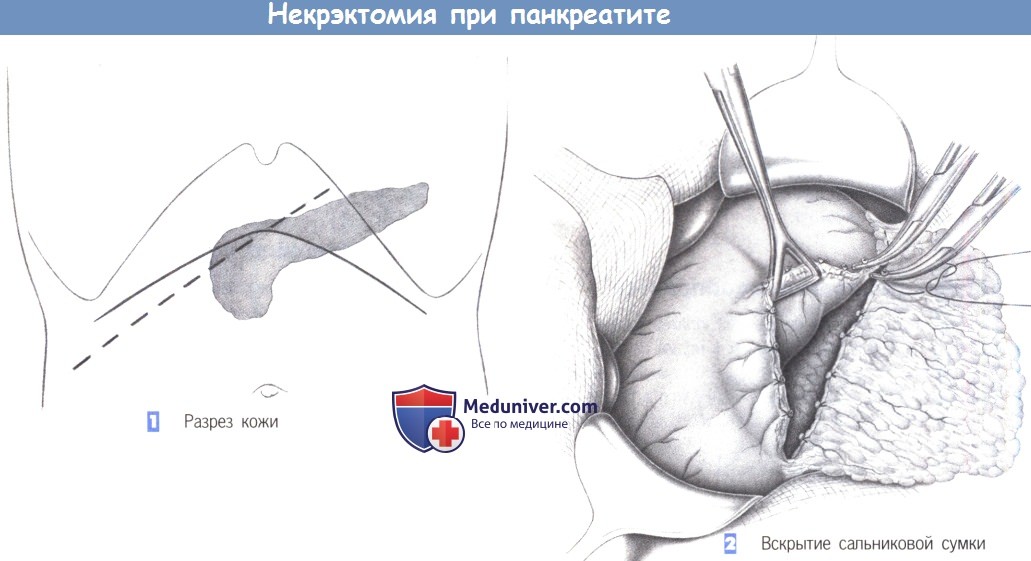
1. Разрез кожи. Доступ к поджелудочной железе может быть получен через правый подреберный разрез или даже верхнюю поперечную лапаротомию. Из-за лучшей доступности верхняя поперечная лапаротомия особенно рекомендуется при патологических процессах, локализованных в теле и хвосте поджелудочной железы.
2. Вскрытие сальниковой сумки. Выделение поджелудочной железы начинается с вскрытия сальниковой сумки. С этой целью желудочно-ободочная связка последовательно рассекается между зажимами Оверхольта вдоль большой кривизны желудка. Захват большой кривизны зажимами Дюваля позволяет сместить желудок в краниовентральном направлении, таким образом, обнажая поджелудочную железу в глубине брюшной полости.
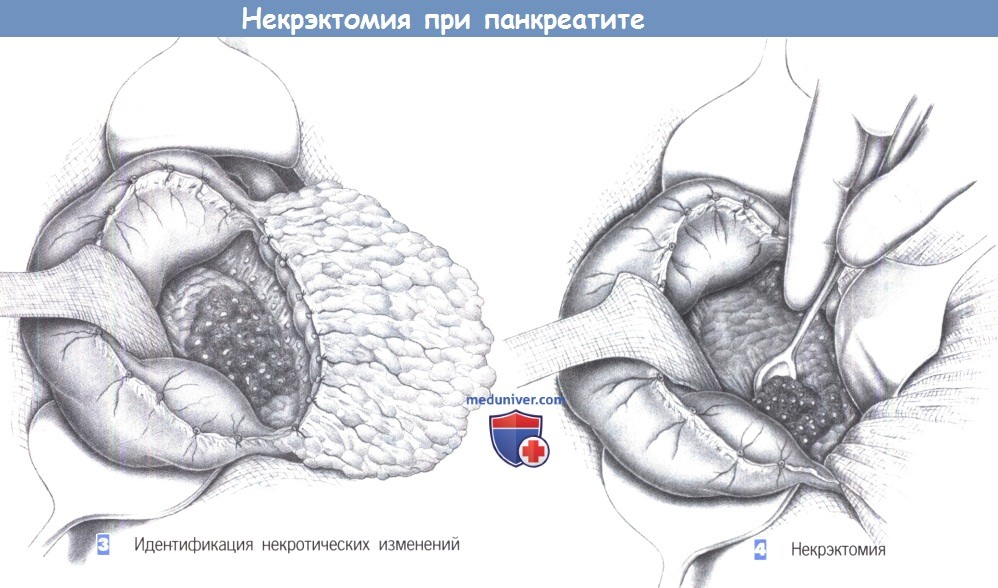
3. Идентификация некротических изменений. После полного обнажения большой кривизны желудка путем рассечения желудочно-ободочной связки, за желудок можно завести крючки для экспозиции всей передней поверхности поджелудочной железы. Некротизированные ткани имеют черноватый или сероватый цвет и сочетаются с зонами геморрагического пропитывания. Макроскопически не всегда можно отличить некроз поджелудочной железы от некроза перипанкреатических тканей.
4. Некрэктомия. Некротизированные ткани удаляются пальцами, ложкой Фолькмана или поверхностным иссечением. Диссекция продолжается до тех пор, пока капиллярное кровотечение из поджелудочной железы не укажет границу с жизнеспособной тканью. Нельзя удалять хорошо кровоснабжаемую ткань поджелудочной железы, так как позже это приведет к нарушению ее функции, а также увеличит риск рецидива кровотечения.
Особое внимание должно быть обращено на селезеночную вену и верхнюю брыжеечную вену, которые не должны быть повреждены в ходе некрэктомии.
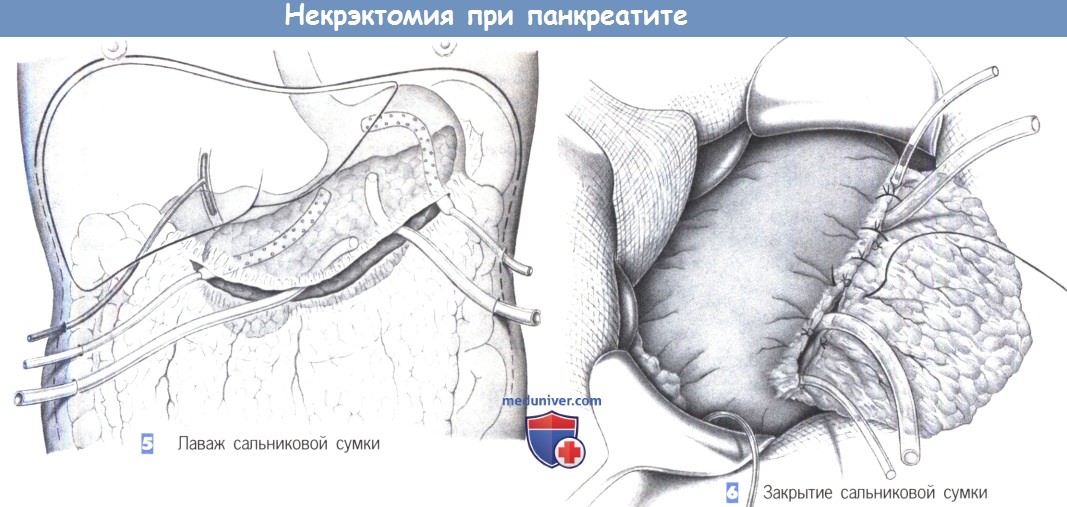
5. Лаваж сальниковой сумки. Полное удаление всего некротического материала из сальниковой сумки должно сопровождаться проточным лаважем. С этой целью сальниковая сумка непрерывно орошается 20 л изотонического раствора в течение 24 часов через два приводящих и два отводящих дренажа. Это приводит к вымыванию некротизированных тканей, эндотоксинов и цитотоксических веществ.
Для дренирования желчного дерева в общий желчный проток должен быть введен Т-образный дренаж. Дренаж Джексона-Пратта или его модификации оказались эффективными в качестве приводящих дренажей, тогда как в качестве отводящих дренажей в самую нижнюю точку сальниковой сумки вводятся трубки с широким просветом (по крайней мере, 10 мм).
6. Закрытие сальниковой сумки. Закрытая ирригационная система создается путем восстановления сальниковой сумки отдельными швами. С этой целью желудочно-ободочная связка герметично восстанавливается над дренажами. В послеоперационном периоде промывание продолжается до тех пор, пока прозрачное, негеморрагическое отделяемое по дренажам не укажет на прекращение некротического процесса.
— Также рекомендуем «Показания, этапы и техника наложения анастамоза псевдокисты поджелудочной железы с тонкой кишкой»
Оглавление темы «Этапы и техника операций в абдоминальной хирургии»:
- Показания, этапы и техника гепатикоеюностомии
- Показания, этапы и техника клиновидной резекции печени
- Показания, этапы и техника операции при кисте печени
- Показания, этапы и техника левосторонней лобэктомии печени
- Показания, этапы и техника операции при разрыве печени
- Показания, этапы и техника катетеризации печеночной артерии
- Показания, этапы и техника некрэктомии поджелудочной железы при панкреатите
- Показания, этапы и техника наложения анастамоза псевдокисты поджелудочной железы с тонкой кишкой
- Показания, этапы и техника резекции хвоста поджелудочной железы
- Показания, этапы и техника удаления селезенки (спленэктомии)
Источник


отметить
статью
Шабунин А. В., Лукин А. Ю., Шиков Д. В., Колотильщиков А. А.
Шабунин Алексей Васильевич — доктор мед. наук, профессор, член-корр. РАН, заведующий кафедрой хирургии ФГБОУ ДПО РМАНПО, главный врач ГБУЗ ГКБ им. С.П. Боткина, главный хирург Департамента здравоохранения города Москвы, ФГБОУ ДПО “Российская медицинская академия непрерывного профессионального образования” Министерства здравоохранения Российской Федерации; ГБУЗ “Городская клиническая больница имени С.П. Боткина” Департамента здравоохранения города Москвы, 125933, Москва, ул. Баррикадная, д. 2/1, стр. 1, Российская Федерация
Лукин Андрей Юрьевич — канд. мед. наук, доцент кафедры хирургии ФГБОУ ДПО РМАНПО, заместитель главного врача ГБУЗ ГКБ им. С.П. Боткина по амбулаторно-поликлинической помощи, ФГБОУ ДПО “Российская медицинская академия непрерывного профессионального образования” Министерства здравоохранения Российской Федерации; ГБУЗ “Городская клиническая больница имени С.П. Боткина” Департамента здравоохранения города Москвы, 125933, Москва, ул. Баррикадная, д. 2/1, стр. 1, Российская Федерация
Шиков Дмитрий Владимирович — канд. мед. наук, заведующий операционным блоком экстренной хирургии ГБУЗ ГКБ им. С.П. Боткина, ГБУЗ “Городская клиническая больница имени С.П. Боткина” Департамента здравоохранения города Москвы, 125284, Москва, 2-й Боткинский пр-д, д. 5, Российская Федерация
Колотильщиков Андрей Александрович — аспирант кафедры хирургии ФГБОУ ДПО РМАНПО, врач-хирург ГБУЗ ГКБ им. С.П. Боткина, ФГБОУ ДПО “Российская медицинская академия непрерывного профессионального образования” Министерства здравоохранения Российской Федерации; ГБУЗ “Городская клиническая больница имени С.П. Боткина” Департамента здравоохранения города Москвы, kolotun2110@inbox.ru, 121354, Москва, ул. Гришина, д. 2, корп. 1, кв. 222, Российская Федерация
Цель. Уточнение показаний к применению видеоассистированной ретроперитонеоскопической секвестрэктомии в позднюю фазу развития панкреонекроза. Материал и методы. В период с 2012 по 2018 г. у 1468 пациентов диагностирован острый панкреатит, у 364 (24,8%) панкреатит был деструктивным. У 246 больных выявлен инфицированный панкреонекроз, послуживший показанием к хирургическому лечению. В 20 (8,1%) наблюдениях применена видеоассистированная ретроперитонеоскопическая секвестрэктомия. Результаты. В 6 наблюдениях при видеоассистированной ретроперитонеоскопической секвестрэктомии не было необходимости в открытом способе секвестрэктомии. Потребовалось от 2 до 6 повторных видеоассистированных санаций забрюшинной клетчатки. У 4 пациентов был диагностирован инфильтрат по “левому” типу, у 2 — инфильтрат по “правому” типу. В 14 наблюдениях видеоассистированную ретроперитонеоскопическую секвестрэктомию дополнили открытой секвестрэктомией, что было обусловлено распространенностью патологического процесса в поджелудочной железе и парапанкреатической клетчатке. Отмечено развитие двух послеоперационных осложнений (аррозивное кровотечение) и один летальный исход. Заключение. Видеоассистированная ретроперитонеоскопическая секвестрэктомия является перспективным миниинвазивным способом секвестрэктомии. Применение метода в комбинации с чрескожным дренированием наиболее эффективно у пациентов при наличии инфильтрата по “левому” и “правому” типу. При наличии изменений в поджелудочной железе и забрюшинной клетчатке, характерных для инфильтрата по “смешанному” типу, целесообразно сочетать видеоассистированную ретроперитонеоскопическую секвестрэктомию с открытым способом.
Ключевые слова:
поджелудочная железа, деструктивный панкреатит, инфицированный панкреонекроз, моделирование панкреонекроза, секвестрэктомия, видеоассистированная ретроперитонеоскопическая секвестрэктомия, чрескожное дренирование, pancreas, destructive pancreatitis, infectedpancreatic necrosis, pancreatic necrosis modeling, sequestrectomy, video-assisted retroperitoneal debridement, percutaneous drainage
Литература:
1.Yadav D., Lowenfels A.B. The epidemiology of pancreatitis and pancreatic cancer. Gastroenterology. 2013; 144 (6): 1252-1261. DOI: 10.1053/j.gastro.2013.01.068.
2.Isaji S., Takada T., Mayumi T., Yoshida M., Wada K., Yokoe M., Gabata T. Revised Japanese guidelines for the management of acute pancreatitis 2015: Revised concepts and updated points. J. Hepatobiliary Pancreat. Sci. 2015; 22 (6): 433-445. DOI: 10.1002/jhbp.260.
3.Working Group IAPAPAAPG. IAP/APA evidence-based guidelines for the management of acute pancreatitis. Pancreatology. 2013; 13 (4, Suppl 2): e1-15. DOI: 10.1016/j.pan.2013.07.063.
4.Van Santvoort H.C., Bakker O.J., Bollen T.L., Besselink M.G., Ahmed Ali U., Schrijver A.M., Gooszen H.G. A conservative and minimally invasive approach to necrotizing pancreatitis improves outcome. Gastroenterology. 2011; 141 (4): 1254-1263. DOI: 10.1053/j.gastro.2011.06.073.
5.Werge M., Novovic S., Schmidt P.N., Gluud L.L. Infection increases mortality in necrotizing pancreatitis: A systematic review and meta-analysis. Pancreatology. 2016; 16 (5): 698-707. DOI: 10.1016/j.pan.2016.07.004.
6.Banks P.A., Bollen T.L., Dervenis C., Gooszen H.G., Johnson C.D., Sarr M.G., Zyromski N.J. Classification of acute pancreatitis — 2012: Revision of the Atlanta classification and definitions by international consensus. Gut. 2013; 62 (1): 102-111. DOI: 10.1136/gutjnl-2012-302779.
7.Шабунин А.В., Араблинский А.В., Лукин А.Ю. Панкреонекроз. Диагностика и лечение. М.: ГЭОТАР-Медиа, 2014. 89 с.
8.Baron T.H., Kozarek R.A. Endotherapy for organized pancreatic necrosis: perspectives after 20 years. Clin. Gastroenterol. Hepatol. 2012; 10 (11): 1202-1207. DOI: 10.1016/j.cgh.2012.07.009.
9.van Brunschot S., Besselink M.G., Bakker O.J., Boermeester M.A., Gooszen H.G., Horvath K.D., van Santvoort H.C. Video-assisted retroperitoneal debridement (VARD) of infected necrotizing pancreatitis: an update. Curr. Surg. Reports. 2013; 1 (2): 121-130. DOI: 10.1007/s40137-013-0015-0.
10.Loveday B.P.T., Petrov M.S., Connor S., Rossaak J.I., Mittal A., Phillips A.R.J., Windsor J.A. A comprehensive classification of invasive procedures for treating the local complications of acute pancreatitis based on visualization, route, and purpose. Pancreatology. 2011; 11 (4): 406-413. DOI: 10.1159/000328191.
11.Kokosis G., Perez A., Pappas T.N. Surgical management of necrotizing pancreatitis: An overview. World J. Gastroenterol. 2014; 20 (43): 16106-16112. DOI: 10.3748/wjg.v20.i43.16106.
12.van Santvoort H.C., Besselink M.G., Bakker O.J., Hofker H.S., Boermeester M.A., Dejong C.H., Gooszen H.G. A step-up approach or open necrosectomy for necrotizing pancreatitis. N. Engl. J. Med. 2010; 362 (16): 1491-1502. DOI: 10.1056/NEJMoa0908821.
13.Aranda-Narváez J.M. Acute necrotizing pancreatitis: Surgical indications and technical procedures. World J. Clin.Cases. 2014; 2 (12): 840. DOI: 10.12998/wjcc.v2.i12.840.
14.Harrison S., Kakade M., Varadarajula S., Parden J., Morgan D., Christein J. Characteristics and outcomes of patients undergoing debridement of pancreatic necrosis. J. Gastrointest. Surg. 2010; 14 (2): 245-251. DOI: 10.1007/s11605-009-1100-7.
15.Freeman M.L., Werner J., Van Santvoort H.C., Baron T.H., Besselink M.G., Windsor J.A., Vege S.S. Interventions for necrotizing pancreatitis: Summary of a multidisciplinary consensus conference. Pancreas. 2012; 41 (8): 1176-1194. DOI: 10.1097/MPA.0b013e318269c660.
An experience of video-assisted retroperitoneal debridement
Shabunin A. V., Lukin A. Y., Shikov D. V., Kolotilshchikov A. A.
Aim. To clarify the indications for video-assisted retroperitoneal debridement at the late stage of pancreatic necrosis. Material and methods. Acute pancreatitis was diagnosed in 1468 patients throughout 2012-2018. Severe destructive pancreatic necrosis occurred in 364 (24.8%) patients. Infected pancreatic necrosis needed for surgical treatment in 264 cases. We used video-assisted retroperitoneal debridement in 20 patients (8.1%). Results. Video-assisted retroperitoneal debridement was not associated with “open” surgery in 6 patients. There were 2-6 redo VARD procedures per patient. We diagnosed the “left-sided” and “right-sided” models of pancreas and peripancreatic space infiltrationin 4 and 2 patients, respectively. There were 14 patients who needed an “open” surgery besides video-assisted retroperitoneal debridement due to advanced inflammation. Bleeding was the only complication and occurred in 2 patients. There was 1 unfavorable outcome. Conclusion. Video-assisted retroperitoneal debridement is an effective minimally invasive approach of debridement. Video-assisted retroperitoneal debridement combined with percutaneous catheter drainage is preferable for “leftsided” and “right-sided” infiltration of pancreas and peripancreatic tissue. It is advisable to combine video-assisted retroperitoneal debridement with open surgery for “mixed model” of infiltration.
Keywords:
поджелудочная железа, деструктивный панкреатит, инфицированный панкреонекроз, моделирование панкреонекроза, секвестрэктомия, видеоассистированная ретроперитонеоскопическая секвестрэктомия, чрескожное дренирование, pancreas, destructive pancreatitis, infectedpancreatic necrosis, pancreatic necrosis modeling, sequestrectomy, video-assisted retroperitoneal debridement, percutaneous drainage
Источник
До настоящего времени существуют разногласия в определении показаний и противопоказаний к различным методам хирургического лечения острого панкреатита.
В последние годы хирургическое лечение острого панкреатита обсуждалось на многочисленных форумах хирургов: I Всемирном конгрессе Международного общества хирургов-гастроэнтерологов (1971), на VI пленуме Правления Всероссийского научно-медицинского общества хирургов (1972), Всероссийской конференции хирургов (1973), V конгрессе хирургов Болгарии (1974), V Всероссийском съезде хирургов (1978), VIII съезде хирургов Белоруссии (1979), пленуме Всесоюзной проблемной комиссии по неотложной хирургии АМН СССР (1980) и др.
Проведенные дискуссии показали, что хирурги едины в вопросе лечения отечной формы острого панкреатита — методом выбора признана консервативная терапия. В отношении лечения деструктивных форм единого мнения не достигнуто. Оперативное лечение большинство хирургов предпринимают по специальным показаниям, чаще при панкреатогенном перитоните» абсцессах или псевдокистах поджелудочной железы. Основные разногласия при определении тактики лечения возникают при трудно диагностируемых, осложненных панкреатогенным перитонитом формах острого панкреатита.
Наиболее значительные противоречия касаются применяемых методов хирургического лечения острого панкреатита. Одни хирурги [Шапкин В. С. и др., 1975; Виноградов В. В. и др., 1979] считают, что хирургические методы лечения острого панкреатита неприемлемы, другие ограничивают вмешательство тампонированием и дренированием сальниковой сумки без рассечения брюшины над поджелудочной железой [Лобачев С. В., 1953; Поливанов И., 1963; Гомзяков Г. И. и др., 1969; Елецкая О. И. 1971; Mattig, Clauss, 1967]. Сторонники так называемых закрытых операций отмечают отрицательный эффект рассечения капсулы железы [Шалимов А. А., 1970; Мороз И. М., 1974; Тоскин К. Д. и др., 1976; Muresan et al., 1962], дополняют операцию перипанкреатической новокаиновой блокадой и оментопанкрео-пексией [Тоскин К.Д., 1966, 1970, 1976; Авдей Л. В. и др., 1974; Фиценко А. Я. и др., 1979, и др.]. Ряд авторов предложили закрытые методы, сочетающиеся с дренированием большого панкреатического протока [Petresco, Blidaru, 1970], декомпрессивными операциями на желчных путях [Иванова В. М., Шаак Т. В.г. 1965; Глускина В. М., 1972; Glenn, Frey, 1964] и даже с папиллосфинктеротомией [Goinard et al., 1968]. В последние годы; увеличилось количество сообщений о резекции поджелудочной железы в острый период заболевания. Идея радикального хирургического лечения острого панкреатита путем резекции поджелудочной железы, субтотальной или даже тотальной панкреатэктомии возникла давно. В 1895 г. Korte, в 1927 г. Hoffman, в 1949 г. С. Г. Рукосуев выполнили резекцию поджелудочной железы при панкреонекрозе. Первая успешная панкреатэктомия при панкреонекрозе была выполнена в 1963 г. Watts. О значительном числе подобных операций с благоприятными исходам сообщили Королев Б. А. и соавт. (1972), Филин В. И. (1979), Шалимов А. А. (1981), Hollender и соавт. (1970), Alexander и соавт. (1977), Roy и соавт. (1977) и др.
Однако большинство хирургов не разделяют мнения о необходимости и показанности панкреатзктомии при панкреонекрозе [Чаплинский В. В., Гнатышак А. И., -1972; Виноградов В.В. и др., 1974; Акжигитов Г.Н., 1974; Glazer, 1975; Latasteet al., 1977,. и др.]. Основные причины отказа от «радикальной» хирургической тактики — трудность интраоперационной диагностики распространенности панкреонекроза, сложность оперативной техники, невозможность предотвращения некроза оставленной части поджелудочной железы, высокая послеоперационная летальность, угроза эндокринной и экзокринной панкреатической недостаточности после операции. Вследствие этого из методов хирургического лечения острого панкреатита в нашей стране наибольшее распространение получили закрытые операции — дренирование сальниковой сумки с последующей перитонеальной перфузией, а также оментопанкреатопексия.
В факультетской хирургической клинике им. С. И. Спасокукоцкого II МОЛГМИ с 1936 по 1979 г. было произведено 275 операций по поводу различных форм острого панкреатита и era осложнений с общей послеоперационной летальностью 32%. В анализируемый период тактика лечения острого панкреатита в клинике изменялась. До 1966 г. большинство больных с деструктивными формами острого панкреатита подвергались операции. В этот период значительное число больных было оперировано по поводу отечных и отечно-геморрагических форм острого панкреатита. Это объясняется не столько высокой хирургической активностью, сколько диагностической необходимостью: операцию производили при неясной клинической картине заболевания и наличии симптомов перитонита. Выполняли открытые операции: рассечение брюшины над тканью железы и тампонирование полости малого сальника через рассеченную желудочноободочную связку.
За этот период более половины больных были оперированы по поводу панкреонекроза, при этом отмечены наибольшее число послеоперационных осложнений и самая высокая послеоперационная летальность — 40,4 %
Неудовлетворительные результаты активного хирургического лечения острого панкреатита, а также улучшение клинической и биохимической его диагностики наряду с внедрением в клиническую практику новых эффективных методов консервативного лечения, в частности ингибиторотерапии, заставили нас перейти преимущественно к консервативному лечению. Кроме того, большое количество послеоперационных осложнений привело нас к решению изменить и методы операций при панкреонекрозе.
Стало ясно, что рассечение капсулы поджелудочной железы, направленное, по существовавшему тогда мнению, на предупреждение и ликвидацию деструктивных процессов в ее паренхиме, неэффективно ввиду дольчатого строения стромы железы и приводит лишь к повреждению паренхимы и сосудов, кровотечению и образованию свищей. Подведение к поджелудочной железе марлевых тампонов вызывает инфицирование сальниковой сумки, забрюшинной клетчатки и брюшной полости. Это обстоятельство побудило нас разрабатывать и внедрять закрытые методы операций, при которых после удаления экссудата, перипанкреатической новокаиновой блокады осуществляется дренирование сальниковой сумки с выведением дренажей через контрапертуры. С «1965 г. в клинике стала применяться оменто-панкреатопексия — окутывание передней поверхности поджелудочной железы прядью большого сальника, что способствует отграничению процесса за счет быстрого развития спаек. Богатая васкуляризация большого сальника обеспечивает улучшение кровоснабжения поджелудочной железы и ускоряет организацию и инкапсулирование некротизированных участков. Оменто-панкреатопексии мы придаем важное значение и считаем ее показанной при оперативном лечении мелко- и крупноочаговых -форм панкреонекроза.
При панкреонекрозе, осложненном панкреатогенным перитонитом, с 1971 г. оментопанкреатопексию мы дополняем введением микроирригаторов и дренажей в брюшную полость для проведения в послеоперационном периоде внутрибрюшной ин-фузии изотонических растворов с антиферментными препаратами, антибиотиками и одновременной активной эвакуации перитонеального экссудата, а также избытка инфузируемого раствора по типу перитонеального диализа.
Методика оментопанкреатопексии. Операцию выполняют путем верхнесрединной лапаротомии. После пересечения желудочно-ободочной связки, ревизии поджелудочной железы и желчных путей производят перипанкреатическую новокаиновую блокаду с добавлением ингибиторов из трех точек: инфильтрируются корень брыжейки поперечной ободочной кишки, ретродуоденальная и ретропанкреатическая клетчатка в области подковы двенадцатиперстной кишки и клетчатка в области тела и хвоста железы. Через отверстие в малом сальнике к передней поверхности железы подводят микроирригатор. Оментопанкреатопексию производят после рассечения желудочно-поджелудочных связок. Достаточно подвижную прядь большого сальника проводят через отверстие в желудочно-ободочной связке и фиксируют отдельными швами к легко заметному после блокады листку брюшины у верхнего и нижнего края поджелудочной железы. Отверстие в желудочно-ободочной связке зашивают отдельными кетгутовыми швами. Для проведения внутрибрюшной инфузии ингибиторов микроирригаторы устанавливают при помощи троакара у краев реберных дуг по среднеключичной линии: правый— по направлению к сальниковому отверстию, левый — к левому куполу диафрагмы. Дренажи для отведения перитонеального экссудата и избытка инфузируемого раствора устанавливают в обеих подвздошных областях.
Абдоминизация поджелудочной железы. При панкреонекро-зах одинаково часто поражается как передняя, так и задняя поверхность поджелудочной железы. При этом ферменты и продукты распада легко поступают в клетчатку забрюшинного пространства, брыжейки толстой и тонкой кишки, иногда достигают малого таза, вызывая некроз, что ведет к быстрому развитию интоксикации. Дренирование брюшной полости, оментопанкреа-топексия, направленные на предупреждение развития перитонита, не обеспечивают в этих условиях отграничения процесса на задней поверхности железы и не предупреждают поступления ферментов и продуктов распада в забрюшинное пространство [Стародубцева Л. Н., 1978; Маят В. С. и др., 1979].
В. А. Козловым (1977) разработана и применена в клинике операция, заключающаяся в выведении железы из забрюшинного пространства в брюшную полость. Эта операция названа автором «абдоминизация поджелудочной железы».
Располагая опытом 23 операций абдоминизации железы, мы считаем ее показанной при жировом панкреонекрозе и смешанных его формах, когда не определяются секвестрация и расплавление ткани железы и есть надежда на ее репарацию. Операцию (рис. 43, а, б, в)
выполняют путем верхнесрединной лапаротомии. После введения раствора новокаина в клетчатку вокруг железы вдоль нижнего и верхнего края тела и хвоста железы рассекают париетальную брюшину. Тело и хвост железы тупым путем выделяют из за-брюшинного пространства совершенно бескровно. Под железу подводят свободный конец лоскута сальника и окутывают им железу. Между железой и сальником укладывают дренажную трубку с боковыми отверстиями, которую выводят через отдельный разрез в поясничной области слева. По показаниям дополнительно дренируют забрюшин-ное пространство для подведения антибиотиков, а также желчные пути. Сальник может быть подведен и под головку поджелудочной железы после мобилизации ее по Кохеру, в результате чего железа только в области шейки сообщается с забрюшинным пространством.
Абдоминизация поджелудочной железы обеспечивает более надежное отграничение патологического процесса от брюшной полости, чем оментопанкреатопексия. Она позволяет полностью прекратить поступление ферментов и продуктов распада в забрюшинное пространство, брыжейки толстой и тонкой кишки. В 19 случаях абдоминизация поджелудочной железы привела к выздоровлению больных, у 15 из них в отдаленные сроки не выявляется признаков хронического панкреатита, что можно, видимо, объяснить хорошим кровоснабжением железы благодаря подведению сальника к задней поверхности железы, не покрытой брюшиной, увеличению площади их соприкосновения и быстрому прорастанию сосудов.
Локальная гипотермия поджелудочной железы. В комплекс мероприятий по лечению острого панкреатита включают гипотермию путем охлаждения поджелудочной железы через брюшную стенку, желудок, толстую кишку. Значительное снижение температуры угнетает обменные процессы в ткани железы, понижает ее ферментативную функцию, уменьшает активность протеолитических ферментов.
Экспериментальные исследования В. А. Козлова (1979) показали, что непосредственная локальная гипотермия поджелудочной железы во много раз эффективнее гипотермии желудка. Локальную прямую гипотермию выполняют в послеоперационном периоде с помощью специального зонда, подведенного к поджелудочной железе во время операции. После осуществления операции на железе (дренирование, оментопексия, абдоминизация и др.) на нее укладывают специально изготовленный ла-тексный баллон, соединенный с двухпросветной трубкой, которую через отдельный разрез в левом подреберье выводят наружу. В первые 2—4 дня после операции с учетом состояния больного и данных лабораторного исследования через двухпро-светную трубку, выведенную наружу, периодически 3 раза в день по 2—4 ч охлаждают поджелудочную железу. После улучшения состояния больного баллон опорожняют и извлекают. В. А. Козлов считает, что основное достоинство указанного способа в том, что удается добиться значительного локального охлаждения поджелудочной железы без выраженной общей гипотермии. Однако автор не рекомендует специально производить хирургическое вмешательство только для осуществления гипотермии.
Закрытые операции были выполнены у 72 больных панкреонекрозом с летальностью 29%, открытые — у 119 с летальностью 47%. Оментопанкреатопексия выполнена у 35 больных панкрео-некрозом с летальностью 25%. Абдоминизация железы произведена у 23 больных панкреонекрозом, из которых 4 умерли (17%).
Анализ полученных нами результатов показывает, что закрытые операции при остром панкреатите патогенетически обоснованы, поскольку сохраняют асептичность патологического процесса, позволяют эвакуировать и инактивировать резко токсичный перитонеальный экссудат, подвести к железе ингибиторы и создать максимальную концентрацию антиферментных препаратов в поджелудочной железе и перипанкреатической клетчатке. Оментопанкреатопексия и абдоминизация железы способствуют отграничению патологического процесса в период некроза и секвестрации поджелудочной железы и предотвращают развитие панкреатогенного перитонита и забрюшинной флегмоны.
Хирургическому лечению дегенеративно-гнойных осложнений острого панкреатита до последнего времени уделяли недостаточно внимания. Это объясняется прежде всего тем, что подобные осложнения встречались не так часто; такие тяжелые больные умирали до развития осложнений. Правильная лечебная тактика позволяет купировать тяжелый патологический процесс и вывести больных из состояния панкреатогенной токсемии и шока, в связи с чем относительно увеличилось и число дегенеративных и гнойных осложнений, которые являются неизбежным следствием диффузного панкреонекроза.
Степень распространенности и характер деструкции поджелудочной железы, парапанкреатической и забрюшинной клетчатки, а также присоединение инфекции предопределяют форму дегенеративных и гнойных осложнений: поликистозная дегенерация железы, постнекротический инфильтрат или псевдокиста, апостематозный или гнойный панкреатит, абсцесс железы, дегенеративная и гнойная флегмона забрюшинной клетчатки, дегенеративный и гнойный оментит. За исключением постнекротического инфильтрата, хирургическое лечение показано при всех формах дегенеративных и гнойных осложнений.
По поводу гнойного панкреатита мы оперировали 22 больных; у всех произвели вскрытие абсцессов сальниковой сумки, ее тампонаду и дренирование, у 4 операцию дополнили люм-ботомией. Летальность среди оперированных по поводу гнойного панкреатита составила 50%.
Для профилактики развития гнойных осложнений нам представляется наиболее перспективным внедрение в практику ранних радикальных операций: секвестрэктомии, некрэктомии, резекции железы и даже панкреатэктомии. Как показывает наш опыт, подобное вмешательство необходимо предпринимать именно у тех 10% больных, у которых активное терапевтическое лечение оказывается неэффективным и быстро прогрессирует некротический процесс.
Наиболее сложную проблему представляет своевременная диагностика формы острого панкреатита с обширными и тотальными некротическими необратимыми процессами. Современные методы диагностики (определение активности ферментов, лапароскопия, селективная ангиография и др.), тщательное изучение клиники и течения заболевания у конкретного больного, объективная оценка результатов интенсивной терапии позволяют своевременно диагностировать эти тяжелые формы заболевания.
Мы располагаем опытом 13 экстренных радикальных вмеша тельств при панкреонекрозе: 2 секвестрэктомии, 3 некрэктомии и 8 корпорокаудальных резекций поджелудочной железы со спленэктомией. Четверо больных умерли в ближайшем послеоперационном периоде.
Мы не считаем целесообразным подробно описывать технику этих операций, так как они изложены в специальной литературе. Однако отметить некоторые особенности их выполнения необходимо.
Секвестрэктомия — удаление некротизированной части железы в пределах погибших тканей — может быть выполнена тупым путем, чаще дигитоклазией, и не сопровождается кровотечением.
Некрэктомию — удаление некротизированной части железы в пределах кровоснабжаемых тканей — выполняют острым путем: ткани железы рассекают по границе некроза и тща