Влияние на секрецию бикарбонатов поджелудочной железой
Предотвращение самопереваривания поджелудочной железы. Секреция ионов бикарбоната
Необходимо подчеркнуть, что протеолитические ферменты поджелудочного сока не активируются до тех пор, пока не будут выделены в кишечник, поскольку трипсин и другие ферменты могли бы переварить саму поджелудочную железу. К счастью, клетки, которые секретируют протеолитические ферменты в ацинусах поджелудочной железы, выделяют одновременно вещество, названное ингибитором трипсина. Эта субстанция образуется в цитоплазме железистых клеток и предотвращает активацию трипсина как внутри секреторных клеток, так и в ацинусах и протоках поджелудочной железы. Вследствие того, что трипсин активирует другие панкреатические протеолитические ферменты, ингибитор трипсина в той же степени предотвращает их активацию.
При повреждении поджелудочной железы или блокировании протока в поврежденных участках поджелудочной железы может собираться большое количество панкреатического секрета. В таких условиях часто подавляется действие ингибитора трипсина, и происходит стремительная активация панкреатического секрета, который может буквально полностью переварить поджелудочную железу в течение нескольких часов. Такое состояние называют острым панкреатитом. Это состояние может быть смертельным, т.к. сопровождается циркуляторным шоком. Даже если оно не привело к смерти, то в дальнейшем обычно возможна хроническая недостаточность поджелудочной железы.
Секреция ионов бикарбоната
Хотя ферменты поджелудочного сока полностью выделяются ацинусами поджелудочной железы, два других важных компонента панкреатического сока — ионы бикарбоната и вода — выделяются главным образом эпителиальными клетками канальцев и протоков, которые выходят из ацинусов. Когда поджелудочная железа начинает выделять большие количества панкреатического сока, концентрация иона бикарбоната может повышаться вплоть до 145 мэкв/л. Это приблизительно в 5 раз больше, чем количество ионов бикарбоната в плазме, что создает большое количество щелочи в панкреатическом соке и обеспечивает нейтрализацию соляной кислоты, поступающей из желудка в двенадцатиперстную кишку.
Основные моменты клеточных механизмов секреции раствора бикарбоната натрия в канальцы и протоки поджелудочной железы показаны на рисунке. Они заключаются в следующем.
1. Углекислый газ диффундирует внутрь клетки из крови и под влиянием карбоангидразы соединяется с водой, образуя угольную кислоту (Н2СО3). Угольная кислота, в свою очередь, диссоциирует на ионы бикарбоната (НСО3~) и ионы водорода (Н+). Затем ионы бикарбоната в комплексе с ионами натрия (Na+) активно транспортируются через клеточную мембрану в просвет протока.
2. Ионы водорода, образованные путем диссоциации угольной кислоты внутри клетки, обмениваются на ионы натрия через базалъную часть мембраны клетки путем вторичного активного транспорта. Поступившие ионы натрия транспортируются через клеточную мембрану в просвет панкреатического протока, обеспечивая электрическую нейтральность секретируемым бикарбонатам.
3. Суммарное движение натрия и бикарбонатов из крови в просвет протока создает осмотический градиент давления, который обусловливает также осмотический перенос воды в проток, создавая таким образом почти изоосмолярный раствор бикарбоната натрия.
— Вернуться в оглавление раздела «Физиология человека.»
Оглавление темы «Желудочная и поджелудочная секреция»:
1. Регуляция функции желез пищеварительного тракта. Нервная регуляция секреции желез
2. Секреция воды и электролитов в ЖКТ. Физиология слизи желудочно-кишечного тракта
3. Физиология слюны. Секреция слюны
4. Гигиенические свойства слюны. Нервная регуляция слюноотделения
5. Секреция в пищеводе. Физиология желудочной секреции
6. Физиология секреции пепсиногена. Секреция желудочной слизи и гастрина
7. Стимуляция секреции кислоты в желудке. Стимуляция секреции гастрина
8. Физиология и фазы желудочной секреции. Торможение и регуляция желудочной секреции
9. Строение гастрина. Физиология секреции поджелудочной железы
10. Предотвращение самопереваривания поджелудочной железы. Секреция ионов бикарбоната
Источник
Поджелудочная
железа является железой внешней и
внутренней секреции; она продуцирует
панкреатический сок, играющий значительную
роль в процессе пищеварения и обмена.
По предположению большинства
исследователей, в сутки железа выделяет
1000-4000 мл панкреатического сока; он имеет
щелочную реакцию (рН 8,71-8,98). В его состав
входят ферменты, расщепляющие белки,
жиры и углеводы, а также вода, электролиты
и гидрокарбонат. Удельный вес
панкреатического сока колеблется в
зависимости от концентрации в нем
белков и электролитов и имеет следующие
показатели:
На
98% панкреатический сок состоит из воды;
сухой остаток составляет 1,0-1,23%.
Различают
четыре группы ферментов поджелудочной
железы:
1.
Протеазы (пептидазы): химотрипсиноген,
трипсиноген, карбоксипеп-тидаза,
аминопептидаза, коллагеназа, эластаза.
2.
Липаза (эстераза).
3.
Карбоангидразы (гликозидазы): мальтаза,
амилаза, лактаза.
4.
Нуклеазы: дезоксирибонуклеаза,
рибонуклеаза
Трипсин
и химотрипсин вырабатываются поджелудочной
железой в неактивной форме в виде
трипсиногена и химотрипсиногена. В
двенадцатиперстной кишке трипсиноген
активизируется под влиянием кишечной
энтерокиназы и солей кальция, а
химотрипсиноген — под действием
трипсина. По активности химотрипсин
слабее трипсина и имеет более узкий
спектр действия, однако, в отличие от
последнего, вызывает створаживание
молока. Трипсин расщепляет любые
денатурированные белки, не действует
на жировую ткань, нативный коллаген;
разрушается в процессе пассажа по
кишечнику и в кале, как правило, не
определяется.
Липаза
продуцируется железой в неактивной
форме, но в результате действия желчных
кислот и гистидина активизируется и
расщепляет нейтральные жиры до жирных
кислот и глицерина. Из панкреатического
сока выделены также фосфолипаза А
(гидролиз фосфолипидов, лецитина) и
карбоксилэстераза (гидролиз эфиров
жирных кислот), осуществляющие
липолиз. Железа выделяет основное
количество липазы. Этот фермент активен
в тонкой кишке в присутствии желчных
кислот, которые способствуют
эмульгированию жиров. Молекула липазы
стабилизируется и активизируется
ионами кальция и магния. Фосфолипаза А
и В поступают в двенадцатиперстную
кишку в неактивном состоянии, и там они
активизируются трипсином.
Амилаза,
в отличие от других ферментов, выделяется
в активной форме и способствует
расщеплению углеводов. Она может
выделяться и другими органами
(печенью, слюнными железами).
Инвертаза
расщепляет сахарозу, лактаза — молочный
сахар.
Бикарбонаты
наряду с ферментами играют важную роль
в пищеварении. Основной их функцией
является нейтрализация кислого пищевого
химуса, поступающего из желудка; кроме
того, бикарбонаты защищают слизистую
кишечника и являются оптимальными для
действия гидролаз.
Натрий
составляет 95% всех катионов. Значение
натрия и калия для работы железы
неизвестно. Кальций играет важную роль
в регуляции внутриклеточного синтеза
ферментов и их выхождении в протоки
желез.
Роль
микроэлементов, содержащихся в
панкреатическом соке в очень небольшом
количестве, изучена слабо.
Механизм
панкреатической секреции — нейрогуморальный.
Нервная система оказывает на железу
прямое и опосредованное действие.
Активизировать секрецию, по И.П.
Павлову (1902), удается путем стимуляции
блуждающих нервов (прямое действие).
Опосредованное влияние нервной
системы осуществляется через механизмы
регуляции высвобождения гастрина.
Парасимпатическая нервная система
стимулирует, а симпатическая угнетает
деятельность железы (Богер М.М., 1982).
Отчетливое повышение секреции ферментов
вызывают метахолин, ацетилхолин. При
раздражении волокон симпатической
нервной системы наблюдается резкое
сужение кровеносных сосудов железы,
что сопровождается снижением ее
экзокринной функции.
По
данным И.Л. Долинского (1894) и Л.Б. Попельского
(1896), местное раздражение слизистой
оболочки тонкой кишки соляной кислотой
(кислым желудочным содержимым)
вызывает образование в слизистой
оболочке двенадцатиперстной кишки
секретина, который, поступая в кровь,
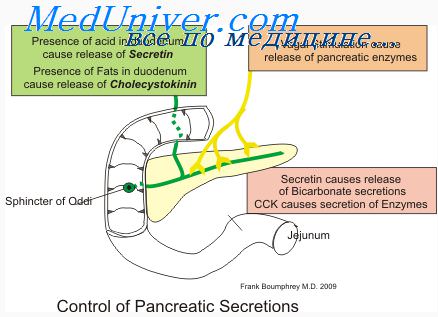
стимулирует панкреатическую секрецию.
В отличие от вагусного влияния,
вызывающего выделение богатого ферментами
сока, секретин стимулирует отделение
сока с низким содержанием ферментов,
однако с большим количеством щелочей.
Известно, что экзокринная функция железы
регулируется в основном секретином,
холецистокинин-панкрео-зимином и
гастрином.
Секретин
и холецистокинин, активизируя друг
друга, попадают в кровь из S-клеток
(секретин) и I-клеток
(холецистокинин) слизистой оболочки
двенадцатиперстной кишки.
Эндокринная
функция поджелудочной железы связана
с деятельностью островков Лангерганса,
клетки которых выделяют в кровь инсулин
(бета-клетки), глюкагон (альфа-клетки),
соматостатин (дельта-клетки).
Инсулин
— анаболический гормон, содержащий
остатки 51 аминокислоты. Он необходим
для процесса гликогенеза и липогенеза.
Всасывание углеводов с последующей
гипергликемией является стимулом для
его выделения. Физиологическое действие
инсулина многогранно. Характерным
проявлением его отсутствия является
повышение уровня сахара в крови. Однако
необходимо помнить о взаимном влиянии
на количество сахара в крови функции
гипофиза, инсулярного аппарата печени
и надпочечников.
Глюкагон
содержит 29 остатков аминокислот;
выделяется в период голодания.
Спобствует поступлению в кровь глюкозы
из запасов гликогена в печени, а кроме
того, глюкогенезу в печени. По данным
А. А. Шелагурова (1970), глюкагон и инсулин
являются антагонистами. Известны три
формы этого гормона: глюкагон,
вырабатываемый L-клетками
островков Лангерганса; энтероглюкагон
и желудочный глюкагон. Все три формы
повышают
концентрацию сахара в крови. Под влиянием
панкреатического глюкагона уменьшается
объем панкреатической секреции и дебит
ферментов; секреция бикарбонатов не
изменяется.
Экзогенный
глюкагон с успехом применяется для
лечения острого панкреатита, однако
роль этого гормона в регуляции секреции
железы пока неизвестна. Считается, что
он влияет на поджелудочную железу
различными способами: путем снижения
кровообращения железы в результате
спазма сосудов; уменьшения содержания
кальция в крови, угнетения высвобождения
секретина, кислотообразующей функции
желудка.
Соматостатин
содержит остатки 14 аминокислот; тормозит
секрецию глюкагона и инсулина.
Высвобождение соматостатина стимулируется
глюкозой, лейцином, аргинином и тормозится
адреналином. Механизм действия
соматостатина на железу не ясен.
Липокаин
— вещество, также выделяемое островковым
аппаратом железы; препятствует жировому
перерождению печени (Лепорский Н.И.,
1951).
По
мнению многих авторов, поджелудочная
железа вырабатывает и ряд других
биологически активных веществ
(лактоферрин, калликреин, ваготонин,
иммуноглобулин А). Калликреин понижает
давление, вызывая расширение артерий
мозга, сердца, кожи, легких, мышц. Железа
продуцирует неактивную форму этого
гормона — калликреиноген, который
активизируется трипсином. Ваготонин
повышает тонус блуждающих нервов и
вызывает ряд эффектов, связанных с их
возбуждением, в том числе падение
артериального давления.
Источник
Хронический панкреатит – кислотозависимое заболевание: его течение и прогрессирование поддерживает соляная кислота. Закисление двенадцатиперстной кишки, с одной стороны, способствует развитию неэффективности ферментной терапии, с другой – вызывает повышенную стимуляцию деятельности поджелудочной железы, что поддерживает обострение хронического панкреатита и усиливает болевой синдром. Понимание механизмов, лежащих в основе этого явления, позволяет проводить медикаментозную коррекцию и повышать эффективность терапии данного заболевания.
Эпителий протоков в основном секретирует воду и электролиты (гидрокарбонаты), обеспечивающие панкреатическому секрету щелочной рН (7,5–8,8). Гидрокарбонаты сока поджелудочной железы ощелачивают кислое пищевое содержимое желудка при его эвакуации в двенадцатиперстную кишку, останавливая желудочное пищеварение. При этом инактивируется пепсин, который в условиях кислой среды (рН
При хроническом панкреатите (ХП) возникает недостаточность секреции бикарбоната, что приводит к чрезмерной ацидификации дуоденального химуса кислым желудочным содержимым. Закисление двенадцатиперстной кишки может стать причиной серьезных нарушений полостного пищеварения с развитием мальдигестии и мальабсорбции. В кислой среде происходит инактивация ферментов поджелудочной железы (при рН
В этих условиях реакция организма направлена на компенсацию нарушенного пищеварения – происходит стимуляция секреции поджелудочной железы, поскольку под влиянием кислоты выработка секретина продолжается, а нарушенная активация трипсина способствует сохранности ХЦК-рилизинг-фактора и выработке ХЦК. При ХП, когда секреторный потенциал поджелудочной железы снижен, избыточная нагрузка на сохранную паренхиму способна усугубить заболевание и привести к обострению ХП (рис. 1). Таким образом, недостаточность секреции бикарбоната усугубляет ферментную недостаточность (при экзокринной недостаточности поджелудочной железы) или вызывает ее посредством названных механизмов (относительная ферментная недостаточность).
Активация компенсаторных механизмов организма при ХП (гиперсекреция секретина и ХЦК) способствует повышению тканевого и протокового давления в поджелудочной железе и, как следствие, усилению болевого синдрома [4]. Закисление двенадцатиперстной кишки поддерживает развитие данного патологического цикла (рис. 1).
Коррекция ферментной несостоятельности поджелудочной железы ферментными препаратами, в том числе в кишечнорастворимой оболочке, вследствие закисления двенадцатиперстной кишки может быть неполной. Оболочка растворяется при рН ≥ 5,5. При низких значениях рН в двенадцатиперстной кишке экзогенно поступающие ферменты активируются в нижних отделах кишки. При этом разрушения рилизинг-пептидов ХЦК и секретина не происходит, механизм обратного торможения может оказаться несостоятельным. При растворении кишечнорастворимой оболочки ниже двенадцатиперстной кишки активации липазы желчными кислотами и колипазой также не будет. Кроме того, экзогенные ферменты в тонкой кишке подвергаются аутолизу. Как известно, собственные ферменты в составе химуса, поступившего в тощую кишку, имеют 74% амилолитической активности дуоденального содержимого, 22% протеолитической и только 1% липолитической активности. Таким образом, одной из причин низкой эффективности ферментозаместительной терапии может быть закисление двенадцатиперстной кишки.
Нельзя не вспомнить и о дискуссии по поводу влияния (или отсутствия такового) ферментных препаратов на боль у пациентов с ХП. Все рандомизированные исследования, посвященные этому вопросу, проводились без использования препаратов, нейтрализующих соляную кислоту или блокирующих ее продукцию [5–10]. Неоднозначность полученных результатов может быть обусловлена закислением двенадцатиперстной кишки и связанными с ним эффектами.
Диагностика ферментной и бикарбонатной недостаточности поджелудочной железы
Степень выраженности экзокринной недостаточности можно оценить с помощью инвазивных (прямых) тестов – секретинового, секретин-панкреозиминового (церулеинового), теста Лунда. При их использовании собирается секрет поджелудочной железы в базальном состоянии и после стимуляции с последующим определением содержания ферментов и бикарбоната. В настоящее время из-за трудоемкости, высокой стоимости и плохой переносимости пациентами инвазивные тесты ограниченно применяются в диагностике ХП.
В ранних исследованиях, проведенных с помощью секретинового или секретин-панкреозиминового теста, были получены четкие параметры объема и характера секреции поджелудочной железы у здоровых лиц и больных ХП. По данным М.М. Богера (1984), объем секреции и концентрация бикарбоната у больных ХП по сравнению со здоровыми лицами снижены. При этом продукция ферментов может быть как сниженной, так и повышенной. Повышенную концентрацию нередко фиксировали в начальных стадиях развития воспалительно-дистрофического процесса в поджелудочной железе [3]. Это свидетельствует о том, что развитие бикарбонатной недостаточности может опережать развитие ферментной недостаточности.
Результаты изучения внешнесекреторной функции поджелудочной железы с помощью интрадуоденального зондирования после введения солянокислого метионина c последующим забором трех 20-минутных порций панкреатического сока у 120 больных с умеренным или легким обострением ХП показали достоверное снижение количества панкреатического сока и его качественного состава (концентрации и дебита амилазы и бикарбонатов). Амилазу в секрете определяли методом Дж. Вольгемута (J. Wohlgemuth), бикарбонатную щелочность – методом обратного титрования по А.А. Шелагурову. После проведенного комплексного лечения наблюдали увеличение исходно сниженного уровня ферментов до уровня показателей контрольной группы и повышение концентрации бикарбонатов до субнормальных показателей. Отмечены также увеличение скорости и часового напряжения секреции, положительная тенденция роста стимулированного дебита основных компонентов [12]. Таким образом, даже легкое или умеренное обострение ХП сопровождается развитием как ферментной, так и бикарбонатной недостаточности.
Неинвазивные (непрямые) методы (бентираминовый тест, дыхательный тест с 13C-меченными триглицеридами, определение эластазы кала) низкочувствительны в определении ранних стадий внешнесекреторной недостаточности и не позволяют оценить секрецию бикарбоната, поскольку ориентированы исключительно на косвенную оценку выработки ферментов.
Частота выявления внешнесекреторной недостаточности по изучению ферментов зависит от метода определения. Так, по данным О.Н. Минушкина [13], при изучении внешнесекреторной функции поджелудочной железы у 260 больных ХП по эластазному тесту внешнесекреторная недостаточность в период обострения зафиксирована у 76% больных. Этот показатель оказался динамичным, по мере купирования обострения группа со стойкой недостаточностью внешнесекреторной функции поджелудочной железы составила 46%. Однако эластазный тест определяет умеренную и выраженную секреторную недостаточность. Выявление легких степеней – прерогатива прямых методов исследования.
По данным Ю.А. Кучерявого, суточное мониторирование рН желудка и двенадцатиперстной кишки у 81 больного с тяжелой внешнесекреторной недостаточностью поджелудочной железы (эластаза кала
Представленные данные свидетельствуют о том, что при сохраненной желудочной секреции соляной кислоты и тяжелой внешнесекреторной недостаточности закисление двенадцатиперстной кишки является практически облигатным. Однако и при легкой и умеренной экзокринной недостаточности можно наблюдать снижение выработки бикарбоната, особенно при обострении ХП. В практической деятельности для диагностики данного состояния необходимо проводить суточную рН-метрию желудка и двенадцатиперстной кишки, позволяющую констатировать выраженность и продолжительность закисления двенадцатиперстной кишки и проводить соответствующую медикаментозную коррекцию.
Медикаментозная коррекция закисления двенадцатиперстной кишки
В современных рекомендациях по ведению больных ХП блокаторы желудочной секреции упоминаются в основном как средства, предупреждающие инактивацию ферментов [15–18]. Это одна точка зрения. Другая точка зрения заключается в том, что применение этой группы препаратов имеет самостоятельное значение и патогенетически оправданно. Обсуждается использование Н2-блокаторов гистамина [19, 20] и ингибиторов протонной помпы (ИПП) [21–23]. Так, применение фамотидина в лечении больных острым и хроническим панкреатитом сопровождалось положительной динамикой в купировании болевого синдрома после первых инъекций. По мнению авторов, высокая терапевтическая эффективность фамотидина обусловлена не только подавлением кислой желудочной секреции, но и его выраженными антиоксидантными свойствами [19]. Однако применение Н2-блокаторов гистамина ограничено более низкой эффективностью по сравнению с ИПП, развитием феномена рикошета после отмены, достаточно быстрым снижением антисекреторного действия. Учитывая это, назначение ИПП для кислотоснижающей терапии при лечении ХП предпочтительнее.
Уменьшение боли у пациентов с ХП на фоне приема ИПП отмечено в ряде исследований. По данным И.В. Маева и соавт., введение ИПП в схему комплексного лечения ХП приводит к уменьшению интенсивности и купированию болевого абдоминального синдрома, позволяет раньше отменять анальгетики, устраняет явления гастродуоденита. Уменьшение болевого синдрома может быть объяснено снижением протокового и тканевого давления поджелудочной железы, а также позитивной динамикой сывороточных концентраций про- и противовоспалительных цитокинов, четко коррелирующей с уровнем подавления кислотообразования [21].
Вопрос продолжительности терапии ХП с использованием ИПП нуждается в дополнительном изучении. Приведенные выше данные свидетельствуют о целесообразности использования ИПП в период обострения ХП. В то же время ферментозаместительная терапия больным ХП с выраженной экзокринной недостаточностью показана пожизненно. Очевидно, что восстановление секреции как ферментов, так и бикарбоната у этой категории больных не произойдет. По этой причине им показано проведение суточного рН-мониторирования желудка и двенадцатиперстной кишки и вне обострения ХП. При закислении двенадцатиперстной кишки терапия ИПП должна быть продолжена. Другим основанием для их назначения является сопутствующая гастроэзофагеальная рефлюксная болезнь (ГЭРБ), которая часто встречается у больных ХП [24, 25].
Выбор препарата из группы ИПП представляет определенные сложности в связи с их разнообразием и противоречивыми данными об их сравнительной эффективности. Различия между ними определяются скоростью и продолжительностью кислотоблокирующего эффекта, а также влиянием на метаболизм других препаратов, проходящих через систему цитохрома Р450.
Под действием ИПП протонная помпа инактивируется, но затем ее активность возвращается на прежний уровень [26]. После приема лансопразола полупериод восстановления выработки кислоты составляет 12,9 часа, омепразола и рабепразола – 27,5 часа, а пантопразола – 45,9 часа [27]. Разница в продолжительности ингибирования обусловлена отличиями в длительности сохранения связей ИПП с остатками цистеина АТФазы. Омепразол и остальные препараты взаимодействуют с остатками цистеина в положении 813, лансопразол – с цистеином 321, пантопразол – с цистеином 822. Цистеин 822 обеспечивает устойчивость связывания, поэтому при использовании пантопразола секреция соляной кислоты возобновляется преимущественно из-за синтеза АТФазы, а не из-за разрушения химической связи ИПП с протонной помпой. Таким образом, продолжительность эффекта пантопразола больше по сравнению с таковой других ИПП [28].
Метаболизм всех ИПП происходит в печени при участии цитохрома Р450. Большинство ИПП ингибируют метаболизм многих лекарственных средств, таких как диазепам, фенитоин, варфарин, бета-адреноблокаторы, дигоксин, теофиллин, диклофенак, кларитромицин, клопидогрел и др. [29]. При необходимости сочетанного приема нескольких препаратов целесообразно использовать ИПП с минимальным влиянием на микросомальные ферменты гепатоцитов. Пантопразол по этому показателю превосходит другие ИПП. Полипрагмазия достаточно часто встречается у больных ХП, лечение которых может потребовать применения препаратов самых разных групп. При одновременном приеме двух лекарств риск развития нежелательных явлений, вызванных лекарственными взаимодействиями, достигает 6%, пяти – 50%, восьми – 100% (рис. 2) [30]. Чтобы снизить риск нежелательных последствий (независимо от количества одновременно принимаемых медикаментов), предпочтение следует отдавать препарату с низким потенциалом лекарственного взаимодействия – пантопразолу.
Одним из генерических препаратов пантопразола, представленных на отечественном фармацевтическом рынке, является препарат Панум® (пантопразол) (UNIQUE PHARMACEUTICAL Laboratories, Индия).
Нами оценивались эффективность и безопасность данного препарата в терапии ГЭРБ. Препарат Панум® в дозе 40 мг в сутки продемонстрировал высокую эффективность в лечении больных ГЭРБ 1–4-й степени: полное заживление эрозий в пищеводе к четвертой неделе и исчезновение симптоматики наблюдали в 91% случаев. Лечение препаратом Панум® приводило к достоверному увеличению уровня сывороточного гастрина-17 более чем в два раза. Это косвенно отражает эффективную кислотосупрессию при лечении данным препаратом [31].
Дополнительные преимущества препарата Панум®:
- длительное подавление кислотной продукции, что делает безопасным пропуск очередного приема препарата;
- низкая аффинность к цитохрому Р450, позволяющая эффективно и безопасно проводить необходимую сопутствующую терапию;
- наличие парентеральной формы, что обеспечивает быстрое повышение концентрации препарата в плазме крови и развитие антисекреторного эффекта.
Таким образом, закисление двенадцатиперстной кишки, с одной стороны, способствует развитию неэффективности ферментной терапии, с другой – вызывает повышенную стимуляцию деятельности поджелудочной железы, что поддерживает обострение ХП и усиливает болевой синдром. Блокада желудочной секреции является важной составляющей патогенетической терапии ХП. Продолжительное действие и низкий риск развития лекарственных взаимодействий делают пантопразол препаратом выбора. Одним из препаратов пантопразола с доказанной эффективностью является Панум®.
Источник


