Гиперфункция поджелудочной железы глюкагон
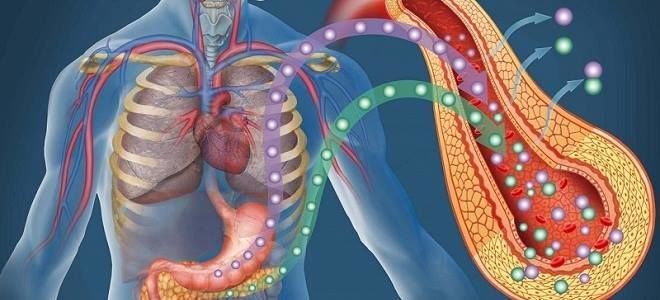 Гиперфункция и гипофункция поджелудочной железы, независимо от причины появления, представляют опасность для здоровья. Сбои в работе связаны с расстройством секреторной деятельности органа. Особенно тяжело протекает сахарный диабет — состояние с нарушенным синтезом или выработкой инсулина, которое развивается при гипофункции поджелудочной железы, приводит к тяжелым поражениям многих органов и систем, изменяет образ жизни больного и длительно лечится.
Гиперфункция и гипофункция поджелудочной железы, независимо от причины появления, представляют опасность для здоровья. Сбои в работе связаны с расстройством секреторной деятельности органа. Особенно тяжело протекает сахарный диабет — состояние с нарушенным синтезом или выработкой инсулина, которое развивается при гипофункции поджелудочной железы, приводит к тяжелым поражениям многих органов и систем, изменяет образ жизни больного и длительно лечится.
В процессе терапии может возникнуть другое нарушение, когда количество вырабатываемых гормонов резко увеличивается. При гиперфункции поджелудочной железы нередко развивается жизнеопасное состояние, если количество синтезируемых гормональных веществ становится критично высоким. В таких случаях необходимо оказание неотложной помощи.
Структура поджелудочной и основные функции железы
Поджелудочная железа (ПЖ) является органом, одновременно относящимся к пищеварительной и эндокринной системе и выполняющим экскреторную и инкреторную функции. Это связано со строением тканей, строго разделяющимся по структуре и выполняемым функциям.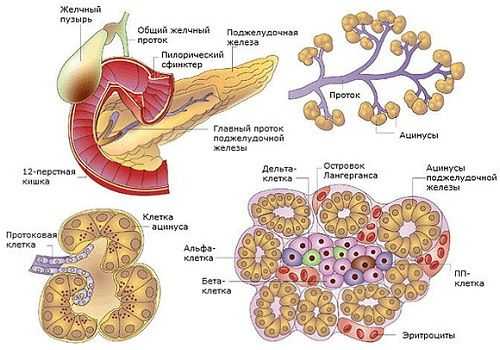
Эндокринная часть ПЖ состоит из скопления клеток, вырабатывающих гормоны. Составляет 1,5% объема органа, называется островками Лангерганса, у человека их насчитывается 1—1,5 млн. Состоят из нескольких видов клеток, вырабатывающих строго определенные гормоны:
- α (25%) − глюкагон,
- β (60%) − инсулин и амилин,
- δ (10%) – соматостатин,
- PP (5%) − вазоактивный интестинальный полипептид (ВИП), панкреатический полипептид (ПП),
- g-клетки − гастрин, влияющий на желудочный сок, его кислотность.
Среди всех гормонов главное значение как в условиях нормы, так и при патологии, играет инсулин.
Остальная часть ПЖ (90%) выполняет экзокринную функцию. Представлена железистыми клетками, продуцирующими ферменты панкреатического сока. Они расщепляют поступающую в организм пищу:
- трипсин,
- липаза,
- амилаза.
Помимо этих главных представителей, в каждую группу входит еще по несколько ферментов. Все они направлены на обеспечение внешнесекреторной функции — поддержания процесса нормального пищеварения. При воспалении ПЖ агрессивные по отношению к любой ткани ферменты могут вызывать самопереваривание железы из-за их высокой активности. Прогноз может быть неблагоприятным при появлении осложнений.
Гиперфункция поджелудочной железы
Гиперфункция поджелудочной железы зависит от того, какая часть органа патологически изменена. Проявлением повышенной внешнесекреторной деятельности ПЖ является ферментный выброс, развитие панкреатита и всех проявлений, связанных с его обострением. При отсутствии лечения гиперферментемия может привести к панкреонекрозу и другим осложнениям, угрожающим жизни.
Если происходит интенсивная секреция гормонов ПЖ, это вызывает чаще всего симптоматику гипогликемии (при высоком синтезе железой инсулина). Она опасна для ЦНС.
Причины возникновения
Существует три глобальных причины развития повышенной эндокринной функции ПЖ:
Инсулома
Чаще всего в развитии и росте инсуломы участвует клетки разных видов. Около 60% опухолей продуцируют инсулин, но может преобладать секреция гастрина, соматостатина, панкреатического полипептида. Инсулома развивается в виде аденомы — доброкачественного новообразования, или как аденокарцинома — злокачественная, быстропрогрессирующая опухоль. В последнем случае возможен летальный исход из-за осложнений, которые возникают из-за воздействия на организм большого количества инсулина, и распространения опухоли.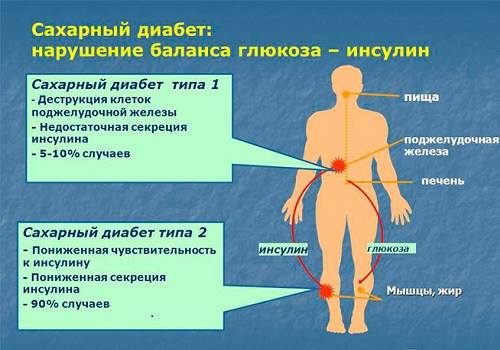
По данным статистики, среди диагностированных инсулом выявляются:
- 80% – доброкачественные аденомы,
- 9% – с признаками озлокачествления,
- 11% – злокачественные аденокарциномы.
Развивается опухоль в возрасте 35—50 лет, в 2 раза чаще выявляется у женщин, чем у мужчин, у детей практически не встречается. Не является наследственным заболеванием.
Виды инсулом
Первичная симптоматика болезни
Симптомы патологии зависят от превалирования секреции конкретного гормона. Чаще всего увеличивается продукция инсулина.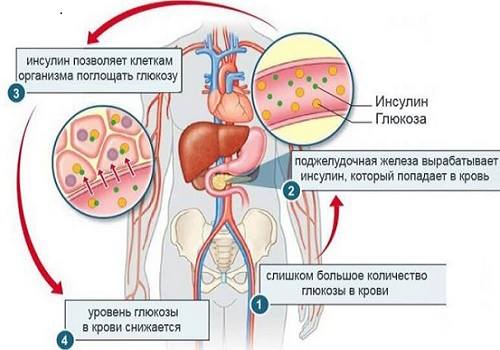
Клиническая картина индивидуальна, но имеет ряд нарушений в состоянии, по которым можно заподозрить патологию. Это триада Уиппла — симптомы, связанные с падением сахара в крови:
С течением времени присоединяется неврологическая симптоматика, нарушение слуха и зрения. Чаще появляются:
- дезориентация в утреннее время,
- судорожные приступы, длительные по времени, напоминающие эпилептические,
- вегетативные нарушения прогрессируют и учащаются: гипергидроз (повышенная потливость), резкая слабость, покраснение лица, вялость, повышение артериального давления (АД), приступы тахикардии или аритмии,
- психомоторные возбуждения с несвязной речью и бессмысленными движениями, сходные с состоянием опьянения,
- нарушение сознания вплоть до комы.
Заболевание опасно тем, что на начальных этапах нет никаких специфических симптомов. Состояние напоминает глубокую усталость, астенический синдром или протекает как вегетососудистая дистония. Во многих случаях клиника развивается постепенно: появляется рассеянность, отсутствие концентрации, иногда человек не может сосредоточиться и правильно ответить на простой вопрос.
В дальнейшем, по мере падения уровня сахара в крови, возникают случаи психомоторного возбуждения (метания, бессмысленные поиски, некоординированные движения, невозможность общения). Появляются элементы спутанности сознания с нарушением ориентации, которые учащаются и прогрессируют, состояния, напоминающие сон: человек куда-то идет или совершает действия необъяснимые и неосознанные. Могут учащаться и вегетативные приступы: внезапные повышения АД до высоких цифр, приступы сердцебиений, потливость. Состояние сопровождается сухостью во рту, тошнотой, рвотой. Через год развиваются необратимые изменения в психике из-за частых эпизодов гипогликемии.
Несмотря на частые приступы голода, из-за чрезмерного питания между ними может развиться ожирение. В большинстве случаев, при длительном течении болезни возникают истощение и мышечная атрофия.
Обострение заболевания
При гиперфункции ПЖ, связанной с усиленной выработкой инсулина, возникают гипогликемические состояния и кома. Ухудшение, связанное с низким сахаром в крови, не всегда наступает постепенно. Часто это происходит внезапно и проявляется ступором, судорогами или острой формой психоза.
Признаками начальной стадии является острый голод, тремор рук, вегетативные нарушения. Если сразу не купировать развитие гипогликемии углеводами (продуктами питания или введением глюкозы), приступ продолжит развиваться. Появится:
- профузное потоотделение,
- дрожь в теле,
- диплопия (двоение перед глазами),
- неподвижный взгляд,
- гемиплегии.
Возможно развитие психического состояния, напоминающего алкогольное опьянение: неспособность ориентироваться, галлюцинации. Если состояние не нормализовать, возникает рвота, судорожный синдром с клоническими и тоническими судорогами, спутанность сознания, кома. Повторные приступы приводят к деградации личности.
Симптоматика хронической гипогликемии
Хроническая гипогликемия проявляется слабостью, апатией, ощущением беспричинной усталости, разбитости, постоянной сонливости при обычном режиме сна, головными болями, невозможностью сосредоточиться. Симптомы выражены неярко, клиническая картина напоминает гипотиреоз. Обычно пациент не обращается к врачу, начало заболевания пропускается. Патология принимает хронический характер. Каждый симптом со временем нарастает.
Предвестниками гипогликемического приступа являются потливость, тремор, тревога, сердцебиение, падение АД, сильное чувство голода. Состояние можно прервать, приняв глюкозу.
Гипофункция поджелудочной железы
Поскольку главным гормоном ПЖ, от которого зависят сохранность и нормальное функционирование других органов, является инсулин, сниженная функция β-клеток приводит к необратимым изменениям в организме. Нарушаются все виды обмена веществ: снижается синтез белка, липогенез и глюконеогенез. Гипофункция ПЖ встречается гораздо чаще, чем повышенный синтез гормонов, проявляется сахарным диабетом.
Симптоматика гипофункции
Проявлением сниженной функции ПЖ является сахарный диабет. Он характеризуется:
- постоянной сухостью во рту,
- сильной жаждой,
- полиурией (выделением большого количества мочи),
- потерей веса,
- постоянной утомляемостью и слабостью.
Если не проводится адекватное лечение или нарушается диета, заболевание прогрессирует, развиваются осложнения: поражаются практически все органы и системы. Особенно страдают почки, глаза (может появиться слепота), сердечно-сосудистая и нервная система, нарушается кровоснабжение ног, развивается диабетическая стопа, гангрена. Самое опасное осложнение — это диабетическая кома.
Сахарный диабет при гипофункции инсулина с учетом механизма поражения разделяется на 2 типа:
- инсулинозависимый (тип I) — вызван разрушением β-клеток, характеризуется абсолютным дефицитом инсулина (у 10% больных),
- инсулинонезависимый (тип II) — развивается у тучных людей, при гиподинамии, стрессе, имеющейся генетической предрасположенности, связан с нарушением чувствительности рецепторов к инсулину.
Гипофункции гормонов
Гипофункция гормонов при поражении ПЖ наблюдается чаще и проявляется нарушением выработки инсулина, как следствие — сахарного диабета. В настоящее время структура и свойства инсулина изучены, он синтезирован и широко применяется в лечении этой патологии. Это дает возможность продлить жизнь пациентам. Но принимать заместительную инсулинотерапию и соблюдать специальную диету больным приходится всю жизнь.
Методы диагностики нарушения функций ПЖ
При подозрении на нарушение функции ПЖ необходимо тщательное обследование. Из лабораторных методов назначаются при инсулиноме:
- анализ крови и мочи на сахар,
- при необходимости — дополнительные нагрузочные тесты с углеводным завтраком, инсулином,
- в период спонтанного приступа инсулиомы определяется уровень инсулина в крови.
Используются функциональные методы:
- УЗИ ОБП и ЗП — для обнаружения опухоли и изменений в соседних органах, если они есть,
- КТ — если возникли сомнения при проведении ультразвукового исследования.
При диагностике глюканомы:
- сахар крови и мочи,
- глюкагон в крови.
При гастриноме:
- кровь на гастрин натощак,
- рентгенологическое и эндоскопическое исследование для выявления язв в слизистой желудка и кишечника,
- кислотность желудочного сока.
Локализация опухоли определяется стандартно, как при инсулиноме.
Лечение заболевания
Опухоли (инсулиомы) лечат хирургическим путем, используя следующие методы:
- энуклеацию — успешно применяется на ранних этапах заболевания,
- дистальную резекцию ПЖ,
- лапароскопию.
Гастриному лечат препаратами, подавляющими секрецию соляной кислоты:
- ИПП (ингибиторы протонной помпы) — Пантапразол, Рабепразол, Омепразол,
- блокаторы Н2 -рецепторов — Циметидин, Ранитидин, Фамотидин.
В тяжелых случаях применяется оперативное вмешательство — гастрэктомия.
Для лечения гипофункции, проявляющейся низким сахаром в крови, необходима углеводная диета, введение глюкозы, при диагностике опухоли — оперативное лечение, курс химиотерапии. Возможно назначение препаратов, подавляющих инсулин, — Диазоксид, Октреотид и гормон ПЖ — Глюкагон. Лекарственные средства, снижающие инсулин, ухудшают внешнесекреторную функцию ПЖ, поэтому одновременно рекомендуется ферментная терапия.
В терапии сахарного диабета используются инсулин, сахароснижающие препараты, строгая диета — стол № 9 по Певзнеру. При назначенном инсулине пациента обучают пользоваться специальной таблицей с указанием углеводного содержания продуктов, количества условных хлебных единиц, по которым можно рассчитать необходимую дозу инсулина при нарушении в питании.
Осложнения нарушения функции гормонов
Если функция ПЖ снижена, уменьшена выработка инсулина и развивается сахарный диабет, при отсутствии адекватного лечения или нарушении диеты заболевание прогрессирует. Развиваются осложнения, при которых поражаются сосуды и ткани практически всех органов и систем. Очень страдают почки, глаза (может появиться слепота), сердечно-сосудистая и нервная система, нарушается кровоснабжение ног, развивается диабетическая стопа, гангрена. Самое тяжелое осложнение — диабетическая кома.
Вылечить полностью нарушения функций поджелудочной железы невозможно, но при своевременном обращении и раннем терапевтическом или хирургическом лечении можно улучшить качество жизни, а в некоторых случаях — сохранить ее.
Тест: на определение риска сахарного диабета 2 типа
Источник
Гиперфункция поджелудочной железы
Гипофункция поджелудочной железы
При недостаточной секреции инсулина развивается сахарный диабет. Выделяют два типа сахарного диабета: инсулинзависимый (тип I) и инсулиннезависимый (тип II).
Инсулинзависимыйсахарный диабет (у 10% больных) – заболевание, вызываемое разрушением β-клеток островков Лангерганса. Характеризуется абсолютным дефицитом инсулина.
Инсулиннезависимыйсахарный диабет (у 90% больных) развивается чаще всего у тучных людей. Основная причина – снижение чувствительности рецепторов к инсулину, повышенная скорость катаболизма инсулина, нарушение регуляции секреции гормона. При этом уровень инсулина в крови – в норме. Факторы риска развития заболевания – генетическая предрасположенность, ожирение, гиподинамия, стресс.
Симптомы сахарного диабета: гипергликемия – повышение концентрации глюкозы в крови; глюкозурия–выведение глюкозы с мочой; кетонемия– повышение в крови концентрации кетоновых тел; кетонурия– выведение кетоновых тел с мочой;полиурия– возрастает суточный диурез (в среднем до 3-4 л).
Накопление кетоновых тел снижает буферную емкость крови, что приводит к ацидозу. Активируются катаболические процессы: распад белков, липидов, гликогена; повышается концентрация в крови аминокислот, жирных кислот, липопротеинов.
Инсулинома – опухоль β-клеток островков Лангерганса, сопровождается повышенной выработкой инсулина, выраженной гипогликемией, судорогами, потерей сознания. При крайней степени гипогликемии может наступить смертельный исход. Устранить гиперинсулинизм можно введением глюкозы и гормонами, повышающими уровень глюкозы (глюкагон, адреналин).
Глюкагон – одноцепочечный полипептид, состоящий из 29 аминокислотных остатков. Синтезируется в α-клетках островков Лангерганса, в нейроэндокринных клетках кишечника. Эффекты глюкагона в основном противоположны эффектам инсулина.
Основные клетки-мишени глюкагона – печень, жировая ткань, корковое вещество почек.
В печени гормон ускоряет мобилизацию гликогена, вызывает торможение гликолиза, стимулирует глюконеогенез, активирует синтез кетоновых тел. Глюкагон угнетает в печени синтез белков и облегчает их катаболизм. Образующиеся аминокислоты используются в синтезе глюкозы (глюконеогенез).
В жировой ткани глюкагон ускоряет мобилизацию триацилглицеролов, что приводит к повышению уровня жирных кислот и глицерола в крови.
В корковом веществе почек глюкагон активирует глюконеогенез.
Главный эффект – повышение содержания глюкозы в крови – обеспечивают два механизма: быстрый (распад гликогена) и медленный (глюконеогенез).
Глюкагонома – опухоль α-клеток островков Лангерганса. Основной симптом – гипергликемия.
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Как то на паре, один преподаватель сказал, когда лекция заканчивалась — это был конец пары: «Что-то тут концом пахнет». 8181 — | 7872 — или читать все.
91.146.8.87 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
Внутри поджелудочной железы расположены островки Лангерганса, которые морфологически отличаются от ткани, отделяющей поджелудочный сок. Клетки островков более густо оплетены кровеносными капиллярами и отдельно снабжаются нервными волокнами.
У человека насчитывают 210-1750 тыс. островков Лангерганса.
В филогенезе и онтогенезе внутрисекреторные элементы железы развиваются раньше, чем внешнесекреторные.
В островках Лангерганса имеются 3 рода клеток: альфа, бета и гамма. Гранулы бета-клеток растворяются в спирте, а гранулы альфа-клеток не растворяются. Бета-клеток в 3,5-4 раза больше, чем альфа-клеток. У новорожденных количество альфа- и бета-клеток одинаково. Инсулин образуется в бета-клетках. Поджелудочная железа крупного рогатого скота содержит около 150 мг инсулина на 1 кг массы железы. У человека секретируется примерно 2 мг инсулина в сутки.
А. И. Яроцкий (1898) наблюдал у животных, которых он кормил сахаром, уменьшение островков Лангерганса. На этом основании он заключил, что островки «представляют самостоятельные органы».
Л. В. Соболев (1901) доказал, что островки являются органами внутренней секреции.
Бантинг и Бест (1921) получили активный гормон инсулин.
Активный инсулин получен в чистой кристаллической форме. Химическую природу инсулина установил Сенджер (1945 — 1956). Это сложный полипептид. Инсулин содержит легко отщепляемую серу. Белковая природа инсулина объясняет, почему он не действует при применении его внутрь через рот и почему он разрушается трипсином. Он обладает видовой специфичностью, т. е. имеются некоторые различия его строения у разных животных. В его образовании участвует цинк.
Физиологический механизм действия инсулина недостаточно изучен. Основное действие инсулина состоит в повышении использования глюкозы тканями, в переходе глюкозы из крови и тканевой жидкости внутрь клеток, повышении ассимиляции и сгорания сахара в них вследствие активации фермента глюкокиназы. Инсулин увеличивает проницаемость клеток для глюкозы и усвоение сахара мышцами, задерживает воду в тканях, активирует синтез белков из аминокислот и уменьшает образование углеводов из белка и жира. При действии инсулина в мембранах мышечных и нейронов открываются поры для прохождения внутрь природного сахара, что уменьшает его содержание в крови. Введение инсулина увеличивает отложение сахара в печени и в мышцах в виде гликогена и тормозит переход гликогена в сахар. Малые дозы инсулина повышают дыхательный коэффициент выше единицы. что указывает на переход углеводов пищи в жиры, накапливающиеся в жировой ткани. Поэтому инсулин дается истощенным людям для повышения массы тела.
После введения инсулина здоровому животному получается резкая гипогликемия. Когда содержание глюкозы в крови падает ниже 0.045%, учащается дыхание и наступает общее возбуждение; вследствие возбуждения двигательных центров варолиевого моста и продолговатого мозга развиваются судороги. Тяжелые явления инсулиновой гипогликемии почти моментально исчезают после введения глюкозы.
Следовательно, на углеводный обмен инсулин действует противоположно адреналину. Таким образом, инсулин и адреналин регулируют относительное постоянство содержания глюкозы в крови. Инсулин применяется для лечения диабета.
Адреналин увеличивает секрецию инсулина, а поступление в кровь инсулина увеличивает секрецию адреналина. Длительное введение инсулина ослабляет активность островков Лангерганса и усиливает деятельность мозгового слоя надпочечников. При отравлении инсулином клетки коркового вещества надпочечников теряют своп липиды. В альфа-клетках образуется глюкагон, который действует противоположно инсулину. Химическую природу глюкагона установил Сенджер (1945 — 1956).
Введение глюкагона сопровождается повышением содержания сахара в крови, что объясняется усиленным расщеплением гликогена печени вследствие активации фермента фосфорилазы. Значение глюкагона, возможно, заключается в том, что благодаря своему гипергликемическому действию он предупреждает значительное снижение уровня сахара в крови в тех случаях, когда усиливается образование инсулина. В эпителии мелких протоков поджелудочной железы образуется гормон липокаин, предупреждающий ожирение печени.
У взрослого организма инсулин выделяется непрерывно. Зародыш млекопитающих вначале получает инсулин с кровью матери через плаценту, а затем во второй половине беременности у него образуется собственный инсулин. В это время удаление железы у матери не вызывает у нее диабета, но он наступает у нее сразу же после родов.
Существуют два механизма регуляции секреции инсулина: нервный и нервно-гуморальный. Островки Лангерганса иннервируются блуждающими и симпатическими нервами. Раздражение ветвей обоих блуждающих нервов вызывает приток к железе эфферентных импульсов, что возбуждает секрецию инсулина — это определяется по уменьшению количества глюкозы в крови.
Симпатические нервы тормозят отделение инсулина. Железа, пересаженная в другое место, т. е. полностью денервированная, сохраняет способность вырабатывать инсулин. Повышение содержания сахара в крови возбуждает секрецию инсулина и одновременно тормозит секрецию глюкагона. Уменьшение секреции глюкагона уменьшает содержание сахара в крови. Оба гормона действуют на углеводный обмен, активируя ферменты. Следовательно, внутренняя секреция железы регулируется уровнем сахара в крови, а возможно, и содержанием в крови инсулина.
На введение в кровь инсулина вырабатываются условные рефлексы. Измененный состав крови через посредство нервной системы регулирует секрецию инсулина. При гипергликемии секреция инсулина повышается, а при гипогликемии понижается. Секреция инсулина увеличивается при поступлении углеводов в кровь во время пищеварения и уменьшается натощак. Кроме того, на секрецию инсулина влияет еще гормон передней части аденогипофиза.
Вещество, действующее аналогично инсулину, образуется также в слюнных железах (С. И. Гальперин и Н. П. Коханович, 1940, 1947).
Регуляция обмена углеводов посредством инсулиноподобных веществ широко распространена в природе, включая и растения. Источником инсулина могут служить и вещества растений. Сахарный диабет значительно легче протекает при преимущественно растительной пище, так как в растительных продуктах содержатся вещества, обладающие инсулиноподобным действием. По содержанию инсулиноподобных веществ растительные продукты располагаются в следующий ряд: овес > бобы > чечевица > горох > рис > пшеница и картофель.
Липокаин тормозит ожирение печени при диабете путем повышения окисления высших жирных кислот и образования в ней фосфолипидов. Он получен из поджелудочной железы крупного рогатого скота после извлечения инсулина.
Из экстракта поджелудочной железы извлечен также калликреин, или падутин. Он может быть получен и путем химической обработки мочи, с которой он удаляется из организма. Калликреин очень нестоек и разрушается при подогревании выше 60°С, а также под действием кислот, щелочей и алкоголя. Понижает кровяное давление, расширяя артериолы и капилляры.
В поджелудочной железе образуется также гормон ваготонин, повышающий активность парасимпатической системы, и гормон центропнеин, возбуждающий дыхательный центр и способствующий переносу кислорода гемоглобином.
Гипофункция и гиперфункция поджелудочной железы
Удаление поджелудочной железы у собак было впервые осуществлено Мерингом и О. Миньковским (1889). После полного удаления поджелудочной железы через короткое время наступает смерть. После удаления железы и при ее гипофункции наблюдается тяжелое и трудноизлечимое заболевание человека и животных, известное под именем сахарного мочеизнурения, или сахарного диабета. Сахарное мочеизнурение наступает уже через несколько часов после удаления поджелудочной железы. Несмотря на прожорливость и жажду, животные с удаленной поджелудочной железой имеют сильно истощенный вид. После смерти больных сахарным диабетом при вскрытии почти всегда находят изменения в ткани островков Лангерганса.
Инсулин адсорбируется и сохраняется на поверхности оболочек свыше 60% от общего числа эритроцитов. Поэтому уменьшение число эритроцитов, переносящих инсулин, позволяет обнаружить дефицит инсулина на ранних стадиях сахарного диабета.
Гиперфункция поджелудочной железы связана, как правило, с развитием в ней опухолей. При достаточном количестве углеводов в пище у больного постоянно понижено количество сахара в крови (гипогликемия). При резкой гипогликемии, когда содержание глюкозы в крови уменьшается на 1/3-1/4 нормального, наступают мышечные подергивания, а затем потеря сознания. Эти явления гипогликемии проходят через несколько минут после введения раствора глюкозы в вену.
При недостаточной секреции инсулина развивается сахарный диабет. Выделяют два типа сахарного диабета: инсулинзависимый (тип I) и инсулиннезависимый (тип II).
Инсулинзависимыйсахарный диабет (у 10% больных) – заболевание, вызываемое разрушением β-клеток островков Лангерганса. Характеризуется абсолютным дефицитом инсулина.
Инсулиннезависимыйсахарный диабет (у 90% больных) развивается чаще всего у тучных людей. Основная причина – снижение чувствительности рецепторов к инсулину, повышенная скорость катаболизма инсулина, нарушение регуляции секреции гормона. При этом уровень инсулина в крови – в норме. Факторы риска развития заболевания – генетическая предрасположенность, ожирение, гиподинамия, стресс.
Симптомы сахарного диабета: гипергликемия – повышение концентрации глюкозы в крови; глюкозурия–выведение глюкозы с мочой; кетонемия– повышение в крови концентрации кетоновых тел; кетонурия– выведение кетоновых тел с мочой;полиурия– возрастает суточный диурез (в среднем до 3-4 л).
Накопление кетоновых тел снижает буферную емкость крови, что приводит к ацидозу. Активируются катаболические процессы: распад белков, липидов, гликогена; повышается концентрация в крови аминокислот, жирных кислот, липопротеинов.
Гиперфункция поджелудочной железы
Инсулинома – опухоль β-клеток островков Лангерганса, сопровождается повышенной выработкой инсулина, выраженной гипогликемией, судорогами, потерей сознания. При крайней степени гипогликемии может наступить смертельный исход. Устранить гиперинсулинизм можно введением глюкозы и гормонами, повышающими уровень глюкозы (глюкагон, адреналин).
ГЛЮКАГОН
Глюкагон – одноцепочечный полипептид, состоящий из 29 аминокислотных остатков. Синтезируется в α-клетках островков Лангерганса, в нейроэндокринных клетках кишечника. Эффекты глюкагона в основном противоположны эффектам инсулина.
Основные клетки-мишени глюкагона – печень, жировая ткань, корковое вещество почек.
В печени гормон ускоряет мобилизацию гликогена, вызывает торможение гликолиза, стимулирует глюконеогенез, активирует синтез кетоновых тел. Глюкагон угнетает в печени синтез белков и облегчает их катаболизм. Образующиеся аминокислоты используются в синтезе глюкозы (глюконеогенез).
В жировой ткани глюкагон ускоряет мобилизацию триацилглицеролов, что приводит к повышению уровня жирных кислот и глицерола в крови.
В корковом веществе почек глюкагон активирует глюконеогенез.
Главный эффект – повышение содержания глюкозы в крови – обеспечивают два механизма: быстрый (распад гликогена) и медленный (глюконеогенез).
Глюкагонома – опухоль α-клеток островков Лангерганса. Основной симптом – гипергликемия.
No related posts.
No related posts.
Источник

