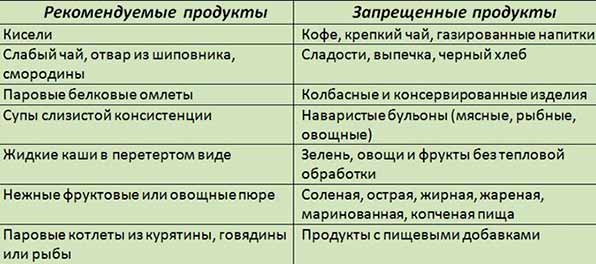
У крысы в печени поджелудочной железе и сердце
Учёные впервые доказали на практике, что органы, выращенные в организме особей другого вида, могут не только успешно прижиться после пересадки, но и вылечить такое тяжёлое заболевание как диабет. Новое исследование, опубликованное в журнале Nature, является важной вехой на пути к медицине будущего.
Сегодня множество пациентов с самыми разными заболеваниями стоят в очереди на трансплантацию донорских органов. Дефицит вызван тем, что лишь в трёх случаях из тысячи люди умирают таким образом, что их органы могут быть использованы для пересадки. Но в обозримом будущем ситуация может в корне измениться, и любой человек сможет на заказ вырастить необходимый орган из собственных клеток.
Исследования в этой области активно ведутся в научных центрах по всему миру. Учёные давно научились выращивать полностью функционирующие органы и ткани в пробирках с использованием перепрограммированных стволовых клеток. Но, когда речь идёт о больших органах со сложной трёхмерной структурой и собственными запасами крови, получить их в лабораторных условиях невероятно сложно. И тогда в качестве живых инкубаторов используют животных.
В настоящее время большинство подобных экспериментов проводится на мышах и крысах, в телах которых уже выращивали миниатюрные копии человеческих почек, вилочковую и поджелудочную железы.
В одной из предыдущих работ биологи получали поджелудочную железу крысы в теле мыши, а затем успешно пересаживали её крысам, больным диабетом. Но в тот раз вылечить животных не получилось, потому что железы оказались меньшего размера и содержали слишком мало панкреатических островков, где производится инсулин и другие гормоны.
На этот раз команда из Стэнфордского и Токийского университетов, работающая под руководством Хиромицу Накаучи (Hiromitsu Nakauchi), решила перевернуть эксперимент с ног на голову и выращивать мышиные железы в организме крыс.
Для этого они изменили гены крыс таким образом, чтобы у их потомства не формировалась собственная поджелудочная железа. Через несколько дней после зачатия в крошечные эмбрионы крыс вводили стволовые клетки мышей. В итоге крысята ничем не отличались от своих обыкновенных сородичей за исключением того, что их поджелудочные железы по большей части состояли из мышиных клеток. Таких животных называют химерами.
Крысы взрослели, исследователи умерщвляли их и аккуратно удаляли из их тел поджелудочную железу, которую затем пересаживали мышам, страдающим от диабета. Чтобы полностью исключить влияние крысиного наследия на результаты эксперимента, учёные ограничились лишь кратким пятидневным курсом иммунодепрессантов, которые вводили животным после пересадки, чтобы предотвратить отторжение новых тканей. После того как искусственное угнетение иммунной системы прекращалось, организм мышей очень быстро очищался от клеток крыс.
В течение года после операции уровень глюкозы в крови больных мышей приходил в норму.
«Мы обнаружили, что у мышей с диабетом уровень глюкозы нормализовался после трансплантации всего лишь 100 панкреатических островков, – говорит Накаучи в пресс-релизе Стэнфорда. – Кроме того, после пересадки животные-реципиенты нуждались лишь в пятидневном лечении иммуносупрессивными препаратами, что гораздо короче, чем существующие курсы при пересадке органов».
Авторы работы также отмечают, что в ходе их экспериментов у крыс не наблюдалось никаких признаков образования опухолей или других отклонений, которые ранее становились проблемой при использовании чужеродных плюрипотентных стволовых клеток в организме животного.
Уже сейчас исследователи ведут работу и над выращиванием в организме крысы других мышиных органов – печени, почек и лёгких.
Разумеется, для реального производства почек или печени человека будут использованы не мыши – лучше всего для этой цели подходят свиньи и овцы, так как их органы по размеру сходны с человеческими. Об этой технологии и прорывах в её использовании корреспонденты «Вести.Наука» расскажут в следующем материале.
Источник
Modulatory effect of polyphenolic extracts of Ichnocarpus frutescens on oxidative stress in rats with experimentally induced diabetes
Источник: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3573603/
Изучена роль окислительного стресса в развитии сахарного диабета и его сосудистых осложнений. Гипергликемия вызывает окислительный ущерб путем образования активных форм кислорода и приводит к развитию осложнений. Настоящее исследование было проведено с целью изучения антигипергликемического потенциала полифенольного обогащенного экстракта Ichnocarpus frutescens у индуцированных стрептозотоцином (n-STZ) неонатальных диабетических крыс (щенков) в течение шести недель и изучения окислительного стресса и антиоксидантного статуса.
Двухдневные щенки были подвергнуты диабетической однократной инъекции стрептозотоцина (90 мг / кг массы тела, внутрибрюшинно). В конце периода лечения измеряли уровень глюкозы в крови, биохимические маркеры в сыворотке крови, уровни липидов в сыворотке крови и уровень малдоальдегида в печени, уровень антиоксидантов в тканях.
Заметный рост наблюдался на уровнях глюкозы натощак натощак (230,33 мг / дл), липидных профилей, пероксидативных продуктов липидов и значительного снижения тканевых антиоксидантов (супероксиддисмутазы, каталазы и восстановленного глутатиона) и уровней холестерина липопротеинов высокой плотности сыворотки в STZ обработанных крыс. Пероральное введение полифенольного экстракта (150 и 300 мг / кг массы тела, по) уменьшало уровень глюкозы в крови натощак (187,66 и 170,50 мг / дл соответственно) у пациентов с диабетом, получавших STZ, значительно (P
Наше исследование показало, что антиоксидант эффекта полифенольного экстракта I. frutescens в STZ индуцирует экспериментальный диабет. Результаты также предположили, что этот экстракт полифенольного богача может быть потенциально полезен при лечении гипергликемией для коррекции диабетического состояния.
Сахарный диабет является самым быстрорастущим метаболическим расстройством в мире и одной из основных причин заболеваемости в развивающихся странах1. Показано, что сахарный диабет связан с повышенным окислительным стрессом, что может быть следствием либо увеличения производства свободных радикалов, либо снижения антиоксидантной защиты2. Кислородные свободные радикалы непропорционально формируются при сахарном диабете путем окисления глюкозы, неферментативной гликирования белков и последующей деградации гликозилированных белков. Диабетические осложнения также связаны с перепроизводством свободных радикалов и накоплением побочных продуктов перекисного окисления липидов. Усиленный окислительный стресс хорошо документирован как в экспериментальном, так и в человеческом сахарном диабете3. Таким образом, была предпринята попытка уменьшить окислительный стресс у пациента с диабетом путем добавления природных антиоксидантов4. Основными целями антиоксидантного лечения были снижение окислительного стресса путем предотвращения или замедления прогрессирования или отмены осложнений диабета. Лекарственные растения часто содержат значительное количество антиоксидантов, таких как полифенолы, флавоноиды, антоцианы и дубильные вещества.
Ichnocarpus frutescens L. Br. (общее название: Sarsaparilla, местное название: Paalvalli; Family: Apocynaceae) используется как народная медицина и как ингредиент в аюрведических и унани для лечения заболеваний крови, кожи, головной боли, укуса змей и воспаления. Листья I. frutescens богаты полифенолами и флавоноидами. Распространение различных соединений фенольной кислоты и флавоноидов в листьях I. frutescens систематически изучено и хорошо документировано56. Отвар листьев I. frutescens используется при лечении желтухи и диабета, и эти растения также используются племенами Карнатака и Уттера Прадеш для лечения диабета и желтухи7. Наши более ранние исследования показали гепатопротекторные, антигиперлипидемические, антиоксидантные свойства in vitro и ослабление диабетических осложнений с I. frutescens89. Это исследование было проведено для оценки антиоксидантного потенциала экстракта, обогащенного полифенолом (PPE) I. frutescens при диабете, индуцированном стрептозотоцином, у крыс Wistar у новорожденных (n-STZ) II типа.
Химические вещества и инструменты: Стрептозотоцин (STZ) был приобретен у Sigma Chemical Co (MO, США). Глибенкламид и пентобарбитоновый натрий были приобретены в Ranbaxy Laboratories, Индия. Антронный реагент, бычий сывороточный альбумин (BSA), тиобарбитуровая кислота, восстановленный глутатион (GSH), нитроцеллюлозный тетразолий, трихлоруксусная кислота, никотинамидадениндинуклеотид (NADH), реагент Эллмана [5,5′-дитиобис- (2-нитробензойная кислота)] были приобретенных у SISCO Research Laboratories Private Limited, Мумбаи, Индия. Комплексы биохимического анализа сыворотки для аспартатаминотрансферазы (АСТ), аланинаминотрансферазы (АЛТ), щелочной фосфатазы (АЛП), общего билирубина, общего холестерина (ТС), триглицеридов (ТГ) и общего белка были приобретены у Span Diagnostics Limited, Мумбаи, Индия. Уровни глюкозы в крови натощак (FBG) оценивали по реакционноспособным полоскам глюкозооксидазы пероксидазы (Accu-chek, Roche Diagnostics, USA). Все другие химикаты и растворители имели аналитический сорт. Используемое оборудование — ультрафиолетовый спектрофотометр (Spekol 1200, Япония), гомогенизатор (Remi, Индия), холодная центрифуга (Remi, Индия), pH-метр (Systronics, Индия), ротационный вакуумный испаритель (Superfit, Индия), лиофилизатор (Instrumentation India, Индия) и световой микроскоп (Киова, Япония).
Растительные материалы: свежие листья I. frutescens были собраны в дельте реки Каувери, Тиручипаппалли, Индия, в феврале 2005 года и заверены в Ботаническом обзоре Индии, Центральном национальном гербарии Хавра, Индия (Ref No: CNH / I -I / 87/2005-TECH / 1326). Оригинальный образец ваучера был помещен в Гербарий отдела фармакогнозии, научно-исследовательской лаборатории фитотерапии, кафедра фармацевтической технологии, Университет Джадавпур, Калькутта, Индия.
Экстракция экстракта, обогащенного полифенолом (PPE): Листья сушили на воздухе в течение одного недель при комнатной температуре без воздействия солнечного света и грубо напудренной. Листовый порошок (300 г) мацерировали в течение 5 дней при комнатной температуре три раза с 800 мл гидро-спиртовой смеси (двойная дистиллированная вода: 99% абсолютного спирта, 30: 70 об.% Об.). Три мацерата объединяли и концентрировали, используя роторный испаритель при пониженном давлении при температуре
Животные: 2-дневная крыса Wistar (M / s Ghosh Enterprises, Калькутта, Индия) размещалась со своей соответствующей матерью в клетках макролона в стандартных лабораторных условиях. Мать крыс кормили коммерческой диеты от Hindustan Lever Ltd (Бангалор, Индия) и свободного доступа к воде во время экспериментов. Протокол исследования был одобрен Институциональным комитетом по этическим вопросам (IAEC) Университета Джадавпур, Калькутта, Индия.
Индукция экспериментального диабета типа II: щенки крысы Wistar (n = 40) вводили (ip) с 90 мг / кг STZ в 0,9% раствор хлорида натрия. Контрольные щенки получали эквивалентный объем только 0,9% раствора хлорида натрия. Через двенадцать недель после инъекции STZ животные с FBG> 150 мг / дл считались неонатальными STZ (n-STZ) -диабетическими10. Эти животные были разделены на пять групп. Обработанный контроль (глибенкламид 600 мкг / мг) и обработанные диабетические крысы получали полифенольный экстракт (150 и 300 мг / кг, перорально) в течение шести недель.
После последней обработки полифенольного экстракта (после 6 недель) крыс голодали в течение ночи и умерщвляли при обезболивании шейки матки. Собирают кровь и используют сыворотку для оценки биохимических параметров. Печень, почка, поджелудочная железа и сердечные ткани были немедленно вырезаны и хранятся в ледяных контейнерах. Ткани гомогенизировали соответствующим буфером, центрифугировали и собирали супернатант. Оценки антиоксидантов в тканях проводились в гомогенатах в тот же день жертвоприношений.
Анализ биохимических параметров: уровни FBG были оценены реакционноспособными полосками глюкозооксидазы пероксидазы11 (Accu-Chek, Roche Diagnostics, USA). Оцениваемыми биохимическими параметрами были сывороточные липидные профили 1213 (ТГ и ТС), биомаркеры печени, такие как билирубин14, АСТ15, АЛТ15 и АЛП16, общий белок сыворотки17 с использованием диагностических наборов. Высокий уровень холестерина липопротеина18 (HDL-C) и холестерин липопротеинов низкой плотности19 (LDL-C) оценивали стандартными методами с использованием спектрофотометрического метода.
Анализ тканевых антиоксидантных ферментов: гликоген печени оценивали стандартным методом и выражали в мг / г ткани печени20. Реактивные вещества тиобарбитуровой кислоты (TBARS) и GSH2122 оценивались во всех тканях (печень, сердце, поджелудочная железа и почка). Кроме того, активность антиоксидантных ферментов, таких как супероксиддисмутаза (SOD) и каталаза (CAT), анализировали стандартными методами2324.
Гистопатологические исследования: для гистопатологических исследований крысы контрольных и экспериментальных групп перфузировали 10% -ным раствором нейтрального формалина. Поджелудочная железа немедленно удалялась от крысы; парафиновые срезы толщиной 5 мкм и окрашивали окрашиванием гематоксилин-эозин (H & E). После окрашивания участки наблюдались под световым микроскопом.
Статистический анализ: данные статистически оценивались с использованием одностороннего анализа дисперсии (ANOVA), а затем с использованием теста Dunnett t-test с использованием программного обеспечения GraphadInstat Statistical версии 4.01 (San Diego, CA, USA).
В таблицах I и II показаны изменения уровня FBG, TG, TC, AST, ALT, ALP и общего белка в нормальной и экспериментальной группах крыс. Наблюдалось значительное повышение уровня FBG, AST, ALT, ALP, TGs, TC, LDL-C, и в то время как уровни HDL-C, белка уменьшались во время диабета по сравнению с контрольной группой. Введение полифенольного экстракта приводило к уровням до почти нормальных значений, чем уровень стандартного лекарственного глибенкламида. Стрептозотоцин индуцированные диабетические крысы показали значительное снижение массы тела по сравнению с нормальными крысами. Оральное введение экстракта полифенола показало значительное увеличение (Р
Влияние полифенольных экстрактов I. frutescens на глюкозу крови натощак и массу тела на стрептозотоцин-индуцированных новорожденных диабетических крыс
Влияние полифенольных экстрактов I. frutescens на биохимические параметры сыворотки и уровни гликогена в печени у новорожденных диабетических крыс, индуцированных стрептозотоцином
Антиоксидантные ферменты SOD, CAT и неферментативные уровни GSH определяли в печени, поджелудочной железе, сердце и почках диабетических и диабетических крыс, получавших полифенольный экстракт и глибенкламид (таблица III). У крыс с отрицательным контролем были обнаружены самые высокие уровни антиоксидантов в печени, за которыми следуют почка, сердце и поджелудочная железа. В диабетической печени крыс, поджелудочной железы, сердца и почек уровни СОД, КПП и GSH значительно снижались по сравнению с контрольными крысами с возрастом. Лечение полифенольным экстрактом нормализовало измененные уровни антиоксидантов всех тканей, возникающие из-за болезней.
Влияние полифенольных экстрактов I. frutescens на ткани антиоксидантных ферментов и уровней перекисного окисления липидов у индуцированных стрептозотоцином новорожденных диабетических крыс
Уровни пероксида липидов значительно повышались в печени, сердце, почках и поджелудочной железе у крыс, обработанных STZ. Полифенольный экстракт способствовал изменению измененного пероксидативного повреждения до почти нормальных значений (табл. III).
Участок крыс, не обработанных диабетом, показал нормальную архитектуру поджелудочной железы (рис. А), и у этих животных не наблюдалось гистопатологических изменений. Поджелудочная секция от контрольных диабетических крыс (рис. Б) показала минутное и уменьшенное количество островков. Раздел из обработанных полифенольным экстрактом диабетических крыс показал регенерацию крошечных островков (рис. С), которые могли быть сопоставимы с таковыми у недиабетических контрольных крыс. Эти гистологические наблюдения показали защитную роль полифенольного экстракта на поджелудочной железе у индуцированных STZ диабетических крыс.
(a) Участок поджелудочной железы недиабетической крысы, показывающий нормальные островки (→). (Б). Участок поджелудочной железы диабетической контрольной крысы, показывающий минутные островки (→) с нарушенным расположением. (С). Участок поджелудочной железы диабетической крысы, обработанной СИЗ, демонстрирует извлечение просветов и их расположение (→), которые сопоставимы с таковой у недиабетической крысы (a-c: H & E stain, 100 X).
Целью настоящего исследования было продемонстрировать эффективность полифенольного экстракта в снижении уровня FBG, а также определить восстановление в измененных биохимических переменных индикативного окислительного стресса и различных повреждений органов у крыс с индуцированным СТЗ диабетом. Высокие уровни FBG крови наблюдались у крыс, обработанных STZ, что указывало на установление диабетического состояния, опосредованного окислительным стрессом25. Администрация градуированной дозы полифенольного экстракта значительно уменьшала концентрацию FBG по сравнению с диабетическим контролем. Пероральное введение полифенольного экстракта приводило к значительному снижению ТС и ТГ сыворотки. Содержимое TGs, TC и VLDL-C в плазме зарегистрировало значительный поход в группу диабетической контрольной группы, которая была восстановлена почти до нормального уровня в группах, обработанных полифенольным экстрактом. Это наблюдение указывает на потенциал снижения липидов у I. frutescens.
Увеличение плазмы АЛТ, АСТ и АЛП наблюдаются в состоянии, при котором поджелудочная железа, почка и сердце разрушаются СТЗ. Более того, активность этих ферментов использовалась в качестве показателей тканевой токсичности при экспериментальном диабете. Повышенные уровни АСТ, АЛТ и АЛП наблюдались у индуцированных STZ диабетических крыс в течение шести недель. Лечение полифенольным экстрактом показало потенциальную гепатопротекторную активность, о чем сообщалось в нашем раннем исследовании10.
Синтез гликогена в печени крыс и скелетных мышцах нарушается во время диабета26. Регулирование метаболизма гликогена происходит с помощью многофункциональной ферментной гликогенсинтазы и гликогенфосфорилазы, которые играют основную роль в метаболизме гликогена27. Восстановленный гликоген-хранилище у крыс с экспериментально индуцированным диабетом объясняется сниженной активностью гликогенсинтазы и повышенной активностью гликогенфосфорилазы. В настоящей работе экспериментальные диабетические крысы, обработанные полифенольным экстрактом и обработанными глибенкламидом группами, восстанавливали уровень гликогена в печени путем увеличения активности фермента гликогенсинтазы.
Измерение тканевой TBARS помогает оценить степень повреждения тканей и повышенное TBARS, наблюдаемое в различных тканях диабетической крысы, может быть связано с перепроизводством побочных продуктов перекисного окисления липидов и диффузией из поврежденных тканей28. Усиленные TBARS и уменьшенные антиоксиданты, наблюдаемые в печени, поджелудочной железе, сердце и почках диабетических крыс, можно объяснить увеличением процесса перекисного окисления липидов в биомембране и тем самым способствовать изменению статуса антиоксидантов29. Снижение реактивного вещества тиобарбитуровой кислоты (TBARS) различных тканей четко показало антиоксидантное свойство полифенольного экстракта. Эти данные свидетельствуют о том, что полифенольный экстракт может оказывать антиоксидантную активность и защищать ткань от перекисного окисления липидов.
В текущем исследовании активность SOD, CAT и GSH диабетической печени крыс, поджелудочной железы, сердца и почек значительно сократилась. Это может быть связано с образованием реакционноспособных кислородных свободных радикалов, которые сами могут уменьшить активность этих ферментов. Сниженный уровень глутатиона при диабете считается важным показателем повышенного окислительного стресса30.
Было показано, что флавоноиды являются потенциальными антиоксидантами при лечении индуцированного STZ окислительного стресса у диабетических крыс31. Возможно, что задержка STZ вызвала окислительный стресс в различных тканях крыс, обработанных полифенольным экстрактом, преимущественно из-за его антиоксидантной активности. Полифенольный экстракт I. frutescens также может действовать либо путем прямого удаления реактивных кислородных метаболитов из-за присутствия различных антиоксидантных соединений, либо путем увеличения уровня эндогенных антиоксидантных молекул или ферментов. Кроме того, для изучения механизма действия активного ингредиента (ов), ответственного за наблюдаемую антиоксидантную активность, необходимы фармакологические и химические исследования.
Авторы признают Всеиндийский совет технического образования (AICTE), Нью-Дели, правительство Индии, за предоставление первого докторского стипендии (NDF-AICTE) первому автору (ЧТК).
Источник